医薬品情報
| 総称名 | オンダンセトロン |
|---|---|
| 一般名 | オンダンセトロン塩酸塩水和物 |
| 欧文一般名 | Ondansetron Hydrochloride Hydrate |
| 製剤名 | オンダンセトロン塩酸塩水和物注射液 |
| 薬効分類名 | 5-HT3受容体拮抗型制吐剤 |
| 薬効分類番号 | 2391 |
| ATCコード | A04AA01 |
| KEGG DRUG |
D00678
オンダンセトロン塩酸塩水和物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年1月 改訂(第1版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| オンダンセトロン注射液4mg「サンド」 (後発品) | Ondansetron Injection 4mg[SANDOZ] | サンド | 2391401A1050 | 1289円/管 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対して過敏症の既往歴のある患者
4. 効能または効果
○抗悪性腫瘍剤(シスプラチン等)投与に伴う消化器症状(悪心、嘔吐)
5. 効能または効果に関連する注意
本剤は強い悪心・嘔吐が生じる抗悪性腫瘍剤(シスプラチン等)の投与の場合に限り使用すること。
6. 用法及び用量
成人
通常、成人にはオンダンセトロンとして1回4mg、1日1回緩徐に静脈内投与する。なお、年齢、症状により適宜増減する。
また、効果不十分な場合には、同用量を追加投与できる。
また、効果不十分な場合には、同用量を追加投与できる。
小児
通常、小児にはオンダンセトロンとして1回2.5mg/m2、1日1回緩徐に静脈内投与する。なお、年齢、症状により適宜増減する。
また、効果不十分な場合には、同用量を追加投与できる。
また、効果不十分な場合には、同用量を追加投与できる。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 薬物過敏症の既往歴のある患者
9.1.2 消化管通過障害の症状のある患者
投与後観察を十分に行うこと。消化管運動の低下があらわれることがある。
9.3 肝機能障害患者
9.3.1 重篤な肝障害のある患者
本剤は主として肝臓で代謝されるので、血中濃度が上昇するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)において乳汁への移行が報告されている。
9.7 小児等
低出生体重児、新生児、乳児を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
血漿クリアランスの減少及び半減期の延長が認められているが、安全性、有効性に65歳以下の患者と差がないことから、高齢者で用法及び用量の調整は必要ないとの報告がある1)。なお、副作用が発現した場合には、副作用の程度と有効性を勘案し減量するなど適切な処置を行うこと。生理機能が低下していることがある。
10. 相互作用
相互作用序文
本剤は、肝チトクロームP-450(CYP3A4、CYP2D6及びCYP1A2)で代謝される。[16.4参照]
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
CYP2D6
薬物代謝酵素用語
CYP1A2
10.2 併用注意
| CYP3A4誘導作用を有する薬剤 フェニトイン カルバマゼピン リファンピシン 等 | 本剤の作用が減弱するおそれがある。 | 併用薬剤のCYP3A4誘導作用により、本剤のクリアランスが増大し血中濃度が低下する可能性がある。 |
| トラマドール | 本剤がトラマドールの鎮痛作用を減弱させるおそれがある。 | 本剤との併用によりトラマドールの鎮痛作用が減弱するとの報告がある。 |
| セロトニン作用薬 選択的セロトニン再取り込み阻害剤(SSRI) セロトニン・ノルアドレナリン再取り込み阻害剤(SNRI) MAO阻害剤 等 | セロトニン症候群(不安、焦燥、興奮、錯乱、発熱、発汗、頻脈、振戦、ミオクローヌス等)があらわれるおそれがある。 | セロトニン作用が増強するおそれがある。 |
| アポモルヒネ | 海外において、5-HT3受容体拮抗剤との併用により、重度の血圧低下、失神/意識消失、徐脈、けいれん発作が発現したとの報告がある。 | 機序は明らかではないが、アポモルヒネの副作用が増強されるおそれがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック(頻度不明)、アナフィラキシー(頻度不明)
11.1.2 てんかん様発作(頻度不明)
11.2 その他の副作用
| 1%以上 | 1%未満 | 頻度不明 | |
| 過敏症 | 発疹 | そう痒 | |
| 精神神経系 | ふるえ感、眠気、頭痛、頭重感 | ||
| 消化器 | 下痢、便秘 | ||
| 循環器 | 動悸 | 胸痛、徐脈、不整脈、低血圧 | |
| 肝臓 | AST、ALT、LDH、γ-GTP、総ビリルビン値等の上昇 | ||
| 注射部位 | 血管痛 | 発疹、蕁麻疹、そう痒、紅斑等の局所症状、静脈炎 | |
| その他 | 全身けん怠感、発汗、しゃっくり、顔面紅潮、発熱 | 熱感、不随意運動(眼球回転発作、ジストニー反応等の錐体外路様症状)、一過性の視覚障害(霧視、一過性盲等) |
13. 過量投与
海外臨床試験において、オンダンセトロン32mgを15分かけて単回静脈内投与したとき、QTcF間隔の延長が認められ、最大平均変化量(90%信頼区間上限)は投与終了5分後に19.6(21.5)msecであった2)。また、海外において、小児が誤って過量服用し、セロトニン症候群が認められたとの報告がある。
14. 適用上の注意
14.1 薬剤投与時の注意
14.1.1 急速に静注した場合、めまいを起こすことがあるので、緩徐に静脈内投与すること。
14.1.2 本剤はワンポイントカットアンプルを使用しているので、カット部をエタノール綿等で清拭した後、ヤスリを用いず、アンプル枝部のマークの反対方向に折り取ること。
15. その他の注意
15.1 臨床使用に基づく情報
16. 薬物動態
16.1 血中濃度
健康成人男子にオンダンセトロン塩酸塩水和物注射剤(オンダンセトロンとして4mg)を単回静脈内投与した時、血漿中オンダンセトロン濃度推移及び薬物動態パラメータは以下の通りであった7)。
| 投与量 (mg) | T1/2(β) (hr) | AUC0-24 (ng・hr/mL) |
| 4 | 5.13±1.50 | 153.15±63.00 |
16.3 分布
16.3.1 血漿蛋白結合率
In vitroにおけるヒト血漿蛋白に対する結合率は、約88%であった8)。
16.4 代謝
16.5 排泄
健康成人にオンダンセトロン塩酸塩水和物注射剤(オンダンセトロンとして8mg)を静脈内投与した時、投与後24時間までの未変化体、水酸化体、並びに水酸化体のグルクロン酸抱合体及び硫酸抱合体の尿中排泄率は投与量の40%であった11)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
18. 薬効薬理
18.1 作用機序
オンダンセトロンは、延髄の最後野にあるCTZ(chemoreceptor trigger zone)や求心性迷走神経の5-HT3受容体に作用し、嘔吐を抑制すると考えられている19)。
18.2 制吐作用
18.3 5-HT3受容体拮抗作用
18.3.1 迷走神経の脱分極に対する作用
オンダンセトロンはin vitroにおいて、5-HT3受容体を介した5-HTによるラット迷走神経の脱分極を強力かつ競合的に抑制する22)。
18.3.2 von Bezold-Jarisch反射に対する作用
麻酔ラットにおける5-HT3受容体を介した5-HTによる反射性の徐脈に対し、オンダンセトロンは静脈内又は経口投与により用量依存的に抑制する22)。
18.3.3 5-HT3受容体への親和性
オンダンセトロンはラット最後野及び迷走神経のホモジネートを用いた放射性リガンド結合試験において、5-HT3受容体に対して高い親和性を示す23)。
18.4 その他の受容体に対する作用
In vitro(ネコ、イヌ、ウサギ、ラット、モルモット)において5-HT1 like、5-HT2受容体、並びにアドレナリン、ムスカリン及びヒスタミン等の5-HT以外の各種受容体が介在する反応に対して、オンダンセトロンは5-HT3受容体拮抗作用を示す濃度の1,000倍以上を用いてもほとんど作用を示さない22)。
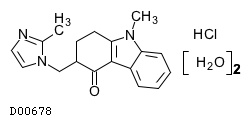
19. 有効成分に関する理化学的知見
19.1. オンダンセトロン塩酸塩水和物
20. 取扱い上の注意
20.1 本剤は光により着色するので、使用直前に遮光袋から取り出すこと。着色したものは使用しないこと。
22. 包装
2mL×5アンプル
23. 主要文献
- 矢島忠孝ほか, 臨床医薬, 14 (14), 2589-2601, (1998)
- Zuo,P.et al., J.Clin.Pharmacol., 54 (11), 1221-1229, (2014) »PubMed
- Huybrechts KF et al., JAMA, 320 (23), 2429-2437, (2018)
- Zambelli-Weiner A et al., Reprod.Toxicol., 83, 14-20, (2019)
- Huybrechts KF et al., JAMA, 323 (4), 372-374, (2020)
- MS Fejzo,et al., Reprod.Toxicol., 62, 87-91, (2016)
- 熊谷雄治ほか, 臨床医薬, 8 (7), 1505-1513, (1992)
- Hallifax D,et al., 基礎と臨床, 26 (4), 1337-1347, (1992)
- Dixon CM,et al., Drug Metab.Dispos., 23 (11), 1225-1230, (1995) »PubMed
- Ashforth EIL,et al., Br.J.Pharmacol., 37 (4), 389-391, (1994)
- ゾフラン注2・注4 医薬品インタビューフォーム
- 住永雅司ほか, 癌と化学療法, 19 (9), 1333-1345, (1992) »PubMed
- 太田 潤ほか, 癌と化学療法, 19 (12), 2041-2055, (1992) »PubMed
- 池田正典ほか, 癌と化学療法, 19 (12), 2071-2084, (1992) »PubMed
- 赤阪雄一郎ほか, 癌と化学療法, 19 (9), 1359-1374, (1992) »PubMed
- 池田正典ほか, 癌と化学療法, 19 (11), 1905-1914, (1992) »PubMed
- 忽滑谷直孝ほか, 癌と化学療法, 19 (9), 1375-1385, (1992) »PubMed
- 恒松由記子ほか, 小児科診療, 58 (10), 1819-1834, (1995)
- たか折修二他監訳, グッドマン・ギルマン薬理書(下)薬物治療の基礎と臨床 第12版, 1725-1726, (2013), (廣川書店)
- Stables R,et al., Cancer Treat.Rev., 14 (3,4), 333-336, (1987) »PubMed
- 南 勝ほか, 基礎と臨床, 26 (4), 1323-1335, (1992)
- Butler A,et al., Br.J.Pharmacol., 94 (2), 397-412, (1988) »PubMed
- Kilpatrick GJ,et al., Eur.J.Pharmacol., 159 (2), 157-164, (1989) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
サンド株式会社
カスタマーケアグループ
〒105-6333
東京都港区虎ノ門1-23-1
電話:0120-982-001
FAX:03-6257-3633
製品情報問い合わせ先
サンド株式会社
カスタマーケアグループ
〒105-6333
東京都港区虎ノ門1-23-1
電話:0120-982-001
FAX:03-6257-3633