医薬品情報
| 総称名 | アクタリット |
|---|---|
| 一般名 | アクタリット |
| 欧文一般名 | Actarit |
| 製剤名 | アクタリット錠 |
| 薬効分類名 | 抗リウマチ剤 |
| 薬効分類番号 | 1149 |
| KEGG DRUG |
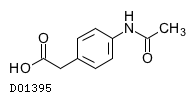
D01395
アクタリット
|
| KEGG DGROUP |
DG01985
疾患修飾性抗リウマチ薬 (DMARD)
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年12月 改訂(第1版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アクタリット錠100mg「サワイ」 (後発品) | ACTARIT Tablets[SAWAI] | 沢井製薬 | 1149031F1065 | 19.8円/錠 | 処方箋医薬品注) |
2. 禁忌
4. 効能または効果
5. 効能または効果に関連する注意
5.1 本剤は比較的発症早期の関節リウマチ患者に使用することが望ましい。
6. 用法及び用量
通常、他の消炎鎮痛剤等とともに、アクタリットとして成人1日300mgを3回に分割経口投与する。
7. 用法及び用量に関連する注意
7.1 本剤は鎮痛消炎作用を持たないため本剤投与前から投与している消炎鎮痛剤等を併用すること。ただし、本剤を6ヵ月間継続投与しても効果があらわれない場合は投与を中止すること。
8. 重要な基本的注意
8.1 本剤の投与に際しては、関節リウマチの治療法に十分精通し、患者の病態並びに副作用の出現に注意しながら使用すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 消化性潰瘍又はその既往歴のある患者
消化性潰瘍が悪化するおそれがある。
9.2 腎機能障害患者
9.2.1 腎機能障害又はその既往歴のある患者
腎機能障害が悪化するおそれがある。
9.3 肝機能障害患者
肝機能障害が悪化するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。動物実験(ラット)で胎児への移行が認められている。[2.1参照]
9.6 授乳婦
投与しないこと。動物実験(ラット)で乳汁中への移行が認められている。[2.1参照]
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
低用量(例えば1回1錠1日2回)から投与を開始するなど注意すること。なお、定期的に臨床症状の観察、臨床検査(肝機能・腎機能検査等)を行い、異常が認められた場合には、減量か又は休薬等の適切な処置を行うこと。本剤は主として腎臓から排泄されるが、高齢者では腎機能が低下していることが多いため高い血中濃度が持続するおそれがある。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ネフローゼ症候群(0.1%未満)、急性腎障害(頻度不明)[8.2参照]
11.1.2 間質性肺炎(0.1%未満)、肺線維症(頻度不明)
発熱、咳嗽、呼吸困難、胸部X線異常を伴う間質性肺炎があらわれることがあるので、患者の状態を十分に観察し、このような症状があらわれた場合には、投与を中止し、副腎皮質ホルモン剤投与等の適切な処置を行うこと。
11.1.3 再生不良性貧血、汎血球減少、無顆粒球症、血小板減少(いずれも頻度不明)[8.2参照]
11.1.4 肝機能障害(頻度不明)
AST、ALT、ALPの上昇等を伴う肝機能障害があらわれることがある。[8.2参照]
11.1.5 消化性潰瘍、出血性大腸炎(いずれも頻度不明)
消化性潰瘍(出血を伴うことがある)、出血性大腸炎があらわれることがある。
注)発現頻度は、製造販売後調査の結果を含む。
11.2 その他の副作用
| 0.1〜5%未満 | 頻度不明 | |
| 腎臓 | 腎機能異常(蛋白尿、BUN、クレアチニン、尿中NAGの上昇等) | 血尿 |
| 肝臓 | 肝機能異常(AST、ALT、ALPの上昇等) | |
| 血液 | 白血球減少、顆粒球減少 | 貧血、血小板減少 |
| 消化器 | 腹痛、嘔気・嘔吐、口内炎、舌炎、食欲不振、消化不良、下痢、胃潰瘍、口内乾燥、口唇腫脹 | |
| 皮膚 | 発疹、そう痒感、湿疹 | 脱毛、紅斑性発疹、蕁麻疹 |
| 精神神経系 | 頭痛、めまい、しびれ感、傾眠 | |
| その他 | 浮腫、倦怠感、発熱、耳鳴、視力異常、複視、味覚異常、動悸 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 健康成人男性(4例)にアクタリット錠1錠(アクタリットとして100mg)を食後単回経口投与したときの血中薬物動態パラメータは以下のとおりである1)。
| \ | 健康成人男性(n=4) |
| Cmax(μg/mL) | 2.24±0.49 |
| tmax(h) | 1.88±0.25 |
| t1/2(h) | 0.86±0.15 |
| AUC0-∞(μg・h/mL) | 4.56±0.65 |
16.1.2 生物学的同等性試験
アクタリット錠100mg「サワイ」とモーバー錠100mgを健康成人男子にそれぞれ1錠(アクタリットとして100mg)空腹時単回経口投与(クロスオーバー法)し、血漿中アクタリット濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された2)。
| Cmax(μg/mL) | Tmax(hr) | T1/2(hr) | AUC0-6hr(μg・hr/mL) | |
| アクタリット錠100mg「サワイ」 | 2.32±0.71 | 1.2±0.5 | 0.9±0.1 | 3.87±0.52 |
| モーバー錠100mg | 2.48±0.60 | 1.1±0.6 | 0.9±0.2 | 3.99±0.55 |
血漿中濃度ならびにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.3 分布
16.3.1 組織移行
14C-アクタリット10mg/kgをラットに単回経口投与した場合、組織内放射能濃度は投与後0.5〜1時間で最高値に達し、投与後8時間で各組織内放射能濃度は最高濃度の約17%以下となった。投与後24時間でほとんどの臓器で検出限界以下となり、組織残留性は認められなかった3)。
16.3.2 血漿蛋白結合率
17〜20%である3)(in vitro)。
16.4 代謝
アクタリットは代謝を受けない3)。
16.5 排泄
健康成人男性(4例)にアクタリット錠1錠(アクタリットとして100mg)を単回経口投与したとき、アクタリット錠投与後24時間までに未変化体として尿中にほぼ100%排泄される1)。
16.6 特定の背景を有する患者
18. 薬効薬理
18.1 作用機序
血管新生の抑制、細胞接着の抑制及び炎症性サイトカイン・蛋白分解酵素の産生抑制作用により、抗リウマチ作用を示す(in vitro)。
18.2 関節リウマチの類似疾患モデルに対する作用
18.2.1 アジュバント関節炎
18.2.2 コラーゲン関節炎
コラーゲンに対するIV型(遅延型)アレルギー反応を抑制することにより、II型コラーゲン関節炎を抑制する9)(マウス)。
18.2.3 MRL/lpr
18.3 抗リウマチ作用
19. 有効成分に関する理化学的知見
19.1. アクタリット
22. 包装
PTP
100錠(10錠×10)
23. 主要文献
- 塩川優一他, 臨床医薬, 7 (Suppl.2), 19-35, (1991)
- 水山和之他, 診療と新薬, 43 (5), 515-521, (2006)
- Sugihara,K.et al., Arzneim.-Forsch./Drug Res., 40 (7), 800-805, (1990) »PubMed
- 浜田勝生, Progress in Medicine, 15 (9), 1687-1691, (1995)
- 浜田勝生, Progress in Medicine, 17 (6), 1652-1657, (1997)
- Fujisawa,H.et al., Arzneim.-Forsch./Drug Res., 40 (6), 693-697, (1990) »PubMed
- 西村健志他, 薬理と治療, 21 (10), 3651-3656, (1993)
- 藤沢広他, 応用薬理, 39 (6), 587-593, (1990)
- Fujisawa,H.et al., Arzneim.-Forsch./Drug Res., 44 (1), 64-68, (1994) »PubMed
- 藤沢広他, 炎症, 6 (3), 285-290, (1986) »DOI
- Nakagawa,Y.et al., Int.J.Immunotherapy, VI (3), 131-140, (1990)
- Nakagawa,Y.et al., Int.J.Immunotherapy, VI (3), 141-148, (1990)
- Takeba,Y.et al., J.Rheumatol., 26 (1), 25-33, (1999) »PubMed
- 松原司, 医学のあゆみ, 186 (2), 129-132, (1998)
- 木谷敦, 中部リウマチ, 29 (1), 26-27, (1998)
24. 文献請求先及び問い合わせ先
文献請求先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
製品情報問い合わせ先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
26. 製造販売業者等
26.1 製造販売元
沢井製薬株式会社
大阪市淀川区宮原5丁目2-30