医薬品情報
| 総称名 | グラッシュビスタ |
|---|---|
| 一般名 | ビマトプロスト |
| 欧文一般名 | Bimatoprost |
| 製剤名 | ビマトプロスト外用液剤 |
| 薬効分類名 | プロスタマイド誘導体 |
| 薬効分類番号 | 2679 |
| KEGG DRUG |
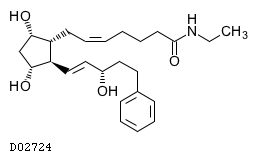
D02724
ビマトプロスト
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年8月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| グラッシュビスタ外用液剤0.03%5mL | GlashVista cutaneous solution 0.03%5mL | アッヴィ | 267970AQ1020 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
睫毛貧毛症
5. 効能または効果に関連する注意
発毛可能な毛包が存在しない部位における本剤の有効性は期待できない。
6. 用法及び用量
片眼ごとに、1滴を本剤専用のアプリケータに滴下し、1日1回就寝前に上眼瞼辺縁部の睫毛基部に塗布する。
7. 用法及び用量に関連する注意
7.1 本剤の塗布には同梱の専用アプリケータを使用し、片眼ごとに新しいアプリケータを使用すること。[14.2.6参照]
7.2 がん化学療法による睫毛貧毛症の患者では、本剤の投与はがん化学療法終了4週間後以降に開始することが望ましい(がん化学療法施行中及び終了4週間後までの間における本剤投与に関する安全性及び有効性は確立していない)。[17.1.1参照]
8. 重要な基本的注意
8.1 本剤の投与により、虹彩や眼瞼への色素過剰(メラニンの増加)があらわれることがある。これらは投与の継続により徐々に進行し、投与中止により停止する。眼瞼色素過剰については、投与中止後徐々に消失、あるいは軽減する可能性があるが、虹彩色素過剰については投与中止後も消失しないことが報告されている。混合色虹彩の患者では虹彩の色素過剰は明確に認められるが、暗褐色の単色虹彩の患者(日本人に多い)においても変化が認められている。これらの症状について患者に十分説明するとともに、患者を定期的に診察し、症状に応じて投与継続の可否を検討すること。
8.2 本剤投与中に角膜上皮障害(点状表層角膜炎、糸状角膜炎、角膜びらん)があらわれることがあるので、しみる、そう痒感、眼痛等の自覚症状が持続する場合には、直ちに眼科医を受診するように患者に十分に指導すること。
8.3 本剤投与により、内眼部及び外眼部の炎症や角膜上皮障害が悪化する可能性、及び眼圧が影響を受ける可能性があるため、眼疾患又は眼手術後で治療中の患者に本剤を投与する際は、眼科医に相談することが望ましい。
8.4 眼瞼色素過剰、接触皮膚炎、眼周囲の多毛化等の予防あるいは軽減のため、投与の際に液が上眼瞼辺縁部以外に付着した場合には、よくふき取るか洗い流すよう患者を指導すること。[14.2.5参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 無水晶体眼あるいは眼内レンズ挿入眼の患者又は硝子体手術等の内眼手術の既往のある患者
嚢胞様黄斑浮腫を含む黄斑浮腫、及びそれに伴う視力低下を起こすおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、投与しないことが望ましい。動物実験では、妊娠動物(マウス・ラット)において0.3または0.6mg/kg/日以上を経口投与した場合に流産及び早産が認められ、0.3mg/kg/日以上で、母体毒性や胎児毒性(胎児死亡等)が認められた。なお、これら所見が発現した際の親動物における曝露量(AUC)はヒト点眼時の64倍以上であった。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ヒトの母乳中に移行するかどうかは不明だが、動物実験では乳汁中に移行することが報告されている。
9.7 小児等
投与しないことが望ましい。小児等を対象とした臨床試験は実施していない。
9.8 高齢者
一般に高齢者では生理機能が低下しているので注意すること。
10. 相互作用
10.2 併用注意
| プロスタグランジン系点眼剤 ラタノプロスト含有点眼剤 | 眼圧低下作用が減弱する可能性がある1)。 | 機序不明 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 虹彩色素過剰(0.2%)
11.1.2 眼瞼溝深化(0.2%)
11.2 その他の副作用
| 2%以上 | 2%未満 | 頻度不明 | |
| 眼 | 結膜充血、眼脂、眼乾燥、点状角膜炎、眼瞼紅斑、眼瞼そう痒症、眼そう痒症、眼瞼刺激、眼刺激 | 結膜濾胞、眼瞼障害、睫毛乱生、眼瞼炎、麦粒腫 | 眼痛、眼瞼痛、眼部腫脹、眼瞼浮腫、流涙増加、霧視、灼熱感(眼瞼)、眼の異物感、眼瞼色素沈着、眼瞼皮膚乾燥、眼瞼下垂 |
| 皮膚 | 皮膚色素過剰 | 毛質異常、睫毛眉毛脱落症(部分的な一時的睫毛眉毛の脱落も含む) | 毛髪成長異常、裂毛(一時的な睫毛の裂毛)、発疹(眼瞼及び眼窩周囲に限定された斑状発疹、紅斑性発疹、そう痒性発疹を含む)、皮膚変色(眼窩周囲)、眼窩周囲紅斑、皮膚剥脱(眼瞼及び眼窩周囲) |
| その他 | − | 顔面痛 | 頭痛、過敏症(局所的アレルギー反応) |
14. 適用上の注意
14.1 投与経路、使用部位
本剤は点眼剤として使用しないこと。本剤は上眼瞼辺縁部の睫毛基部にのみ塗布し、下眼瞼には使用しないこと。
14.2 投与時
患者に対し次の点に注意するよう指導すること。
14.2.1 塗布する前に洗顔して上眼瞼辺縁部を清潔にしてから使用すること。
14.2.2 塗布時に、容器やアプリケータの先端が周囲の物や指などの表面に触れないよう注意すること。
14.2.3 アプリケータを水平に持ち、アプリケータの先端に最も近い部分に1滴滴下すること。
14.2.4 滴下後すぐに、アプリケータを片方の目の上眼瞼辺縁部に内側から外側に向けて慎重に沿わせること。
14.2.5 塗布したときに液が上眼瞼辺縁部以外についた場合は、ティッシュ等吸収性の素材ですぐにふき取るか、洗い流すこと。[8.4参照]
14.2.6 一度使用したアプリケータは廃棄すること。[7.1参照]
14.2.7 新しいアプリケータを使い、もう片方の目の上眼瞼辺縁部に同様に繰り返すこと。
14.2.8 ベンザルコニウム塩化物によりコンタクトレンズを変色させることがあるので、コンタクトレンズを装着している場合は、塗布する前に一旦レンズを外し、塗布15分以上経過後に再装用すること。
15. その他の注意
15.1 臨床使用に基づく情報
特発性及びがん化学療法による睫毛貧毛症以外の睫毛貧毛症患者に対する有効性は確立されていない。[17.1.1参照]。
16. 薬物動態
16.1 血中濃度
16.1.1 皮膚組織内濃度
含水アルコール性カルボポールゲル製剤(ビマトプロスト0.03%を含む)0.1mLを雌マウスの背部皮膚(12cm2)に単回塗布したとき、約4時間後に皮膚組織内濃度が最高濃度(平均値±標準偏差)6.74±5.86(μg/g)に達した。また、1日1回21日間反復塗布したとき、21日目の投与24時間後の皮膚組織内濃度(平均値±標準偏差)は、3.61±0.90μg/gであった。血中のビマトプロスト濃度は単回塗布および反復塗布いずれにおいても皮膚組織内濃度の0.1%程度であり、代謝物(17-フェニルトリノルプロスタグランジンF2α)は皮膚組織内および血中のいずれにおいても検出されなかった。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相臨床試験
特発性睫毛貧毛症成人患者173例又はがん化学療法による睫毛貧毛症成人患者(がん化学療法終了後4週間以上が経過した患者が対象とされた)36例を対象とした2つのプラセボ対照二重盲検比較試験において、投与4ヵ月後のGEA-J*スケールで1段階以上の改善が認められた場合を有効と評価した場合の有効率の結果は下表のとおりであり、いずれの試験でも本剤群はプラセボ群と比較して統計学的に有意に優れていた。
*日本人用画像数値化ガイド付き総合的睫毛評価スケール:標準写真を参考に、医師が患者の上睫毛の全般的な印象を4段階(1「低い」、2「普通」、3「高い」、4「著しく高い」)で評価
| 特発性睫毛貧毛症 | がん化学療法による睫毛貧毛症 | |||
| プラセボ群 | 本剤群 | プラセボ群 | 本剤群 | |
| 有効率 | 17.6%(15/85例) | 77.3%(68/88例) | 27.8%(5/18例) | 88.9%(16/18例) |
18. 薬効薬理
19. 有効成分に関する理化学的知見
19.1. ビマトプロスト
22. 包装
グラッシュビスタ外用薬剤0.03%5mL×1(アプリケータ140本同梱)
23. 主要文献
24. 文献請求先及び問い合わせ先
文献請求先
アッヴィ合同会社
アラガン・エステティックス お客様相談窓口
〒108-0023
東京都港区芝浦3-1-21
電話:0120-404-100 (9:00〜17:00/土日祝日及び当社休業日を除く)
FAX:0120-085-235 (24時間受付)
製品情報問い合わせ先
アッヴィ合同会社
アラガン・エステティックス お客様相談窓口
〒108-0023
東京都港区芝浦3-1-21
電話:0120-404-100 (9:00〜17:00/土日祝日及び当社休業日を除く)
FAX:0120-085-235 (24時間受付)
25. 保険給付上の注意
本剤は保険給付の対象とならない(薬価基準未収載)。
26. 製造販売業者等
26.1 製造販売元
アッヴィ合同会社
東京都港区芝浦3-1-21
Allergan Aesthetics
an AbbVie company
an AbbVie company