医薬品情報
| 総称名 | カナリア |
|---|---|
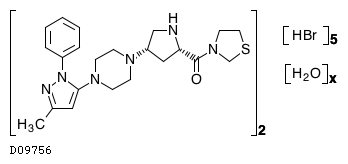
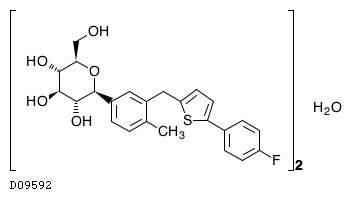
| 一般名 | テネリグリプチン臭化水素酸塩水和物 カナグリフロジン水和物 |
| 欧文一般名 | Teneligliptin Hydrobromide Hydrate Canagliflozin Hydrate |
| 製剤名 | テネリグリプチン臭化水素酸塩水和物・カナグリフロジン水和物配合錠/テネリグリプチン臭化水素酸塩水和物・カナグリフロジン水和物配合口腔内崩壊錠 |
| 薬効分類名 | 選択的DPP-4阻害剤/SGLT2阻害剤 配合剤 2型糖尿病治療剤 |
| 薬効分類番号 | 3969 |
| KEGG DRUG |
D10897
テネリグリプチン臭化水素酸塩水和物・カナグリフロジン水和物
|
| KEGG DGROUP |
DG02044
血糖降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年12月 改訂(第8版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| カナリア配合錠 | CANALIA COMBINATION TABLETS | 田辺ファーマ | 3969106F1028 | 208.5円/錠 | 処方箋医薬品注) |
| カナリア配合OD錠 | CANALIA COMBINATION OD TABLETS | 田辺ファーマ | 3969106F2024 | 208.5円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 重症ケトーシス、糖尿病性昏睡又は前昏睡、1型糖尿病の患者[輸液及びインスリンによる速やかな高血糖の是正が必須となるので本剤の投与は適さない。]
2.3 重症感染症、手術前後、重篤な外傷のある患者[インスリン注射による血糖管理が望まれるので本剤の投与は適さない。]
4. 効能または効果
2型糖尿病
ただし、テネリグリプチン臭化水素酸塩水和物及びカナグリフロジン水和物の併用による治療が適切と判断される場合に限る。
ただし、テネリグリプチン臭化水素酸塩水和物及びカナグリフロジン水和物の併用による治療が適切と判断される場合に限る。
5. 効能または効果に関連する注意
5.1 本剤を2型糖尿病治療の第一選択薬として用いないこと。
5.2 原則として、既にテネリグリプチン臭化水素酸塩水和物(テネリグリプチンとして1日20mg)及びカナグリフロジン水和物(カナグリフロジンとして1日100mg)を併用し状態が安定している場合、あるいはテネリグリプチン臭化水素酸塩水和物(テネリグリプチンとして1日20mg)又はカナグリフロジン水和物(カナグリフロジンとして1日100mg)の単剤治療により効果不十分な場合に、使用を検討すること。
5.3 本剤は2型糖尿病と診断された患者に対してのみ使用すること。
5.6 本剤投与中において、本剤の投与がテネリグリプチン臭化水素酸塩水和物及びカナグリフロジン水和物の各単剤の併用よりも適切であるか慎重に判断すること。
5.7 本剤の適用はあらかじめ糖尿病治療の基本である食事療法、運動療法を十分に行ったうえで効果が不十分な場合に限り考慮すること。
6. 用法及び用量
通常、成人には1日1回1錠(テネリグリプチン/カナグリフロジンとして20mg/100mg)を朝食前又は朝食後に経口投与する。
8. 重要な基本的注意
8.2 本剤の有効成分であるカナグリフロジンの利尿作用により多尿・頻尿がみられることがある。また、体液量が減少することがあるので、適度な水分補給を行うよう指導し、観察を十分行うこと。特に体液量減少を起こしやすい患者(高齢者、腎機能障害患者、利尿薬併用患者等)においては、脱水や糖尿病性ケトアシドーシス、高浸透圧高血糖症候群、脳梗塞を含む血栓・塞栓症等の発現に注意すること。[9.1.3、9.2.2、9.8.2、10.2、11.1.2参照]
8.3 本剤の有効成分であるカナグリフロジンの投与により、尿路感染及び性器感染を起こし、腎盂腎炎、外陰部及び会陰部の壊死性筋膜炎(フルニエ壊疽)、敗血症等の重篤な感染症に至ることがある。十分な観察を行うなど尿路感染及び性器感染の発症に注意し、発症した場合には適切な処置を行うとともに、状態に応じて休薬等を考慮すること。尿路感染及び性器感染の症状及びその対処方法について患者に説明すること。[9.1.4、11.1.4参照]
8.4 本剤投与中は、血糖を定期的に検査し、薬剤の効果を確かめ、本剤を3ヵ月投与しても効果が不十分な場合には他の治療法への変更を考慮すること。
8.5 本剤と他の糖尿病薬の併用における安全性は検討されていない。
8.6 本剤の有効成分であるテネリグリプチンとGLP-1受容体作動薬はいずれもGLP-1受容体を介した血糖降下作用を有している。両剤を併用した臨床試験成績はなく、有効性及び安全性は確立されていない。
8.7 本剤の有効成分であるカナグリフロジンの投与により、血清クレアチニンの上昇又はeGFRの低下がみられることがあるので、腎機能を定期的に検査すること。腎機能障害患者においては経過を十分に観察し、継続的にeGFRが45mL/min/1.73m2未満に低下した場合は投与の中止を検討すること。[5.4、5.5、9.2.1、9.2.2参照]
8.8 本剤の有効成分であるカナグリフロジンの作用機序である尿中グルコース排泄促進作用により、血糖コントロールが良好であっても脂肪酸代謝が亢進し、ケトーシスがあらわれ、ケトアシドーシスに至ることがある。[11.1.3参照]
8.8.1 著しい血糖の上昇を伴わない場合があるため、以下の点に留意すること。[8.8.2参照]
・悪心・嘔吐、食欲減退、腹痛、過度な口渇、倦怠感、呼吸困難、意識障害等の症状が認められた場合には、血中又は尿中ケトン体測定を含む検査を実施すること。
・特に、インスリン分泌能の低下、インスリン製剤の減量や中止、過度な糖質摂取制限、食事摂取不良、感染症、脱水を伴う場合にはケトアシドーシスを発現しやすいので、観察を十分に行うこと。
・患者に対し、以下の点を指導すること。
・ケトアシドーシスの症状(悪心・嘔吐、食欲減退、腹痛、過度な口渇、倦怠感、呼吸困難、意識障害等)。
・ケトアシドーシスの症状が認められた場合には直ちに医療機関を受診すること。
・血糖値が高値でなくともケトアシドーシスが発現しうること。
8.8.2 カナグリフロジンを含むSGLT2阻害薬の投与中止後、血漿中半減期から予想されるより長く尿中グルコース排泄及びケトアシドーシスが持続した症例が報告されているため、必要に応じて尿糖を測定するなど観察を十分に行うこと。[8.8.1参照]
8.9 本剤の有効成分であるカナグリフロジンは、尿中グルコース排泄促進作用を有する。排尿困難、無尿、乏尿あるいは尿閉の症状を呈する患者においては、その治療を優先するとともに他剤での治療を考慮すること。
8.10 本剤の有効成分であるカナグリフロジンの投与による体重減少が報告されているため、過度の体重減少に注意すること。
8.11 低血糖症状を起こすことがあるので、高所作業、自動車の運転等に従事している患者に投与するときは注意すること。[11.1.1参照]
8.12 急性膵炎があらわれることがあるので、持続的な激しい腹痛、嘔吐等の初期症状があらわれた場合には、速やかに医師の診察を受けるよう患者に指導すること。[11.1.9参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 心不全(NYHA心機能分類III〜IV)のある患者
使用経験がなく、安全性が確立していない。
9.1.2 低血糖を起こすおそれのある以下の患者又は状態
9.1.3 脱水を起こしやすい患者(血糖コントロールが極めて不良の患者、高齢者、利尿剤併用患者等)
9.1.4 尿路感染、性器感染のある患者
9.1.5 腹部手術の既往又はイレウスの既往のある患者
腸閉塞を含むイレウスを起こすおそれがある。[11.1.5参照]
9.1.6 QT延長を起こしやすい患者(先天性QT延長症候群等QT延長の既往歴又はTorsade de pointesの既往歴のある患者、重度の徐脈等の不整脈又はその既往歴のある患者、うっ血性心不全等の心疾患のある患者、低カリウム血症の患者等)
QT延長を起こすおそれがある。海外臨床試験において本剤の有効成分であるテネリグリプチン160mgを1日1回投与したときにQT延長が報告されている。[17.3.1参照]
本剤の有効成分であるテネリグリプチンの承認用量は通常、20mg/日であり、最大用量は40mg/日である。
9.2 腎機能障害患者
9.2.1 高度腎機能障害患者又は透析中の末期腎不全患者
9.2.2 中等度腎機能障害患者
9.3 肝機能障害患者
9.3.1 高度肝機能障害患者
これらの患者(Child-Pugh分類で合計スコア9超)を対象とした臨床試験は実施していない。[16.6.2参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には本剤を投与せず、インスリン製剤等を使用すること。本剤の成分であるテネリグリプチン及びカナグリフロジンの動物実験(ラット)で胎児への移行が報告されている。また、カナグリフロジンの動物実験(ラット)で、ヒトの妊娠中期及び後期にあたる期間の曝露により、幼若動物に腎盂及び尿細管の拡張が報告されている。
9.6 授乳婦
授乳しないことが望ましい。本剤の成分であるテネリグリプチン及びカナグリフロジンの動物実験(ラット)で乳汁中への移行が報告されている。また、カナグリフロジンの動物実験(ラット)では哺育期間中に出生児の体重増加抑制や幼若動物の腎盂の拡張、尿細管の拡張が認められている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
10. 相互作用
相互作用序文
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
フラビン含有モノオキシゲナーゼ(FMO1)
薬物代謝酵素用語
フラビン含有モノオキシゲナーゼ(FMO3)
薬物代謝酵素用語
UGT1A9
薬物代謝酵素用語
UGT2B4
薬物代謝酵素用語
P-糖蛋白質
10.2 併用注意
| 糖尿病用薬 スルホニルウレア剤 速効型インスリン分泌促進薬 α-グルコシダーゼ阻害薬 ビグアナイド系薬剤 チアゾリジン系薬剤 GLP-1受容体作動薬 インスリン製剤等 [11.1.1参照] | 低血糖症状が起こるおそれがあるので、患者の状態を十分観察しながら投与すること。特に、インスリン製剤、スルホニルウレア剤又は速効型インスリン分泌促進薬と併用する場合、低血糖のリスクが増加するため、これらの薬剤の減量を検討すること。 | 血糖降下作用が増強される。 |
| 血糖降下作用を増強する薬剤 β-遮断剤 サリチル酸剤 モノアミン酸化酵素阻害剤等 | 血糖値その他患者の状態を十分観察しながら投与すること。 | 血糖降下作用が増強される。 |
| 血糖降下作用を減弱する薬剤 アドレナリン 副腎皮質ホルモン 甲状腺ホルモン等 | 血糖値その他患者の状態を十分観察しながら投与すること。 | 血糖降下作用が減弱される。 |
| QT延長を起こすことが知られている薬剤 クラスIA抗不整脈薬 キニジン硫酸塩水和物、プロカインアミド塩酸塩等 クラスIII抗不整脈薬 アミオダロン塩酸塩、ソタロール塩酸塩等 | QT延長等が起こるおそれがある。 | これらの薬剤では単独投与でもQT延長がみられている。 |
| ジゴキシン [16.7.3参照] | カナグリフロジン300mgとの併用によりジゴキシンのCmax及びAUCがそれぞれ36%及び20%上昇したとの報告があるため、適切な観察を行うこと。 | カナグリフロジンのP-糖蛋白質阻害作用による。 |
| リファンピシン、フェニトイン、フェノバルビタール、リトナビル等 [16.7.2参照] | カナグリフロジンとリファンピシンとの併用によりカナグリフロジンのCmax及びAUCがそれぞれ28%及び51%低下したとの報告があるため、適切な観察を行うこと。 | カナグリフロジンの代謝酵素であるUGT1A9及びUGT2B4をこれらの薬剤が誘導することにより、カナグリフロジンの代謝が促進される。 |
| 利尿作用を有する薬剤 ループ利尿薬 サイアザイド系利尿薬等 [8.2、9.1.3、11.1.2参照] | 必要に応じ利尿薬の用量を調整するなど注意すること。 | 左記薬剤との併用により利尿作用が増強されるおそれがある。 |
| 炭酸リチウム | リチウムの作用が減弱されるおそれがある。 | 血清リチウム濃度が低下する可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 低血糖
11.1.2 脱水(頻度不明)
11.1.3 ケトアシドーシス(頻度不明)
11.1.4 腎盂腎炎、外陰部及び会陰部の壊死性筋膜炎(フルニエ壊疽)、敗血症(頻度不明)
11.1.5 イレウス(頻度不明)
腸閉塞を含むイレウスを起こすおそれがある。高度の便秘、腹部膨満、持続する腹痛、嘔吐等の異常が認められた場合には投与を中止し、適切な処置を行うこと。[9.1.5参照]
11.1.6 肝機能障害(頻度不明)
AST、ALTの上昇等を伴う肝機能障害があらわれることがある。
11.1.7 間質性肺炎(頻度不明)
咳嗽、呼吸困難、発熱、肺音の異常(捻髪音)等が認められた場合には、速やかに胸部X線、胸部CT、血清マーカー等の検査を実施すること。間質性肺炎が疑われた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.8 類天疱瘡(頻度不明)
水疱、びらん等があらわれた場合には、皮膚科医と相談し、投与を中止するなど適切な処置を行うこと。
11.1.9 急性膵炎(頻度不明)
持続的な激しい腹痛、嘔吐等の異常が認められた場合には投与を中止し、適切な処置を行うこと。[8.12参照]
11.2 その他の副作用
| 1%以上 | 0.1〜1%未満 | 頻度不明 | |
| 精神・神経系 | 浮動性めまい、感覚鈍麻 | ||
| 消化器 | 口渇、便秘 | 裂肛、消化器カンジダ症 | 腹部膨満、上腹部痛、悪心、下痢 |
| 循環器 | 心筋梗塞、高血圧、起立性低血圧 | ||
| 泌尿器 | 頻尿、多尿 | 膀胱炎、尿閉 | |
| 皮膚 | 湿疹 | 発疹、酒さ、足部白癬 | そう痒症 |
| 耳 | 耳不快感 | ||
| 生殖器 | 外陰部腟カンジダ症 | 亀頭包皮炎、外陰腟そう痒症、陰部そう痒症 | |
| 臨床検査 | 血中ケトン体増加 | 血中ブドウ糖減少 | |
| 全身症状 | 疲労 | 空腹 | |
| 筋骨格系 | 関節痛 | ||
| その他 | 熱中症 |
12. 臨床検査結果に及ぼす影響
カナグリフロジンの作用機序により、本剤服用中は尿糖陽性、血清1,5-AG(1,5-アンヒドログルシトール)低値を示す。尿糖及び血清1,5-AGの検査結果は、血糖コントロールの参考とはならないので注意すること。
13. 過量投与
13.1 処置
14. 適用上の注意
14.1 薬剤交付時の注意
<製剤共通>
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
<OD錠>
14.1.2 本剤は舌の上にのせて唾液を浸潤させると崩壊するため、水なしで服用可能である。また、水で服用することもできる。
14.1.3 本剤は寝たままの状態では、水なしで服用させないこと。
15. その他の注意
15.1 臨床使用に基づく情報
海外で行われた脳・心血管疾患の既往又は高いリスクを有する、血糖コントロール不良な2型糖尿病患者を対象とした大規模臨床試験において、本剤の有効成分であるカナグリフロジンとして100又は300mgを1日1回投与された患者では、プラセボを投与された患者よりも、下肢切断の発現頻度が有意に高かった(ハザード比:1.97、95%信頼区間1.41-2.75)との報告がある1)。
本剤の有効成分であるカナグリフロジンの承認用量は100mg/日である。
本剤の有効成分であるカナグリフロジンの承認用量は100mg/日である。
15.2 非臨床試験に基づく情報
15.2.1 カニクイザルを用いたテネリグリプチンの52週間反復経口投与毒性試験において、75mg/kg/日投与で尾、四肢及び耳介等に表皮剥脱・痂皮・潰瘍等の皮膚症状が認められた。このときのAUC0-24hは、1日40mgをヒトに投与したときの約45倍に達していた。なお、同様の毒性所見は、他の動物種(ラット、マウス及びウサギ)及びヒトでは報告されていない。
15.2.2 雌雄ラットを用いたカナグリフロジンの2年間反復投与がん原性試験(10、30及び100mg/kg/日)において、10mg/kg/日以上の雄で精巣に間細胞腫、100mg/kg/日の雌雄で副腎に褐色細胞腫及び腎臓に尿細管腫瘍の発生頻度の増加が認められた。ラットにカナグリフロジン10mg/kg/日(雄)又は100mg/kg/日(雌)を反復経口投与したときの曝露量(AUC0-24h)は、最大臨床推奨用量(1日1回100mg)の約6倍又は約84倍であった。
16. 薬物動態
16.1 血中濃度
16.1.1 生物学的同等性試験
(1)カナリア配合錠〔普通錠〕と単剤〔普通錠〕併用投与
健康成人男性に、カナリア配合錠〔普通錠〕又は単剤〔普通錠〕併用で空腹時に投与したときのテネリグリプチンとカナグリフロジンの血漿中濃度推移及び薬物動態パラメータは以下のとおりであった。単剤〔普通錠〕に対するカナリア配合錠〔普通錠〕のAUC0-72h及びCmaxの対数値の平均値の差の90%信頼区間は、いずれもlog(0.80)〜log(1.25)の範囲内であり、生物学的同等性が確認された2)。
(平均値+標準偏差、n=24)
| Cmax(ng/mL) | AUC0-72h(ng・h/mL) | tmax(h) | t1/2(h) | |
| テネリグリプチン | ||||
| カナリア配合錠〔普通錠〕 | 268.6(104.4) | 2002.9(303.2) | 1.00(0.50-5.00) | 21.5(4.7) |
| 単剤併用〔普通錠〕 | 231.2(66.45) | 1921.6(285.6) | 1.00(0.50-5.00) | 22.9(5.7) |
| カナグリフロジン | ||||
| カナリア配合錠〔普通錠〕 | 1158(249.8) | 7833(1389) | 1.75(1.00-12.00) | 13.42(3.41) |
| 単剤併用〔普通錠〕 | 1115(286.0) | 7633(1616) | 2.00(1.00-5.00) | 13.83(3.74) |
(2)カナリア配合OD錠とカナリア配合錠〔普通錠〕
健康成人男性に、カナリア配合OD錠(水なしで服用及び水で服用)又はカナリア配合錠〔普通錠〕を空腹時に投与したときのテネリグリプチンとカナグリフロジンの血漿中濃度推移及び薬物動態パラメータは以下のとおりであった。カナリア配合錠〔普通錠〕に対するカナリア配合OD錠のAUC0-72h及びCmaxの対数値の平均値の差の90%信頼区間は、いずれもlog(0.80)〜log(1.25)の範囲内であり、両製剤の生物学的同等性が確認された3)。
・水なしで服用(普通錠:水で服用)
(平均値+標準偏差、n=77)
| Cmax(ng/mL) | AUC0-72h(ng・h/mL) | tmax(h) | t1/2(h) | |
| テネリグリプチン | ||||
| カナリア配合OD錠 | 195.0(49.77) | 1628.7(296.5) | 1.50(0.50-3.00) | 21.5(5.1) |
| カナリア配合錠〔普通錠〕 | 198.9(52.34) | 1678.2(298.4) | 1.00(0.50-8.00) | 21.1(4.5) |
| カナグリフロジン | ||||
| カナリア配合OD錠 | 1147(257.3) | 7784(1361) | 2.00(1.00-5.00) | 11.70(2.57) |
| カナリア配合錠〔普通錠〕 | 1094(254.0) | 7808(1437) | 3.00(1.00-5.02) | 11.53(2.13) |
・水で服用
(平均値+標準偏差、n=23)
| Cmax(ng/mL) | AUC0-72h(ng・h/mL) | tmax(h) | t1/2(h) | |
| テネリグリプチン | ||||
| カナリア配合OD錠 | 215.9(55.15) | 1613.8(268.0) | 1.00(0.50-3.00) | 23.9(7.0) |
| カナリア配合錠〔普通錠〕 | 227.8(55.46) | 1730.2(351.7) | 1.00(0.50-3.00) | 23.3(6.0) |
| カナグリフロジン | ||||
| カナリア配合OD錠 | 1105(244.1) | 7314(985) | 2.00(1.00-5.00) | 12.63(3.02) |
| カナリア配合錠〔普通錠〕 | 1149(271.3) | 7409(988) | 2.00(1.00-5.00) | 12.34(2.20) |
16.2 吸収
16.2.1 食事の影響
健康成人男性に、カナリア配合錠〔普通錠〕を空腹時又は食事10分後(食後投与)に単回経口投与したときの薬物動態パラメータは以下のとおりであった2)。
| Cmax(ng/mL) | AUC0-72h(ng・h/mL) | tmax(h) | |
| テネリグリプチン | |||
| 空腹時 | 229.3(65.00) | 1968.8(425.6) | 1.00(0.50-2.00) |
| 食後 | 169.1(32.52) | 1823.5(415.4) | 2.00(1.50-3.00) |
| カナグリフロジン | |||
| 空腹時 | 757.2(168.2) | 5873(1204) | 3.00(1.50-5.00) |
| 食後 | 745.2(186.6) | 6088(1212) | 2.00(1.50-5.00) |
16.3 分布
16.4 代謝
16.4.1 テネリグリプチン
(1)健康成人(外国人、6例)に、[14C]標識テネリグリプチン20mgを単回経口投与したとき、血漿中に未変化体、及び代謝物M1、M2、M3、M4及びM5が認められた。また、投与後72時間までの血漿中放射能濃度から算出したAUC0-∞に対するテネリグリプチン、M1、M2、M3、M4及びM5のAUC0-∞の割合はそれぞれ71.1%、14.7%、1.3%、1.3%、0.3%及び1.1%であった6)。
16.4.2 カナグリフロジン
(1)健康成人(外国人、6例)に、[14C]標識カナグリフロジン192mgを単回経口投与したとき、投与後24時間までの血漿中総放射能に占める未変化体及び代謝物の割合は、カナグリフロジン(45.4〜98.7%)、グルクロン酸抱合代謝物M5(1.9〜29.6%)及びM7(16.0〜28.8%)及び酸化代謝物M9(2.42〜3.70%)であった8)。
(2)カナグリフロジンのグルクロン酸抱合代謝には主にUGT1A9及びUGT2B4が、酸化代謝には主にCYP3A4次いでCYP2D6が関与した。CYP2B6、CYP2C8、CYP2C9及びCYP3A4に対して弱い阻害作用を示したが(IC50値:16、75、80及び27μmol/L)、CYP1A2、CYP2A6、CYP2C19、CYP2D6及びCYP2E1に対して阻害作用を示さなかった。また、いずれのCYP分子種に対しても時間依存的阻害作用を示さず、CYP1A2、CYP2B6、CYP3A4、CYP2C9及びCYP2C19を誘導しなかった。UGT1A1及びUGT1A6に対して弱い阻害作用を示したが(IC50値:91及び50μmol/L)、UGT1A4、UGT1A9及びUGT2B7に対して阻害作用を示さなかった9)(in vitro)。[10.参照]
16.5 排泄
16.5.1 テネリグリプチン
(1)健康成人に、テネリグリプチンとして20及び40mgを空腹時に単回経口投与したとき(各6例)、投与量の21.0〜22.1%が尿中に未変化体として排泄され、腎クリアランスは37〜39mL/h/kgであった10)。
(2)健康成人(外国人、6例)に、[14C]標識テネリグリプチン20mgを単回経口投与したとき、投与後216時間までに投与放射能の45.4%が尿中に、46.5%が糞中に排泄された。また、投与後120時間までの投与量に対する未変化体、M1、M2及びM3の累積尿中排泄率は、それぞれ14.8%、17.7%、1.4%、1.9%であり、未変化体、M1、M3、M4及びM5の累積糞中排泄率は、それぞれ26.1%、4.0%、1.6%、0.3%及び1.3%であった6)。
16.5.2 カナグリフロジン
(1)健康成人(外国人、6例)に、[14C]標識カナグリフロジン192mgを単回経口投与したとき、投与後168時間までに、投与された放射能の32.5%が尿中に、60.4%が糞中に排泄された。投与後48時間までの尿中にカナグリフロジンは認められず、M5(13.3%)及びM7(17.2%)が認められた。また、糞中には、カナグリフロジン(41.5%)、M7(3.2%)及びM9(7.0%)が認められた8)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害者
(1)テネリグリプチン
腎機能障害者(32例)に、テネリグリプチンとして20mgを単回経口投与したとき、テネリグリプチンのCmax及びt1/2は腎機能障害の程度に応じた顕著な変化は認められなかった。
一方、AUC0-∞は健康成人(Ccr>80mL/min、8例)と比較して、軽度腎機能障害者(50≦Ccr≦80mL/min、8例)、中等度腎機能障害者(30≦Ccr<50mL/min、8例)及び高度腎機能障害者(Ccr<30mL/min、8例)でそれぞれ約1.25倍、約1.68倍及び約1.49倍であり、末期腎不全患者(8例)のAUC0-43hは健康成人(8例)と比較して、約1.16倍であった。また、血液透析によってテネリグリプチンは投与量の15.6%が除去された14)(外国人のデータ)。[13.1.1参照]
一方、AUC0-∞は健康成人(Ccr>80mL/min、8例)と比較して、軽度腎機能障害者(50≦Ccr≦80mL/min、8例)、中等度腎機能障害者(30≦Ccr<50mL/min、8例)及び高度腎機能障害者(Ccr<30mL/min、8例)でそれぞれ約1.25倍、約1.68倍及び約1.49倍であり、末期腎不全患者(8例)のAUC0-43hは健康成人(8例)と比較して、約1.16倍であった。また、血液透析によってテネリグリプチンは投与量の15.6%が除去された14)(外国人のデータ)。[13.1.1参照]
(2)カナグリフロジン
・腎機能障害を伴う2型糖尿病患者
・腎機能障害者
腎機能障害者(37例)に、カナグリフロジンとして200mgを単回経口投与したとき、軽度腎機能障害者(eGFR 60〜89mL/min/1.73m2、10例)、中等度腎機能障害者(eGFR 30〜59mL/min/1.73m2、9例)及び高度腎機能障害者(eGFR 15〜29mL/min/1.73m2、10例)のカナグリフロジンのCmaxは正常腎機能者(eGFR≧90mL/min/1.73m2、3例)と比較して、それぞれ約27%、約9%及び約10%低下した。また、AUC0-∞は正常腎機能者と比較して、それぞれ約15%、約29%及び約53%高かった。末期腎不全患者(8例)では、4時間の透析によってカナグリフロジンはほとんど除去されなかった。[5.4、5.5、9.2.1、13.1.2参照]
また、正常腎機能者と軽度、中等度及び高度腎機能障害者における投与後24時間までの累積尿中グルコース排泄量のベースラインからの変化量(調整済み平均値)は、53.04、38.32、17.11及び4.27gであった15)(外国人のデータ)。
また、正常腎機能者と軽度、中等度及び高度腎機能障害者における投与後24時間までの累積尿中グルコース排泄量のベースラインからの変化量(調整済み平均値)は、53.04、38.32、17.11及び4.27gであった15)(外国人のデータ)。
16.6.2 肝機能障害者
(1)テネリグリプチン
(2)カナグリフロジン
16.6.3 高齢者における薬物動態
(1)テネリグリプチン
健康な高齢者(65歳以上75歳以下、12例)と非高齢者(45歳以上65歳未満、12例)に、テネリグリプチンとして20mgを空腹時に単回経口投与したとき、Cmax、AUC0-∞及びt1/2の非高齢者に対する高齢者の幾何最小二乗平均値の比(90%信頼区間)は、それぞれ1.006(0.871-1.163)、1.090(0.975-1.218)及び1.054(0.911-1.219)であり、ほぼ同様であった18)(外国人のデータ)。
(2)カナグリフロジン
2型糖尿病患者を対象とした用量設定試験から、高齢者(65歳以上、71〜73例)と非高齢者(65歳未満、217〜225例)において用量補正した血漿中カナグリフロジン濃度のトラフ値及び投与12週後のAUC0-2.17hを比較した。その結果、高齢者のトラフ濃度の平均値は非高齢者よりも約10〜30%高い値を示した19)。
16.7 薬物相互作用
16.7.1 テネリグリプチンの薬物動態に及ぼす影響
(1)ケトコナゾール
| 併用薬 | 併用薬用量 | テネリグリプチン用量 | テネリグリプチンの薬物動態パラメータ 幾何平均値の比(90%信頼区間) 併用/単独 | |
| Cmax | AUC0-∞ | |||
| ケトコナゾール | 400mg | 20mg | 1.37(1.25-1.50) | 1.49(1.39-1.60) |
(2)その他の薬剤
カナグリフロジン注)、ピオグリタゾン注)、グリメピリド注)及びメトホルミンは、いずれも併用投与による明らかな影響は認められなかった(外国人のデータ)。
注)カナグリフロジン、ピオグリタゾン、グリメピリドは日本人のデータ
16.7.2 カナグリフロジンの薬物動態に及ぼす影響
(1)リファンピシン
(2)その他の薬剤
テネリグリプチン注)、メトホルミン、シクロスポリン、プロベネシド、経口避妊薬(エチニルエストラジオール及びレボノルゲストレル)及びヒドロクロロチアジドは、いずれも併用投与による明らかな影響は認められなかった21)(外国人のデータ)。
注)テネリグリプチンは日本人のデータ
16.7.3 併用薬の薬物動態に及ぼすカナグリフロジンの影響
(1)ジゴキシン
(2)その他の薬剤
テネリグリプチン注)、グリベンクラミド(グリブリド)、メトホルミン、経口避妊薬(エチニルエストラジオール及びレボノルゲストレル)、ヒドロクロロチアジド、シンバスタチン、アセトアミノフェン及びワルファリンカリウムは、いずれも併用投与による明らかな影響は認められなかった21)(外国人のデータ)。
注)テネリグリプチンは日本人のデータ
本剤の有効成分であるカナグリフロジンの承認用量は100mg/日である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(テネリグリプチン上乗せ検証的試験)
食事療法及び運動療法に加えてカナグリフロジン単剤治療で血糖コントロールが不十分な2型糖尿病患者(154例)を対象に、テネリグリプチン又はプラセボを1日1回24週間投与した。結果は次表のとおりであった。
本試験において低血糖の副作用は認められなかった22)。
本試験において低血糖の副作用は認められなかった22)。
| カナグリフロジン100mg+プラセボ | カナグリフロジン100mg+テネリグリプチン20mg | ||||
| 投与前 | 投与前からの変化量 | 投与前 | 投与前からの変化量 | プラセボとの差 | |
| HbA1c(%) | 8.09±0.85 (n=77) | 0.00±0.08 | 7.98±0.80 (n=77) | −0.94±0.08 | −0.94±0.11♯ [−1.16,−0.72] |
| 空腹時血糖(mg/dL) | 151.0±25.0 (n=76) | 10.0±2.8 | 148.5±21.2 (n=77) | −5.6±2.7 | −15.6±3.9♯ [−23.3,−7.9] |
| 食事負荷後2時間血糖(mg/dL) | 232.6±45.6 (n=65) | 2.3±4.5 | 232.2±44.7 (n=73) | −35.3±4.3 | −37.6±6.2♯ [−49.9,−25.2] |
17.1.2 国内第III相試験(カナグリフロジン上乗せ検証的試験)
食事療法及び運動療法に加えてテネリグリプチン単剤治療で血糖コントロールが不十分な2型糖尿病患者(138例)を対象に、カナグリフロジン又はプラセボを1日1回24週間投与した。結果は次表のとおりであった。
本試験において低血糖の副作用は認められなかった23)24)。
本試験において低血糖の副作用は認められなかった23)24)。
| テネリグリプチン20mg+プラセボ | テネリグリプチン20mg+カナグリフロジン100mg | ||||
| 投与前 | 投与前からの変化量 | 投与前 | 投与前からの変化量 | プラセボとの差 | |
| HbA1c(%) | 7.87±0.83 (n=68) | −0.10±0.10 | 8.18±0.90 (n=70) | −0.97±0.10 | −0.88±0.14♯ [−1.15,−0.60] |
| 空腹時血糖(mg/dL) | 167.0±33.6 (n=67) | 3.9±3.5 | 173.9±30.6 (n=69) | −34.9±3.4 | −38.8±4.9♯ [−48.5,−29.2] |
| 食事負荷後2時間血糖(mg/dL) | 247.1±56.0 (n=61) | −9.2±5.1 | 256.1±45.6 (n=67) | −60.1±4.9 | −50.9±7.1♯ [−64.9,−36.9] |
17.1.3 国内第III相試験(長期投与試験)
17.3 その他
18. 薬効薬理
18.1 作用機序
18.1.1 テネリグリプチン
18.1.2 カナグリフロジン
ナトリウム−グルコース共輸送体2(SGLT2)は腎臓で近位尿細管に限局して分布しており、糸球体ろ過されたグルコースの大部分を血液中に再吸収させる役割を担っている29)。
カナグリフロジンは、SGLT2を選択的に阻害し、腎臓でのグルコースの再吸収を抑制することで、血中に過剰に存在するグルコースを尿糖として排泄し血糖低下作用を発揮する。
カナグリフロジンは、SGLT2を選択的に阻害し、腎臓でのグルコースの再吸収を抑制することで、血中に過剰に存在するグルコースを尿糖として排泄し血糖低下作用を発揮する。
18.2 薬理作用
18.2.1 耐糖能改善作用
2型糖尿病モデルであるZucker Diabetic Fatty(ZDF)ラットを用いた糖負荷試験において、テネリグリプチン及びカナグリフロジンの単回併用投与は、それぞれの単独投与と比較して、血漿中活性型GLP-1濃度を増加させ、血糖値上昇の抑制を増強した30)。
18.2.2 テネリグリプチン
(1)DPP-4阻害作用及びGLP-1分解抑制作用
・テネリグリプチンはヒト血漿中DPP-4活性を濃度依存的に阻害し、そのIC50値は1.75nmol/Lであった28)(in vitro)。
・テネリグリプチンはラット血漿中の活性型GLP-1の分解を濃度依存的に抑制した28)(in vitro)。
・インスリン抵抗性及び耐糖能異常を示す肥満モデルであるZucker Fattyラットを用いた糖負荷試験において、テネリグリプチンは単回投与により血漿中活性型GLP-1濃度及び血漿中インスリン濃度を増加させた28)。
・2型糖尿病患者において、テネリグリプチン20mgの1日1回投与は血漿中DPP-4活性を阻害し、血漿中活性型GLP-1濃度を増加させた31)。
(2)耐糖能改善作用
18.2.3 カナグリフロジン
19. 有効成分に関する理化学的知見
19.1. テネリグリプチン臭化水素酸塩水和物
19.2. カナグリフロジン水和物
20. 取扱い上の注意
<OD錠>
PTP包装開封後は、湿気を避けて保存すること。
22. 包装
<カナリア配合錠>
100錠[10錠(PTP)×10]
<カナリア配合OD錠>
100錠[10錠(PTP)×10、乾燥剤入り]
23. 主要文献
- Neal B,et al., N Engl J Med., 377 (7), 644-657, (2017) »PubMed
- 田辺ファーマ(株):健康成人男性を対象とした臨床薬理試験(社内資料)(カナリア配合錠:2017年7月3日承認、CTD2.7.6.1)
- 田辺ファーマ(株):健康成人男性を対象としたOD錠及び普通錠の生物学的同等性試験(社内資料)(カナリア配合OD錠:2025年2月17日承認、CTD2.7.6.1)
- 田辺ファーマ(株):テネリグリプチンの蛋白結合に関する検討(社内資料)(テネリア錠20mg:2012年6月29日承認、CTD2.6.4.4.2)
- 田辺ファーマ(株):カナグリフロジンの蛋白結合に関する検討(社内資料)(カナグル錠100mg:2014年7月4日承認、CTD2.6.4.4.2)
- Nakamaru Y,et al., Xenobiotica., 44 (3), 242-253, (2014) »PubMed
- 田辺ファーマ(株):テネリグリプチンの代謝に関する検討(社内資料)(テネリア錠20mg:2012年6月29日承認、CTD2.6.4.5.6、2.6.4.7.1、2.6.4.7.2)
- 田辺ファーマ(株):カナグリフロジンのマスバランス試験(社内資料)(カナグル錠100mg:2014年7月4日承認、CTD2.7.6.11)
- 田辺ファーマ(株):カナグリフロジンの代謝に関する検討(社内資料)(カナグル錠100mg:2014年7月4日承認、CTD2.6.4.5.5、2.6.4.7.1)
- 田辺ファーマ(株):テネリグリプチンの健康成人を対象とした単回投与試験(社内資料)(テネリア錠20mg:2012年6月29日承認、CTD2.7.6.3)
- 田辺ファーマ(株):テネリグリプチンのP-糖蛋白に関する試験(社内資料)(テネリア錠20mg:2012年6月29日承認、CTD2.6.4.7.3、2.6.4.7.4)
- 田辺ファーマ(株):テネリグリプチンのトランスポーターに関する検討(社内資料)(テネリア錠20mg:2012年6月29日承認、CTD2.6.4.7.5)
- 田辺ファーマ(株):カナグリフロジンのトランスポーターに関する検討(社内資料)(カナグル錠100mg:2014年7月4日承認、CTD2.6.4.7.2)
- 田辺ファーマ(株):テネリグリプチンの腎機能障害者における薬物動態試験(社内資料)(テネリア錠20mg:2012年6月29日承認、CTD2.7.6.9)
- 田辺ファーマ(株):カナグリフロジンの腎機能障害者における薬物動態試験(社内資料)(カナグル錠100mg:2014年7月4日承認、CTD2.7.6.14)
- 田辺ファーマ(株):テネリグリプチンの肝機能障害者における薬物動態試験(社内資料)(テネリア錠20mg:2012年6月29日承認、CTD2.7.6.10)
- 田辺ファーマ(株):カナグリフロジンの肝機能障害者における薬物動態試験(社内資料)(カナグル錠100mg:2014年7月4日承認、CTD2.7.6.15)
- 田辺ファーマ(株):テネリグリプチンの高齢者における薬物動態試験(社内資料)(テネリア錠20mg:2012年6月29日承認、CTD2.7.6.8)
- 田辺ファーマ(株):カナグリフロジンの第II相用量設定試験(社内資料)(カナグル錠100mg:2014年7月4日承認、CTD2.7.6.41)
- Nakamaru Y,et al., Clin Ther., 36 (5), 760-769, (2014) »PubMed
- 田辺ファーマ(株):カナグリフロジンの薬物相互作用試験(社内資料)(カナグル錠100mg:2014年7月4日承認、CTD2.7.2.2.3.2、2.7.2.2.5.1)
- 田辺ファーマ(株):2型糖尿病患者を対象とした検証的試験(1)(社内資料)(カナリア配合錠:2017年7月3日承認、CTD2.7.6.3)
- Kadowaki T,et al., Diabetes Obes Metab., 19 (6), 874-882, (2017) »PubMed
- 田辺ファーマ(株):2型糖尿病患者を対象とした検証的試験(2)(社内資料)(カナリア配合錠:2017年7月3日承認、CTD2.7.6.4)
- 田辺ファーマ(株):2型糖尿病患者を対象とした長期投与試験(社内資料)(カナリア配合錠:2017年7月3日承認、CTD2.7.6.5)
- 田辺ファーマ(株):テネリグリプチンのQTc間隔への影響試験(社内資料)(テネリア錠20mg:2012年6月29日承認、CTD2.7.6.15)
- Kreymann B,et al., Lancet., 2 (8571), 1300-1304, (1987) »PubMed
- Fukuda-Tsuru S,et al., Eur J Pharmacol., 696 (1-3), 194-202, (2012) »PubMed
- Mather A,Pollock C, Kidney Int., 79 (Suppl.120), S1-S6, (2011)
- Oguma T,et al., J Pharmacol Sci., 127 (4), 456-461, (2015) »PubMed
- Eto T,et al., Diabetes Obes Metab., 14 (11), 1040-1046, (2012) »PubMed
- Kuriyama C,et al., J Pharmacol Exp Ther., 351 (2), 423-431, (2014) »PubMed
- 田辺ファーマ(株):カナグリフロジンの2型糖尿病患者を対象とした臨床薬理試験(社内資料)(カナグル錠100mg:2014年7月4日承認、CTD2.7.6.12)
- 田辺ファーマ(株):カナグリフロジンのin vitro及びin vivo薬理作用(社内資料)(カナグル錠100mg:2014年7月4日承認、CTD2.6.2.2.1、2.6.2.2.2)
- Inagaki N,et al., Expert Opin Pharmacother., 15 (11), 1501-1515, (2014) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
第一三共株式会社
製品情報センター
〒103-8426
東京都中央区日本橋本町3-5-1
電話:0120-189-132
製品情報問い合わせ先
第一三共株式会社
製品情報センター
〒103-8426
東京都中央区日本橋本町3-5-1
電話:0120-189-132
26. 製造販売業者等
26.1 製造販売元
田辺ファーマ株式会社
大阪市中央区道修町3-2-10
26.2 販売元
第一三共株式会社
東京都中央区日本橋本町3-5-1