医薬品情報
| 総称名 | シオゾール |
|---|---|
| 一般名 | 金チオリンゴ酸ナトリウム |
| 欧文一般名 | Sodium Aurothiomalate |
| 製剤名 | 金チオリンゴ酸ナトリウム注射液 |
| 薬効分類名 | 水溶性金製剤 |
| 薬効分類番号 | 4420 |
| ATCコード | M01CB01 |
| KEGG DRUG |
D00992
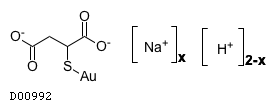
金チオリンゴ酸ナトリウム
|
| KEGG DGROUP |
DG01985
疾患修飾性抗リウマチ薬 (DMARD)
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年3月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| シオゾール注10mg | SHIOSOL Injection | 高田製薬 | 4420402A1031 | 367円/管 | 劇薬, 処方箋医薬品 |
| シオゾール注25mg | SHIOSOL Injection | 高田製薬 | 4420402A2038 | 367円/管 | 劇薬, 処方箋医薬品 |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
活動性の関節リウマチに対してのみ投与を考慮すること。また、一定期間の非ステロイド性抗炎症剤による治療で十分効果が認められないか、治療にもかかわらず疾患が進行性である場合には、投与開始を考慮することが望ましい。
6. 用法及び用量
下記の方法により、本剤を金チオリンゴ酸ナトリウムとして10mgから増量、毎週もしくは隔週に1回筋肉内注射するが、この間に効果発現をみた場合には適当な最低維持量の投与を維持する。
1)徐々に増量する方式
第1〜4週1回10mg
第5〜8週1回25mg
第9〜12週1回50mg
第13週以降1回50mg 場合によっては100mg
2)比較的急速に増量する方式
初期量1回10mg
2週間目1回25mg
3週間目以降1回50mg 場合によっては100mg
ただし、上記の用法・用量は大体の基準を示すものであり、年齢、体重、体質および症状に応じて適宜増減する。
7. 用法及び用量に関連する注意
毎週1回10mg又は25mg、あるいは2週に1回25mgの継続投与でも同様に有効であり、副作用も軽く有用であるとの報告がある1)。
8. 重要な基本的注意
8.1 投与開始に先立ち主な副作用について患者に説明するとともに、皮膚症状(そう痒感、皮疹)、口腔粘膜症状(金属臭・味、口内炎、舌炎)、出血傾向(皮下出血、その他)、呼吸器症状(乾性咳嗽、労作時の息切れ)、視力障害、消化器症状等異常が認められた場合には、速やかに主治医に連絡するよう指示することが望ましい。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 金製剤による副作用の既往のある患者(重篤な副作用の既往のある患者を除く)
9.1.2 蕁麻疹、乾癬等慢性皮疹のある患者
症状を悪化させるおそれがある。
9.1.3 薬物過敏症の既往のある患者
重篤な過敏症を起こすおそれがある。
9.2 腎機能障害患者
9.2.1 腎機能障害のある患者
9.2.2 腎疾患の既往歴のある患者
9.3 肝機能障害患者
9.3.1 肝機能障害のある患者
9.3.2 肝疾患の既往歴のある患者
9.5 妊婦
9.6 授乳婦
9.7 小児等
9.7.1 小児等
小児等を対象とした臨床試験は実施していない。
9.7.2 低出生体重児、新生児
外国において、ベンジルアルコールの静脈内大量投与(99〜234mg/kg)により、中毒症状(あえぎ呼吸、アシドーシス、痙攣等)が低出生体重児に発現したとの報告がある。本剤は添加剤としてベンジルアルコールを含有している。
9.8 高齢者
用量並びに投与間隔に留意するなど患者の状態を観察しながら慎重に投与すること。生理機能が低下していることが多く、副作用があらわれやすい。
10. 相互作用
10.1 併用禁忌
10.2 併用注意
| 免疫抑制剤 | 併用により、血液障害発生の可能性が高まる。 | 機序は不明 両者に血液障害の作用がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(頻度不明)
そう痒、発汗、血管浮腫、呼吸困難等があらわれることがある。
11.1.2 皮膚粘膜眼症候群(Stevens-Johnson症候群)(0.1%未満)、剥脱性皮膚炎(0.1〜5%未満)
皮膚粘膜眼症候群、剥脱性皮膚炎(初期症状:そう痒感、皮疹等)があらわれることがある。
11.1.5 間質性肺炎、肺線維症(0.1%未満)、好酸球性肺炎(頻度不明)
本剤投与中に重篤な間質性肺炎があらわれることがあるので、乾性咳嗽、呼吸困難等の症状がみられた場合は、速やかに胸部X線検査を実施し、間質性肺炎が疑われる場合には、直ちに本剤の投与を中止し、副腎皮質ホルモンを投与するなど適切な処置を行うこと5)。
11.1.6 気管支炎、気管支喘息発作の増悪(0.1%未満)
11.1.7 大腸炎(ときに劇症)(頻度不明)
11.1.8 角膜潰瘍、網膜出血(0.1%未満)
11.1.9 脳症、末梢性神経障害(頻度不明)、ミオキミア(0.1%未満)
脳症(錯乱、傾眠、痙攣等)、末梢性神経障害(多発性神経炎)、ミオキミアがあらわれることがある。
11.2 その他の副作用
| 5%以上又は頻度不明 | 0.1〜5%未満 | 0.1%未満 | |
| 皮膚・粘膜 | そう痒感、皮疹、皮膚炎、脱毛、口内炎、舌炎 | 色素沈着、結節性紅斑 | |
| 血液 | 好酸球増多 | ||
| 腎臓 | 蛋白尿、血尿等の腎障害、腎炎 | ||
| 肝臓 | 黄疸、AST上昇、ALT上昇、Al-P上昇 | ||
| 消化器 | 食欲不振、悪心・嘔吐、上腹部痛、消化管出血、下痢 | ||
| 眼 | 結膜炎、角膜金沈着症 | ||
| 亜硝酸塩様反応 | 注射直後の顔面潮紅、めまい、たちくらみ、霧視、発汗、悪心・嘔吐、衰弱感 重症の場合は失神、脈拍減少、舌の肥厚、呼吸困難 | ||
| その他 | 浮腫、しびれ感、関節炎の増悪、発熱 |
13. 過量投与
金製剤による中毒症状があらわれた場合には、次の処置を考慮すること。
・直ちに投薬を中止する。
・軽〜中等度の皮膚粘膜症状にはステロイド外用剤の使用
・重症の場合ステロイド剤の全身投与(プレドニゾロン1日10〜40mgを分割投与)
・肺合併症やその他の合併症には、ステロイド剤の大量投与(プレドニゾロン1日40〜100mgを分割投与)を行うが、効果不十分の場合にはBAL等の投与も考える。
14. 適用上の注意
14.1 薬剤投与時の注意
14.1.1 筋肉内注射にあたっては組織、神経等への影響を避けるため下記の点に注意すること。
・神経走行部位を避けるよう注意すること。
・注射針を刺入したとき激痛を訴えたり、血液の逆流をみた場合は、直ちに針を抜き、部位をかえて注射すること。
14.1.2 本剤の投与後少なくとも10分間は安静に保ち、観察を十分に行うこと。
15. その他の注意
15.2 非臨床試験に基づく情報
類似化合物(金チオグルコース)をマウスに400mg/kg 1回腹腔内に投与したところ、対照群に比較して肥満及び肥満に引き続く乳腺腫瘍発生増加が認められたとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 健康成人
健康成人男性4例に金チオリンゴ酸ナトリウム10mgを筋肉内注射した時の薬物動態パラメータを以下に示す6)(外国人によるデータ)。
| 投与量(mg) | n | AUC0-∞(μg・日/mL) | T1/2(日) | CLtot(mL/kg/日) | Vd(L/kg) |
| 10 | 4 | 9.17±1.90 | 25.11 | 7.0±0.6 | 0.26±0.05 |
16.1.2 関節リウマチ患者
関節リウマチ患者16例に金チオリンゴ酸ナトリウム25mg、7例に10mgを筋肉内注射した時の血漿中濃度推移を以下に示す7)。
図16-1 単回投与時の血清中濃度
16.3 分布
16.3.1 血液−脳関門通過性
通過し難い8)(外国人によるデータ)。
16.3.2 血液−胎盤関門通過性
16.3.3 母乳中への移行
16.3.4 その他
血漿蛋白結合率
95%がアルブミンと結合する10)(外国人によるデータ)。
16.4 代謝
投与された金塩は速やかに金成分と有機成分に分離され、異なった代謝を受けると考えられる11)(ラット、ウサギ)。
16.5 排泄
金維持療法中の関節リウマチ患者で、金製剤の最終投与後の尿中、糞中の合計金排泄率は、1週目に39%、追加投与が行われないと、2週目に16%、3週目に12%、4週目に10%であった。個人差が大きいが約70%は尿中に、30%は糞中に排泄される10)(外国人によるデータ)。
17. 臨床成績
17.3 その他
18. 薬効薬理
18.1 作用機序
ラットアジュバント関節炎に対する効果、免疫反応に対する影響、マクロファージや多核白血球の貪食能抑制作用、リソソームに対する作用などが報告されているが、作用機序に関する確定的な報告はない13)。
19. 有効成分に関する理化学的知見
19.1. 金チオリンゴ酸ナトリウム
20. 取扱い上の注意
20.1 光によって変化し着色することがあるので注意すること。
20.2 開封後は、なるべく短時間で使用するか、又は再度遮光紙で覆い、個装箱に入れた状態で保存すること。
22. 包装
<シオゾール注10mg>
1mL×10管(ガラスアンプル)
<シオゾール注25mg>
1mL×10管(ガラスアンプル)
23. 主要文献
- 吉沢久嘉, 最新医学, 35 (7), 1350-1356, (1980)
- Cohen,D.L.et al., Arthritis.Rheum., 24 (104), 104-105, (1981)
- Szabo,K.T.et al., Vet.Pathol., 15 (S-5), 97-102, (1978)
- 仲川義人, 医薬品相互作用, 898-899, (1994)
- 池田俊他, 日本胸部疾患学会雑誌, 24 (11), 1258-1264, (1986) »DOI
- Massarella,J.W.et al., Biopharm.Drug Dispos., 5, 101-107, (1984) »PubMed
- 上川英徳, リウマチ, 11 (4), 349-355, (1971)
- Gilg,G.et al., Acta Psychiatr.Neurol.Scand., 33 (2), 174-180, (1958) »PubMed
- Blau,S.P., Arthritis.Rheum., 16 (6), 777-778, (1973) »PubMed
- Mascarenhas,B.R.et al., Arthritis.Rheum., 15 (4), 391-402, (1972) »PubMed
- 石上宮子, 東女医大誌, 51 (11), 1670-1684, (1981)
- 近藤正一, 治療, 73 (3), 560-566, (1991)
- 日本薬局方解説書編集委員会編, 第十八改正 日本薬局方解説書, C-1548-1552, (2021)
24. 文献請求先及び問い合わせ先
文献請求先
高田製薬株式会社
文献請求窓口
〒336-8666
さいたま市南区沼影1丁目11番1号
電話:0120-989-813
FAX:048-816-4183
製品情報問い合わせ先
高田製薬株式会社
文献請求窓口
〒336-8666
さいたま市南区沼影1丁目11番1号
電話:0120-989-813
FAX:048-816-4183
26. 製造販売業者等
26.1 製造販売元
高田製薬株式会社
さいたま市西区宮前町203番地1