医薬品情報
| 総称名 | マクサルト |
|---|---|
| 一般名 | リザトリプタン安息香酸塩 |
| 欧文一般名 | Rizatriptan Benzoate |
| 製剤名 | リザトリプタン安息香酸塩錠・口腔内崩壊錠 |
| 薬効分類名 | 5-HT1B/1D受容体作動型片頭痛治療剤 |
| 薬効分類番号 | 2160 |
| ATCコード | N02CC04 |
| KEGG DRUG |
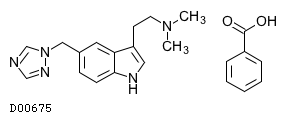
D00675
リザトリプタン安息香酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2020年7月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| マクサルト錠10mg | Maxalt | 杏林製薬 | 2160006F1026 | 383.5円/錠 | 劇薬, 処方箋医薬品注) |
| マクサルトRPD錠10mg | Maxalt | 杏林製薬 | 2160006F2022 | 386.6円/錠 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 心筋梗塞の既往歴のある患者、虚血性心疾患又はその症状・兆候のある患者、異型狭心症(冠動脈攣縮)のある患者[不整脈、狭心症、心筋梗塞を含む重篤な虚血性心疾患様症状があらわれることがある。]
2.3 脳血管障害や一過性脳虚血発作の既往のある患者[脳血管障害や一過性脳虚血発作があらわれることがある。]
2.4 末梢血管障害を有する患者[症状を悪化させる可能性が考えられる。]
2.5 コントロールされていない高血圧症の患者[一過性の血圧上昇を引き起こすことがある。]
2.6 重度の肝機能障害を有する患者[9.3.1参照]
2.8 エルゴタミン、エルゴタミン誘導体含有製剤、あるいは他の5-HT1B/1D受容体作動薬を投与中の患者[10.1参照]
2.9 モノアミン酸化酵素阻害剤(MAO阻害剤)を投与中、あるいは投与中止2週間以内の患者[10.1参照]
2.10 プロプラノロール塩酸塩を投与中の患者[10.1参照]
4. 効能または効果
片頭痛
5. 効能または効果に関連する注意
5.1 本剤は、国際頭痛学会による片頭痛診断基準1)により「前兆のない片頭痛」あるいは「前兆のある片頭痛」と診断が確定された場合にのみ使用すること。特に次のような患者は、クモ膜下出血等の脳血管障害や他の原因による頭痛の可能性があるので、本剤投与前に問診、診察、検査を十分に行い、頭痛の原因を確認してから投与すること。
・今までに片頭痛と診断が確定したことのない患者
・片頭痛と診断されたことはあるが、片頭痛に通常みられる症状や経過とは異なった頭痛及び随伴症状のある患者
5.2 家族性片麻痺性片頭痛、孤発性片麻痺性片頭痛、脳底型片頭痛あるいは眼筋麻痺性片頭痛の患者には投与しないこと。
6. 用法及び用量
通常、成人にはリザトリプタンとして1回10mgを片頭痛の頭痛発現時に経口投与する。
なお、効果が不十分な場合には、追加投与することができるが、前回の投与から2時間以上あけること。
ただし、1日の総投与量を20mg以内とする。
なお、効果が不十分な場合には、追加投与することができるが、前回の投与から2時間以上あけること。
ただし、1日の総投与量を20mg以内とする。
7. 用法及び用量に関連する注意
7.1 本剤は片頭痛の頭痛発現時に限り使用し、予防的に投与しないこと。
7.2 本剤投与により全く効果が認められない場合は、その発作に対して追加投与をしないこと。このような場合は、再検査の上、頭痛の原因を確認すること。
8. 重要な基本的注意
8.2 片頭痛あるいは本剤投与により眠気を催すことがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械操作に従事させないよう十分注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 虚血性心疾患の可能性のある患者
9.1.2 てんかんあるいは痙攣を起こしやすい器質的脳疾患のある患者
てんかん様発作が発現したとの報告がある。[11.1.4参照]
9.1.3 脳血管障害の可能性のある患者
脳血管障害があらわれるおそれがある。
9.1.4 ウォルフ・パーキンソン・ホワイト症候群(WPW症候群)又は他の心臓副伝導路と関連した不整脈のある患者
WPW症候群の典型的症状である重篤な発作性頻脈が発現したとの報告がある。[11.1.3参照]
9.1.5 コントロールされている高血圧症患者
一過性の血圧上昇や末梢血管抵抗の上昇がみられたとの報告がある。
9.2 腎機能障害患者
9.3 肝機能障害患者
9.3.1 重度の肝機能障害患者
9.3.2 肝機能障害患者(重度の肝機能障害患者を除く)
外国において、健康成人と比較して中等度の肝機能障害患者では、本剤のAUCとCmaxが増加する傾向が報告されている。[16.6.2参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中に移行することが報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
10. 相互作用
10.1 併用禁忌
| エルゴタミン製剤 エルゴタミン酒石酸塩・無水カフェイン・イソプロピルアンチピリン(クリアミン) エルゴタミン誘導体含有製剤 ジヒドロエルゴタミンメシル酸塩(ジヒデルゴット) エルゴメトリンマレイン酸塩(エルゴメトリンマレイン酸塩「F」) メチルエルゴメトリンマレイン酸塩(メテルギン) [2.8参照] | 血圧上昇又は血管攣縮が増強されるおそれがある。 本剤投与後にエルゴタミンあるいはエルゴタミン誘導体含有製剤を投与する場合、もしくはその逆の場合は、それぞれ24時間以上の間隔をあけて投与すること。 | 5-HT1B/1D受容体作動薬との薬理的相加作用により、相互に作用(血管収縮作用)を増強させる。 |
| 5-HT1B/1D受容体作動薬 スマトリプタンコハク酸塩(イミグラン) ゾルミトリプタン(ゾーミッグ) エレトリプタン臭化水素酸塩(レルパックス) ナラトリプタン塩酸塩(アマージ) [2.8参照] | 血圧上昇又は血管攣縮が増強されるおそれがある。 本剤投与後に他の5-HT1B/1D受容体作動薬を投与する場合、もしくはその逆の場合は、それぞれ24時間以内に投与しないこと。 | 併用により相互に作用を増強させる。 |
| MAO阻害剤 [2.9、16.4.2、16.7.1参照] | 本剤及び活性代謝物の消失半減期(t1/2)が延長し、血中濃度−時間曲線下面積(AUC)が増加するので、MAO阻害剤を投与中あるいは投与中止2週間以内の患者には本剤を投与しないこと。 | A型MAO阻害剤により本剤の代謝が阻害され、本剤の作用が増強される可能性がある。 |
| プロプラノロール塩酸塩(インデラル) [2.10、16.4.2、16.7.2参照] | 本剤の消失半減期(t1/2)が延長し、血中濃度−時間曲線下面積(AUC)が増加するので、プロプラノロールを投与中あるいは投与中止から次の期間が経過していない患者には本剤を投与しないこと。 錠剤:24時間、 徐放製剤:48時間 | 両薬剤の代謝にはA型MAOが関与するため本剤の代謝が阻害され、本剤の作用が増強される可能性がある。 |
10.2 併用注意
| 選択的セロトニン再取り込み阻害剤 フルボキサミンマレイン酸塩 パロキセチン塩酸塩水和物等 セロトニン・ノルアドレナリン再取り込み阻害剤 ミルナシプラン塩酸塩 | セロトニン症候群(不安、焦燥、興奮、頻脈、発熱、反射亢進、協調運動障害、下痢等)があらわれることがある。 | セロトニンの再取り込みを阻害し、セロトニン濃度を上昇させる。5-HT1B/1D受容体作動薬との併用により、セロトニン作用が増強する可能性が考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 アナフィラキシーショック、アナフィラキシー(いずれも頻度不明)
11.1.2 虚血性心疾患様症状(頻度不明)
11.1.3 頻脈(WPW症候群における)(頻度不明)
WPW症候群の典型的症状である重篤な発作性頻脈の報告がある。[9.1.4参照]
11.1.4 てんかん様発作(頻度不明)[9.1.2参照]
11.1.5 血管浮腫(頻度不明)
顔面、舌、咽頭等の浮腫があらわれることがある。
11.1.6 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)(頻度不明)
11.1.7 呼吸困難(頻度不明)
11.1.8 失神(頻度不明)
11.1.9 薬剤の使用過多による頭痛(頻度不明)[8.3参照]
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 頻度不明 | |
| 全身症状 | 倦怠感、脱力、胸痛、冷感 | 無力症・疲労 | |
| 循環器 | 動悸 | 頻脈、高血圧 | |
| 消化器 | 悪心、嘔吐、下痢、口内乾燥、口渇、腹痛 | 消化不良 | |
| 筋・骨格系 | 硬直 | 頸部痛、局所性重圧感、局所性絞扼感、筋力低下、顔面痛 | |
| 精神神経系 | 傾眠(7.7%) | めまい、感覚減退、錯感覚、知覚過敏 | 頭痛、精神明瞭性の減退、不眠症、振戦、運動失調、神経過敏、失見当識、多幸症 |
| 呼吸器 | 鼻乾燥 | 咽頭不快感、喘鳴 | |
| 皮膚 | 蕁麻疹、そう痒症 | 潮紅、発汗、発疹 | |
| 肝臓 | 肝機能異常(ALT上昇、AST上昇等) | ||
| その他 | CK上昇、光視症、頻尿、食欲減退 | 霧視、ほてり、温感、味覚異常 |
13. 過量投与
13.1 症状
過量投与の主な症状は、傾眠、めまい、高血圧又は他の血管収縮の徴候を含む心・血管系の事象である。その他に、嘔吐、徐脈、失神、アトロピン反応性の3度房室ブロック、失禁が起きる可能性がある。
13.2 処置
本剤を過量に投与した場合は、胃洗浄及び活性炭による吸着を行い、12時間以上は症状及び心電図のモニタリングを行うこと。
14. 適用上の注意
14.1 薬剤交付時の注意
<製剤共通>
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
<RPD錠>
14.1.2 服用直前まで外袋を開封しないこと。
14.1.3 取り出したブリスターパックを乾いた手で剥がして、本剤を取り出し服用すること。
14.1.4 本剤は舌の上にのせて唾液を浸潤させると崩壊するため、水なしで服用可能である。また、水で服用することもできる。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
(1)経口投与
健康成人男子にリザトリプタン錠剤又は口腔内崩壊錠10mgを空腹時に単回経口投与したとき、未変化体はそれぞれ投与後1.0及び1.3時間に最高血漿中濃度(Cmax)に到達し、1.6及び1.7時間の半減期で消失した。N-脱メチル体のAUC0→∞は、リザトリプタンの14%及び11%であった。
| 剤形 | Tmax(hr) | t1/2(hr) | Cmax(ng/mL) | AUC0→∞(ng・hr/mL) |
| 錠剤 | 1.0±0.6 | 1.6±0.3 | 20.3±5.3 | 69.3±18.2 |
| 口腔内崩壊錠 | 1.3±0.7 | 1.7±0.3 | 19.3±6.7 | 68.0±22.0 |
健康成人男子におけるリザトリプタン10mg単回経口投与後の血漿中未変化体濃度推移(平均±標準偏差、n=16)
(2)静脈内投与
健康成人にリザトリプタン1〜4mgを単回静脈内投与注)したとき、血漿クリアランスは1062mL/min、定常状態分布容積は127Lであった(外国人データ)。
(3)片頭痛患者
片頭痛患者にリザトリプタン5mg錠を単回経口投与注)したとき、AUC、Cmax及びTmaxは発作時と非発作時で差はなく、片頭痛発作時の薬物動態は非発作時に比べて変化しなかった(外国人データ)。
16.1.2 反復投与
健康成人男女にリザトリプタン10mg錠を1日目に1回、3及び4日目に2時間間隔で1日3回注)及び5日目に1回空腹時経口投与したとき、AUC0→24hrの幾何平均比(5日目/1日目)は未変化体で0.99であり、N-脱メチル体では1.11であった。
| 投与日 | 1日投与量(mg) | Tmaxa)(hr) | t1/2(hr) | Cmax(ng/mL) | AUC0→24hr(ng・hr/mL) |
| 1日目 | 10 | 0.8±0.4 | 1.9±0.4 | 33.0±13.5 | 81.6±25.3 |
| 3日目 | 30 | 1.4±0.5 | 2.1±0.3 | 49.1±11.7 | 279.5±62.8 |
| 5日目 | 10 | 1.1±0.5 | 1.9±0.4 | 28.0±12.5 | 79.5±20.1 |
16.2 吸収
16.2.1 食事の影響
健康成人男子にリザトリプタン5mg注)カプセル剤を単回経口投与したとき、未変化体のTmaxは空腹時で1.4±0.4時間、食後で2.7±1.0時間であった。AUC及びCmaxは、未変化体及びN-脱メチル体共に空腹時と比べ、いずれも有意に変化しなかった。
| 食事条件 | Tmax(hr) | t1/2(hr) | Cmax(ng/mL) | AUC0→∞(ng・hr/mL) |
| 空腹時 | 1.4±0.4 | 2.6±1.3 | 7.6±1.8 | 32.4±11.7 |
| 食後 | 2.7±1.0 | 2.1±0.8 | 8.9±6.1 | 37.1±11.9 |
16.2.2 初回通過効果の有無及び生物学的利用率
リザトリプタンは初回通過効果を受ける。健康成人にリザトリプタン10mg錠を単回経口投与したときの生物学的利用率は、45%であった(外国人データ)。
16.4 代謝
16.4.1 健康成人にリザトリプタン10mg錠を単回及び反復経口投与(1日3回注)、2時間毎に4日間)したときのヒト血漿中代謝物としてN-脱メチル体、インドール酢酸体、6位水酸化体及びその硫酸抱合体が認められ、N-酸化体は微量代謝物であった(外国人データ)。
16.4.2 リザトリプタンの主要代謝経路は、A型MAOによる酸化的脱アミノ化であり、薬理学的に不活性なインドール酢酸体を生成する。[10.1参照]
16.4.3 リザトリプタンは、各種ヒト肝チトクロムP450各分子種(CYP3A4/5、1A2、2C9、2C19、2E1)のマーカー活性を阻害しないが、CYP2D6に対しては、競合的に阻害する(Ki=1400nmol/L)(in vitro)。
16.5 排泄
16.5.1 健康成人にリザトリプタン錠剤又は口腔内崩壊錠10mgを空腹時に単回経口投与したとき、未変化体及びN-脱メチル体の尿中排泄率は、リザトリプタン錠投与ではそれぞれ約14%及び1.3%、口腔内崩壊錠投与ではそれぞれ約12%及び1.1%であった。
16.5.2 健康成人に14C標識リザトリプタン10mgを単回経口投与したとき、投与後5日までに放射能の82.4%は尿中に、11.5%は糞便中に排泄された。また、投与量の約14%は未変化体として、51%はインドール酢酸代謝物として尿中に排泄された(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
16.6.2 肝機能障害患者
16.6.3 高齢者
健康高齢者(65〜77歳)にリザトリプタン10mg錠を経口投与したときの薬物動態は健康非高齢者(18〜45歳)と比べ、差はなかった(外国人データ)2)。
16.7 薬物相互作用
16.7.1 モクロベミド
16.7.2 プロプラノロール塩酸塩
注)本剤の承認された1回の用法・用量は「10mgを経口投与」であり、1日の総投与量は「20mg以内」である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
日本人片頭痛患者140例を対象に、片頭痛発作発現時にリザトリプタン10mg錠又はプラセボ錠1錠を単回経口投与する二重盲検比較試験を実施した。投与2時間後の頭痛改善率(頭痛の程度が「重度」又は「中等度」から「軽度」又は「なし」に改善した割合)は10mg群が59.4%(41/69例)、プラセボ群が34.3%(24/70例)であり、10mg群の頭痛改善率はプラセボ群と比べて有意に高かった(片側p<0.025)。
10mg群の自覚症状及び他覚所見に関する副作用の発現頻度は23.2%(16/69例)、臨床検査値に関する副作用の発現頻度は2.9%(2/69例)であった。主な副作用は傾眠8.7%(6/69例)、倦怠感4.3%(3/69例)、脱力、嘔吐、浮動性めまい、感覚減退及びALT上昇が各2.9%(2/69例)であった。
10mg群の自覚症状及び他覚所見に関する副作用の発現頻度は23.2%(16/69例)、臨床検査値に関する副作用の発現頻度は2.9%(2/69例)であった。主な副作用は傾眠8.7%(6/69例)、倦怠感4.3%(3/69例)、脱力、嘔吐、浮動性めまい、感覚減退及びALT上昇が各2.9%(2/69例)であった。
17.1.2 国内第III相オープン試験
日本人片頭痛患者41例を対象に、片頭痛発作発現時にリザトリプタン10mg口腔内崩壊錠1錠を単回経口投与する試験を実施した。本剤投与2時間後の頭痛改善率は80.0%(32/40例)であった。
本剤投与による自覚症状及び他覚所見に関する副作用の発現頻度は22.0%(9/41例)、臨床検査値に関する副作用の発現頻度は4.9%(2/41例)であった。主な副作用は傾眠17.1%(7/41例)であった。
本剤投与による自覚症状及び他覚所見に関する副作用の発現頻度は22.0%(9/41例)、臨床検査値に関する副作用の発現頻度は4.9%(2/41例)であった。主な副作用は傾眠17.1%(7/41例)であった。
17.1.3 国内第III相長期投与試験
日本人片頭痛患者42例を対象に、片頭痛発作発現時にリザトリプタン10mg口腔内崩壊錠1錠(1発作24時間以内に最大3錠まで投与可能)注)を最長21週間経口投与する試験を実施した。片頭痛発作回数別の本剤1錠目投与2時間後の頭痛改善率は、それぞれ発作1回目が73.8%(31/42例)、2回目が77.8%(28/36例)、3回目が69.0%(20/29例)、4回目が70.8%(17/24例)、5回目が90.9%(20/22例)であった。本剤の投与回数の増加に伴う治療効果の減弱は認められなかった。
本剤投与による自覚症状及び他覚所見に関する副作用の発現頻度は23.8%(10/42例)、臨床検査値に関する副作用の発現頻度は4.8%(2/42例)であった。主な副作用は傾眠9.5%(4/42例)、倦怠感及び浮動性めまいが各7.1%(3/42例)であった。
本剤投与による自覚症状及び他覚所見に関する副作用の発現頻度は23.8%(10/42例)、臨床検査値に関する副作用の発現頻度は4.8%(2/42例)であった。主な副作用は傾眠9.5%(4/42例)、倦怠感及び浮動性めまいが各7.1%(3/42例)であった。
17.1.4 海外第III相試験(再発発作試験)
外国人片頭痛患者1218例を対象に、片頭痛発作発現時にリザトリプタン5mg注)錠、10mg錠又はプラセボ錠1錠を1回経口投与する(頭痛改善後に再発した場合は、24時間以内の2回までの再発に対し投与する)注)二重盲検比較試験を実施した。投与2時間後の頭痛改善率は10mg群が70.8%(322/455例)、プラセボ群が35.1%(106/302例)であり、10mg群の頭痛改善率はプラセボ群と比べて有意に高かった(p<0.05)。また、頭痛再発時においても、10mg群はプラセボ群と比べて高い頭痛改善率を示した。
10mg群の自覚症状及び他覚所見に関する副作用の発現頻度は30.7%(140/456例)、臨床検査値に関する副作用の発現頻度は0.4%(2/456例)であった。主な副作用は浮動性めまい8.1%(37/456例)、傾眠7.2%(33/456例)、無力感5.3%(24/456例)、嘔気3.3%(15/456例)であった。
10mg群の自覚症状及び他覚所見に関する副作用の発現頻度は30.7%(140/456例)、臨床検査値に関する副作用の発現頻度は0.4%(2/456例)であった。主な副作用は浮動性めまい8.1%(37/456例)、傾眠7.2%(33/456例)、無力感5.3%(24/456例)、嘔気3.3%(15/456例)であった。
17.1.5 海外第III相試験(繰り返し発作試験)
外国人片頭痛患者407例を対象に、片頭痛発作発現時にリザトリプタン10mg錠又はプラセボ錠1錠(1発作24時間以内に同用量を最大3錠まで投与可能)注)を、4回の発作に対して経口投与する二重盲検比較試験を実施した。第1発作における投与2時間後の頭痛改善率は10mg群が76.9%(246/320例)、プラセボ群が36.6%(30/82例)であり、10mg群の頭痛改善率はプラセボ群と比べて有意に高かった(p<0.05)。また、第2〜第4発作においても、10mg群は一貫してプラセボ群より高い頭痛改善率を示した。
10mg群の自覚症状及び他覚所見に関する副作用の発現頻度は46.1%(182/395例)、臨床検査値に関する副作用の発現頻度は1.8%(7/395例)であった。主な副作用は浮動性めまい12.7%(50/395例)、傾眠11.9%(47/395例)、嘔気6.6%(26/395例)、無力感5.8%(23/395例)、錯感覚5.6%(22/395例)であった。
10mg群の自覚症状及び他覚所見に関する副作用の発現頻度は46.1%(182/395例)、臨床検査値に関する副作用の発現頻度は1.8%(7/395例)であった。主な副作用は浮動性めまい12.7%(50/395例)、傾眠11.9%(47/395例)、嘔気6.6%(26/395例)、無力感5.8%(23/395例)、錯感覚5.6%(22/395例)であった。
17.1.6 海外第III相試験
外国人片頭痛患者1099例を対象に、片頭痛発作発現時にリザトリプタン5mg注)錠、10mg錠、スマトリプタン100mg錠又はプラセボ錠を単回経口投与する二重盲検比較試験を実施した。投与2時間後の頭痛改善率は10mg群が67.0%(258/385例)、プラセボ群が40.3%(64/159例)であり、10mg群の頭痛改善率はプラセボ群と比べて有意に高かった(p<0.05)。
10mg群の自覚症状及び他覚所見に関する副作用の発現頻度は32.6%(126/387例)、臨床検査値に関する副作用の発現頻度は0.8%(3/387例)であった。主な副作用は傾眠6.7%(26/387例)、浮動性めまい5.9%(23/387例)、無力感5.9%(23/387例)、嘔気3.4%(13/387例)であった。
10mg群の自覚症状及び他覚所見に関する副作用の発現頻度は32.6%(126/387例)、臨床検査値に関する副作用の発現頻度は0.8%(3/387例)であった。主な副作用は傾眠6.7%(26/387例)、浮動性めまい5.9%(23/387例)、無力感5.9%(23/387例)、嘔気3.4%(13/387例)であった。
注)本剤の承認された1回の用法・用量は「10mgを経口投与」であり、1日の総投与量は「20mg以内」である。
18. 薬効薬理
18.1 作用機序
18.2 5-HT1B/1D受容体に対する選択的結合
リザトリプタンは、受容体結合試験において、5-HT1B及び5-HT1D受容体に対し高い親和性を示したが、その他の5-HT受容体サブタイプやその他の受容体(α及びβ-アドレナリン受容体、ドーパミン受容体、ヒスタミン受容体、ムスカリン受容体、ベンゾジアゼピン受容体等)に対しては、非常に弱い親和性しか示さなかった(in vitro)。
18.3 ヒトクローン5-HT1B及び5-HT1D受容体に対する作用
リザトリプタンは、ヒトクローン5-HT1B及び5-HT1D受容体へのGTPγS結合試験において、5-HTとほぼ変わらない作動薬としての活性を示した(in vitro)。
18.4 ヒト摘出血管に対する作用
18.5 麻酔動物の血管床に対する作用
麻酔したフェレットに静脈内投与(0.3〜1000μg/kg)すると、血圧には影響を与えずに、用量依存的な頸動脈血管抵抗の上昇が認められた。また麻酔したイヌに静脈内投与した場合も、頸動脈血流量の低下作用が認められたが、冠動脈血流には高用量300μg/kg以上でしか抑制作用はみられなかった。麻酔したイヌに十二指腸内投与(30〜1000μg/kg)した場合も、同様の頸動脈血流減少作用がみられた。
18.6 硬膜血管からの神経性血漿蛋白漏出に対する作用
麻酔したラットに静脈内投与(1〜1000μg/kg)すると、三叉神経節電気刺激による硬膜血管からの血漿蛋白漏出を用量依存的に抑制した9)。
18.7 神経刺激による硬膜血管拡張に対する作用
麻酔したラットに静脈内投与(1〜10mg/kg)すると、血管周囲神経電気刺激による硬膜血管拡張を、3mg/kg以上で抑制した9)。
18.8 硬膜血管(周囲神経)電気刺激による三叉神経核尾部の反応に対する作用
麻酔したラットに静脈内投与(0.3〜3mg/kg)すると、硬膜血管(周囲神経)電気刺激による三叉神経核尾部の活動電位発生頻度を、1mg/kg以上で用量依存的に抑制した10)。
19. 有効成分に関する理化学的知見
19.1. リザトリプタン安息香酸塩
22. 包装
<マクサルト錠10mg>
6錠[6錠(PTP)×1]
18錠[6錠(PTP)×3]
<マクサルトRPD錠10mg>
6錠[3錠(ポリプロピレンケース)×2]
18錠[3錠(ポリプロピレンケース)×6]
23. 主要文献
- Headache Classification Committee of the International Headache Society:Cephalalgia., 38, 1-211, (2018)
- Musson,D.G.et al., Int.J.Clin.Pharmacol.Ther., 39, 447-452, (2001) »PubMed
- van Haarst,A.D.et al., Br.J.Clin.Pharmacol., 48, 190-196, (1999) »PubMed
- Goldberg,M.R.et al., Br.J.Clin.Pharmacol., 52, 69-76, (2001) »PubMed
- Longmore,J.et al., Br.J.Clin.Pharmacol., 46, 577-582, (1998) »PubMed
- Ferro,A.et al., Br.J.Clin.Pharmacol., 40, 245-251, (1995) »PubMed
- Longmore,J.et al., Br.J.Clin.Pharmacol., 42, 431-441, (1996) »PubMed
- Longmore,J.et al., Funct.Neurol., 12, 3-9, (1997) »PubMed
- Williamson,D.J.et al., Eur.J.Pharmacol., 328, 61-64, (1997) »PubMed
- Cumberbatch,M.J.et al., Eur.J.Pharmacol., 328, 37-40, (1997) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
エーザイ株式会社
hhcホットライン
〒112-8088
東京都文京区小石川4-6-10
電話:フリーダイヤル 0120-419-497
製品情報問い合わせ先
エーザイ株式会社
hhcホットライン
〒112-8088
東京都文京区小石川4-6-10
電話:フリーダイヤル 0120-419-497
26. 製造販売業者等
26.1 製造販売元
杏林製薬株式会社
東京都千代田区神田駿河台四丁目6番地
26.2 販売元
エーザイ株式会社
東京都文京区小石川4-6-10