医薬品情報
| 総称名 | ピルシカイニド塩酸塩 |
|---|---|
| 一般名 | ピルシカイニド塩酸塩水和物 |
| 欧文一般名 | Pilsicainide Hydrochloride Hydrate |
| 薬効分類名 | 不整脈治療剤 |
| 薬効分類番号 | 2129 |
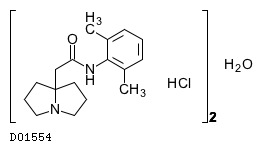
| KEGG DRUG |
D01554
ピルシカイニド塩酸塩水和物
|
| KEGG DGROUP |
DG01653
抗不整脈薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年12月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ピルシカイニド塩酸塩カプセル25mg「サワイ」 (後発品) | PILSICAINIDE HYDROCHLORIDE Capsules[SAWAI] | 沢井製薬 | 2129008M1113 | 12.7円/カプセル | 劇薬, 処方箋医薬品注) |
| ピルシカイニド塩酸塩カプセル50mg「サワイ」 (後発品) | PILSICAINIDE HYDROCHLORIDE Capsules[SAWAI] | 沢井製薬 | 2129008M2128 | 21.5円/カプセル | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 うっ血性心不全のある患者[不整脈(心室頻拍、心室細動等)の誘発又は増悪、陰性変力作用による心不全の悪化を来すおそれが高い。]
2.2 高度の房室ブロック、高度の洞房ブロックのある患者[刺激伝導抑制作用により、これらの障害を更に悪化させるおそれがある。][9.1.3参照]
4. 効能または効果
下記の状態で他の抗不整脈薬が使用できないか、又は無効の場合
6. 用法及び用量
通常、成人にはピルシカイニド塩酸塩水和物として、1日150mgを3回に分けて経口投与する。
なお、年齢、症状により適宜増減するが、重症又は効果不十分な場合には、1日225mgまで増量できる。
なお、年齢、症状により適宜増減するが、重症又は効果不十分な場合には、1日225mgまで増量できる。
7. 用法及び用量に関連する注意
7.1 透析を必要とする腎不全患者では、1日25mgから投与を開始するなど、患者の状態を観察しながら慎重に投与すること。[9.2.1参照]
7.2 高齢者では、1回25mgから投与を開始するなど、患者の状態を観察しながら慎重に投与すること。[9.8参照]
8. 重要な基本的注意
8.1 本剤の投与に際しては、頻回に患者の状態を観察し、心電図、脈拍、血圧、心胸比を定期的に調べること。PQの延長、QRS幅の増大、QTの延長、徐脈、血圧低下等の異常所見が認められた場合には、直ちに減量又は投与を中止すること。
8.2 1日用量150mgを超えて投与する場合は副作用発現の可能性が増大するので注意すること。
8.3 本剤でBrugada症候群に特徴的な心電図変化(右脚ブロック及び右側胸部誘導(V1〜V3)のST上昇)の顕在化又はそれに伴う心室細動、心室頻拍、心室性期外収縮を発現させたとの報告があるので注意すること。
8.4 めまい等があらわれることがあるので、自動車の運転等、危険を伴う機械の操作に従事する際には注意するよう患者に十分に説明すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 基礎心疾患(心筋梗塞、弁膜症、心筋症等)のある患者
心不全を来すおそれのある患者では、少量から開始するなど投与量に十分注意するとともに、頻回に心電図検査を実施すること。また、開始後1〜2週間は入院させること。心室頻拍、心室細動等が発現するおそれが高い。なお、心筋梗塞発症後の無症候性あるいは軽度の症状を伴う患者の場合は、治療上やむを得ないと判断される場合を除き、投与しないこと。[15.1参照]
9.1.2 心不全の既往のある患者
心不全を来すおそれがある。
9.1.3 刺激伝導障害(房室ブロック、洞房ブロック、脚ブロック等)のある患者(高度の房室ブロック、高度の洞房ブロックのある患者を除く)
刺激伝導抑制作用により、これらの障害を更に悪化させるおそれがある。[2.2参照]
9.1.4 著明な洞性徐脈のある患者
高度の徐脈、洞停止を来すおそれがある。
9.1.5 血清カリウム低下のある患者
催不整脈作用が発現するおそれがある。
9.1.6 他の抗不整脈薬を併用している患者
少量から開始するなど投与量に十分注意するとともに、頻回に心電図検査を実施すること。[10.2参照]
9.1.7 恒久的ペースメーカー使用中あるいは一時的ペーシング中の患者
ペースメーカー使用中の患者に投与する場合は適当な間隔でペーシング閾値を測定すること。また、異常が認められた場合には直ちに減量又は投与を中止すること。本剤は心臓ペーシング閾値を上昇させる可能性がある。
9.2 腎機能障害患者
9.3 肝機能障害患者
9.3.1 重篤な肝機能障害のある患者
AST、ALT、LDH等の上昇が報告されている。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(ラット)で静脈内投与した場合、胎児に移行することが報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中に移行することが報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
入院させて本剤の投与を開始することが望ましい。少量から開始するなど投与量に十分注意するとともに、頻回に心電図検査を実施すること。肝・腎機能が低下していることが多く、また体重が少ない傾向があるなど副作用が発現しやすい。[7.2参照]
10. 相互作用
10.2 併用注意
| リファンピシン | 本剤の作用を減弱させることがある。 | リファンピシンによりチトクロームP450の産生が誘導され、本剤の代謝速度が促進し、血中濃度が低下する可能性が考えられている。 |
| カルシウム拮抗薬 ベラパミル β-受容体遮断薬 プロプラノロール ジギタリス製剤 ジゴキシン 硝酸・亜硝酸エステル系薬剤 ニトログリセリン [9.1.6参照] | 動物実験(イヌ)において、本剤の作用が増強される可能性が報告されている。 | 機序は明らかではないが、作用増強の可能性が考えられている。 |
| セチリジン | 両剤の血中濃度が上昇し、本剤の副作用が発現したとの報告がある。 | 腎でのトランスポーターを介した排泄が競合するためと考えられている。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 心室細動(頻度不明)、心室頻拍(Torsades de pointesを含む)(頻度不明)、洞停止(頻度不明)、完全房室ブロック(頻度不明)、失神(頻度不明)、心不全(頻度不明)
ショック、心停止に至る場合もあるので、頻回な心電図検査、胸部X線検査等を実施すること。
11.1.2 急性腎障害(頻度不明)
ショック等による急性腎障害があらわれることがある。
11.1.3 肝機能障害(頻度不明)
AST、ALT、γ-GTPの上昇等を伴う肝機能障害があらわれることがある。
11.2 その他の副作用
| 0.1〜5%未満 | 頻度不明 | |
| 循環器 | QRS幅の増大、QT延長、房室ブロック、洞房ブロック、胸部不快感、動悸、心室性期外収縮、上室性期外収縮、心房細動、上室性頻拍 | 胸痛、徐脈、心房粗動、血圧低下 |
| 消化器 | 胃痛、悪心、嘔吐、口渇、下痢、腹部不快感 | 便秘、食欲不振 |
| 精神神経系 | めまい、頭痛、眠気 | 振戦、不眠、しびれ |
| 血液 | 好酸球増加、リンパ球減少 | 白血球数減少、血小板数減少 |
| 肝臓 | AST上昇、ALT上昇、LDH上昇 | |
| 過敏症 | 発疹、蕁麻疹 | そう痒感 |
| 腎臓 | BUN上昇、クレアチニン上昇、尿蛋白陽性 | |
| 泌尿器 | 排尿困難 | |
| その他 | 全身倦怠感、CK上昇、脱力感 | 熱感 |
13. 過量投与
13.1 症状
過量投与又は高度の腎機能障害により、本剤の血中濃度が上昇した場合、刺激伝導障害(著明なQRS幅の増大等)、心停止、心不全、心室細動、心室頻拍(Torsades de pointesを含む)、洞停止、徐脈、ショック、失神、血圧低下等の循環器障害、構語障害等の精神・神経障害を引き起こすことがある。
13.2 処置
直ちに本剤の投与を中止し、体外ペーシングや直流除細動を考慮する等適切な対症療法を行うこと。なお、本剤の血液透析による除去率は最大約30%と報告されている。[9.2.1参照]
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1
健康成人男性18例にピルシカイニド塩酸塩水和物25mg、50mg及び100mg注)を空腹時単回経口投与したとき、消化管からの吸収は良好であり、血漿中薬物動態パラメータは以下のとおりであった2)。
| 投与量 (mg) | 例数 | Tmax (hr) | Cmax (μg/mL) | t1/2 (hr) | AUC (μg・hr/mL) |
| 25 | 2 | 1.61±0.01 | 0.150±0.002 | 4.4±0.39 | 1.278±0.080 |
| 50 | 8 | 1.22±0.18 | 0.356±0.027 | 4.8±0.34 | 2.975±0.112 |
| 100 | 8 | 1.06±0.18 | 0.650±0.029 | 4.9±0.37 | 5.238±0.307 |
16.1.2 生物学的同等性試験
<ピルシカイニド塩酸塩カプセル25mg「サワイ」>
ピルシカイニド塩酸塩カプセル25mg「サワイ」とサンリズムカプセル25mgを健康成人男子にそれぞれ1カプセル(ピルシカイニド塩酸塩水和物として25mg)空腹時単回経口投与(クロスオーバー法)し、血漿中ピルシカイニド濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された5)。
| Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | AUC0-24hr (ng・hr/mL) | |
| ピルシカイニド塩酸塩カプセル25mg「サワイ」 | 176±24 | 1.5±0.4 | 5.2±0.6 | 1453±225 |
| サンリズムカプセル25mg | 182±29 | 1.4±0.4 | 5.3±1.0 | 1444±224 |
<ピルシカイニド塩酸塩カプセル50mg「サワイ」>
ピルシカイニド塩酸塩カプセル50mg「サワイ」とサンリズムカプセル50mgを健康成人男子にそれぞれ1カプセル(ピルシカイニド塩酸塩水和物として50mg)空腹時単回経口投与(クロスオーバー法)し、血漿中ピルシカイニド濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された6)。
| Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | AUC0-24hr (ng・hr/mL) | |
| ピルシカイニド塩酸塩カプセル50mg「サワイ」 | 325±29 | 1.6±0.5 | 4.8±0.8 | 2497±207 |
| サンリズムカプセル50mg | 320±32 | 1.6±0.4 | 4.9±0.7 | 2480±230 |
血漿中濃度ならびにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.3 分布
16.4 代謝
16.5 排泄
健康成人男性18例にピルシカイニド塩酸塩水和物25mg、50mg及び100mg注)を空腹時単回経口投与したとき、24時間以内に75〜86%が未変化体として尿中に排泄された。また50mg、100mg投与群においては、24時間以内に4.5〜6.5%が代謝物2-ヒドロキシメチル体として尿中に排泄された2)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
ピルシカイニド塩酸塩水和物は腎排泄型の薬剤であり、次のように腎機能障害患者、腎機能が低下している高齢者では半減期が延長する。したがって内因性クレアチニンクリアランス(CLcr)を指標とした障害の程度に応じて、投与間隔をあけるかあるいは症例によって投与量を減じるなど、用法及び用量に十分注意する必要がある13)。[9.2参照]
50≦CLcr:半減期は腎機能正常例とほぼ同じ。
20≦CLcr<50:半減期は腎機能正常例に比し約2倍に延長する。
CLcr<20:半減期は腎機能正常例に比し約5倍に延長する。
| 腎機能CLcr (mL/min) | 例数 | Tmax (hr) | Cmax (μg/mL) | t1/2 (hr) | Vd (L/kg) | CLtot (mL/min) |
| CLcr≧80 | 6 | 3.1±0.6 | 0.41±0.08 | 3.4±0.2 | 1.48±0.19 | 280.0±37.5 |
| 80>CLcr≧50 | 10 | 2.7±0.8 | 0.46±0.03 | 5.7±0.3 | 1.46±0.11 | 182.8±11.8 |
| 50>CLcr≧20 | 8 | 3.1±0.8 | 0.51±0.05 | 9.3±1.1 | 1.70±0.15 | 123.4±19.3 |
| 20>CLcr | 8 | 3.8±0.7 | 0.63±0.05 | 23.7±2.0 | 1.46±0.11 | 38.8±4.6 |
注)本剤の承認された用法及び用量は、1日150〜225mgを3回に分けて投与である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床試験
心室性期外収縮を対象とした二重盲検比較試験において、ピルシカイニド塩酸塩水和物150mg投与群88例、ジソピラミド300mg投与群87例での全般改善度は、それぞれ著明改善が51.4%(37/72例)、33.8%(26/77例)、中等度改善以上が70.8%(51/72例)、54.5%(42/77例)であった。副作用発現率はピルシカイニド塩酸塩水和物投与群で8.1%(7/86例)であり、主なものは口渇、めまい等であった14)。
17.1.2 国内第III相試験
上室性期外収縮を対象とした二重盲検比較試験において、ピルシカイニド塩酸塩水和物150mg投与群41例、ジソピラミド300mg投与群39例での全般改善度は、それぞれ著明改善が41.9%(13/31例)、26.7%(8/30例)、中等度改善以上が67.7%(21/31例)、46.7%(14/30例)であった。副作用発現率はピルシカイニド塩酸塩水和物投与群で5.1%(2/39例)で、頭のふらつき感、胸部不快感であった15)。
18. 薬効薬理
18.1 作用機序
ピルシカイニドは、Vaughan Williamsらの分類のクラスIcに属する不整脈治療剤で、Naチャンネル抑制作用により抗不整脈作用を示す。Sicilian Gambitの提唱する薬剤分類(日本版)において、ピルシカイニドはNaチャンネルを選択的に抑制し、K、Caチャンネル並びにα、β及びムスカリン受容体などには影響を与えないものとして位置づけられる16)。
18.2 臨床電気生理学的作用
発作性上室性頻拍の患者にピルシカイニド塩酸塩水和物150mg又は200mgを単回経口投与した場合、洞房伝導(SA)時間、房室結節内伝導(AH)時間、心室内伝導(HV)時間を延長させた。また、右室の有効不応期を延長させた17)。
18.3 心機能に対する作用
発作性上室性頻拍の患者にピルシカイニド塩酸塩水和物150mg又は200mgを単回経口投与した場合、心拍数及び平均肺動脈圧は有意に増加し、一回拍出係数は有意に減少したがいずれも正常範囲内であった17)。
18.4 実験的不整脈に対する作用
18.4.3 イヌの冠動脈閉塞中及び再灌流中に発生する心室性不整脈を抑制した21)。
18.5 電気生理学的作用
18.5.1 最大脱分極速度に対する作用
モルモット乳頭筋において、静止膜電位にほとんど影響を与えることなく、最大脱分極速度(Vmax)を用量依存的に抑制した22)。
18.5.2 活動電位持続時間及び有効不応期に対する作用
モルモット乳頭筋の活動電位持続時間(APD)及び有効不応期(ERP)に影響を与えなかった22)。
18.5.3 心室細動の発生閾値に対する作用
イヌにおいて電気刺激による心室細動の発生閾値を上昇させた21)。
18.5.4 遅延後脱分極及び誘発自動能に対する作用
イヌのプルキンエ線維においてアセチルストロファンチジンで誘発される遅延後脱分極及び誘発自動能を抑制した23)。
18.6 活性代謝物の抗不整脈作用
イヌ冠動脈二段結紮不整脈に対する2-ヒドロキシメチル体の抗不整脈作用強度はピルシカイニド塩酸塩水和物の1/4であった18)。
19. 有効成分に関する理化学的知見
19.1. ピルシカイニド塩酸塩水和物
20. 取扱い上の注意
アルミピロー包装開封後は、湿気を避けて保存すること。
22. 包装
<ピルシカイニド塩酸塩カプセル25mg「サワイ」>
PTP
100カプセル(10Cap×10)
<ピルシカイニド塩酸塩カプセル50mg「サワイ」>
PTP
100カプセル(10Cap×10)
23. 主要文献
- CAST investigators:N.Engl.J.Med., 321 (6), 406-412, (1989)
- 中島光好他, 臨床医薬, 5 (4), 661-678, (1989)
- 清水賢巳他, 薬理と治療, 22 (8), 3717-3725, (1994)
- 横田充弘他, Ther.Res., 10 (5), 2135-2147, (1989)
- 社内資料:生物学的同等性試験(カプセル25mg)
- 社内資料:生物学的同等性試験(カプセル50mg)
- 林敏郎他, 基礎と臨床, 23 (6), 2197-2229, (1989)
- 林敏郎他, 基礎と臨床, 23 (6), 2183-2195, (1989)
- 小森谷和美他, 応用薬理, 65 (5/6), 89-95, (2003)
- ヒト血漿蛋白結合率(サンリズム注射液:2000年1月18日承認、申請資料概要へ.2.3.3)
- 藤谷朝通他, 薬物動態, 12 (S), 255, (1997)
- 代謝(サンリズム注射液:2000年1月18日承認、申請資料概要へ.3.3)
- 高畠利一他, 薬理と治療, 17 (7), 3195-3205, (1989)
- 新谷博一他, 循環器科, 26 (2), 216-232, (1989)
- 新谷博一他, 循環器科, 26 (2), 201-215, (1989)
- 田中千賀子他編:NEW薬理学,改訂第7版, 382-387, (2017), (南江堂)
- 井野威他, 臨床薬理, 20 (4), 677-685, (1989) »DOI
- 日高寿範他, 応用薬理, 37 (4), 359-372, (1989)
- Aisaka,K.et al., Arzneimittelforschung, 35(8) (II), 1239-1245, (1985)
- 日高寿範他, 基礎と臨床, 26 (13), 4927-4931, (1992)
- 日高寿範他, 応用薬理, 36 (6), 439-447, (1988)
- Hattori,Y.et al., J.Cardiovasc.Pharmacol., 8 (5), 998-1002, (1986) »PubMed
- Inomata,N.et al., Eur.J.Pharmacol., 145 (3), 313-322, (1988) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
製品情報問い合わせ先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
26. 製造販売業者等
26.1 製造販売元
沢井製薬株式会社
大阪市淀川区宮原5丁目2-30