医薬品情報
| 総称名 | トアラセット |
|---|---|
| 一般名 | トラマドール塩酸塩 アセトアミノフェン |
| 欧文一般名 | Tramadol Hydrochloride Acetaminophen |
| 製剤名 | トラマドール塩酸塩・アセトアミノフェン配合錠 |
| 薬効分類名 | 慢性疼痛/抜歯後疼痛治療剤 |
| 薬効分類番号 | 1149 |
| ATCコード | N02AJ13 |
| KEGG DRUG |
D09999
トラマドール塩酸塩・アセトアミノフェン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年8月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| トアラセット配合錠「サワイ」 (後発品) | TOARASET Combination Tablets [SAWAI] | 沢井製薬 | 1149117F1160 | 14.3円/錠 | 劇薬, 処方箋医薬品注) |
1. 警告
2. 禁忌
次の患者には投与しないこと
<効能共通>
2.1 12歳未満の小児[9.7.1参照]
2.2 アルコール、睡眠剤、鎮痛剤、オピオイド鎮痛剤又は向精神薬による急性中毒患者[中枢神経抑制及び呼吸抑制を悪化させるおそれがある。]
2.3 モノアミン酸化酵素(MAO)阻害剤(セレギリン塩酸塩、ラサギリンメシル酸塩、サフィナミドメシル酸塩)を投与中の患者、又は投与中止後14日以内の患者[10.1参照]
2.4 ナルメフェン塩酸塩を投与中の患者又は投与中止後1週間以内の患者[10.1参照]
2.5 治療により十分な管理がされていないてんかん患者[症状が悪化するおそれがある。][9.1.1参照]
2.6 重篤な肝障害のある患者[重篤な転帰をとるおそれがある。][9.3.1参照]
2.7 本剤の成分に対し過敏症の既往歴のある患者[9.1.5参照]
<抜歯後の疼痛>
2.8 アスピリン喘息(非ステロイド性消炎鎮痛剤による喘息発作の誘発)又はその既往歴のある患者[アスピリン喘息の発症にプロスタグランジン合成阻害作用が関与していると考えられる。][9.1.11参照]
4. 効能または効果
非オピオイド鎮痛剤で治療困難な下記疾患における鎮痛
○非がん性慢性疼痛
○抜歯後の疼痛
5. 効能または効果に関連する注意
<非がん性慢性疼痛>
原因となる器質的病変、心理的・社会的要因、依存リスクを含めた包括的な診断を行い、本剤の投与の適否を慎重に判断すること。
6. 用法及び用量
<非がん性慢性疼痛>
通常、成人には、1回1錠、1日4回経口投与する。投与間隔は4時間以上空けること。
なお、症状に応じて適宜増減するが、1回2錠、1日8錠を超えて投与しないこと。また、空腹時の投与は避けることが望ましい。
なお、症状に応じて適宜増減するが、1回2錠、1日8錠を超えて投与しないこと。また、空腹時の投与は避けることが望ましい。
<抜歯後の疼痛>
通常、成人には、1回2錠を経口投与する。
なお、追加投与する場合には、投与間隔を4時間以上空け、1回2錠、1日8錠を超えて投与しないこと。また、空腹時の投与は避けることが望ましい。
なお、追加投与する場合には、投与間隔を4時間以上空け、1回2錠、1日8錠を超えて投与しないこと。また、空腹時の投与は避けることが望ましい。
7. 用法及び用量に関連する注意
<非がん性慢性疼痛>
7.1 投与の継続
本剤投与開始後4週間を経過してもなお期待する効果が得られない場合は、他の適切な治療への変更を検討すること。また、定期的に症状及び効果を確認し、投与の継続の必要性について検討すること。
7.2 投与の中止
本剤の投与を必要としなくなった場合は、退薬症候の発現を防ぐために徐々に減量すること。
7.3 アスピリン喘息又はその既往歴のある患者に対して本剤を投与する場合は、1回1錠とすること。[9.1.15参照]
8. 重要な基本的注意
8.1 本剤は、1錠中にトラマドール塩酸塩(37.5mg)及びアセトアミノフェン(325mg)を含む配合剤であり、トラマドールとアセトアミノフェン双方の副作用が発現するおそれがあるため、適切に本剤の使用を検討すること。
8.2 連用により薬物依存を生じることがあるので、観察を十分に行い、慎重に投与すること。[11.1.4参照]
8.3 悪心、嘔吐、便秘等の症状があらわれることがあるので、観察を十分に行い、悪心・嘔吐に対する対策として制吐剤の併用を、便秘に対する対策として緩下剤の併用を考慮するなど、適切な処置を行うこと。
8.4 眠気、めまい、意識消失が起こることがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作に従事させないよう注意すること。なお、意識消失により自動車事故に至った例も報告されている。
8.5 感染症を不顕性化するおそれがあるので、観察を十分に行うこと。
8.6 重篤な肝障害が発現するおそれがあるので注意すること。アセトアミノフェンの1日総量が1500mg(本剤4錠)を超す高用量で長期投与する場合には定期的に肝機能検査を行い、患者の状態を十分に観察すること。高用量でなくとも長期投与する場合にあっては定期的に肝機能検査を行うことが望ましい。また、高用量で投与する場合などは特に患者の状態を十分に観察すること。[1.1、11.1.9参照]
8.7 鎮痛剤による治療は原因療法ではなく、対症療法であることに留意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
<効能共通>
9.1.1 てんかん等の痙攣性疾患又はこれらの既往歴のある患者、あるいは痙攣発作の危険因子(頭部外傷、代謝異常、アルコール又は薬物の離脱症状、中枢性感染症等)を有する患者(治療により十分な管理がされていないてんかん患者を除く)
本剤投与中は観察を十分に行うこと。痙攣発作を誘発することがある。[2.5参照]
9.1.2 呼吸抑制状態にある患者
呼吸抑制を増強するおそれがある。
9.1.3 脳に器質的障害のある患者
呼吸抑制や頭蓋内圧の上昇を来すおそれがある。
9.1.4 薬物の乱用又は薬物依存傾向のある患者
厳重な医師の管理下に、短期間に限って投与すること。依存性を生じやすい。
9.1.5 オピオイド鎮痛剤に対し過敏症の既往歴のある患者(本剤の成分に対し過敏症の既往歴のある患者を除く)[2.7参照]
9.1.6 ショック状態にある患者
循環不全や呼吸抑制を増強するおそれがある。
9.1.7 消化性潰瘍又はその既往歴のある患者
症状が悪化又は再発を促すおそれがある。
9.1.8 血液の異常又はその既往歴のある患者
症状が悪化又は再発を促すおそれがある。
9.1.9 出血傾向のある患者
血小板機能異常が起こることがある。
9.1.10 心機能異常のある患者
症状が悪化又は心不全が増悪するおそれがある。
9.1.11 気管支喘息のある患者
症状が悪化するおそれがある。[2.8参照]
9.1.12 アルコール多量常飲者
肝障害があらわれやすくなる。[10.2参照]
9.1.13 絶食・低栄養状態・摂食障害等によるグルタチオン欠乏、脱水症状のある患者
肝障害があらわれやすくなる。
9.1.14 18歳未満の肥満、閉塞性睡眠時無呼吸症候群又は重篤な肺疾患を有する患者
投与しないこと。重篤な呼吸抑制のリスクが増加するおそれがある。
<非がん性慢性疼痛>
9.1.15 アスピリン喘息(非ステロイド性消炎鎮痛剤による喘息発作の誘発)又はその既往歴のある患者
本剤を用いず、個別のアセトアミノフェン製剤を用いた用量調節を考慮すること。アスピリン喘息又はその既往歴のある患者では、アセトアミノフェンの1回あたりの最大用量は300mg以下とすることとされているが、本剤は1錠中にアセトアミノフェンを325mg含有している。アスピリン喘息の発症にプロスタグランジン合成阻害作用が関与していると考えられ、症状が悪化又は再発を促すおそれがある。[7.3参照]
9.2 腎機能障害患者
9.2.1 腎障害のある患者あるいはその既往歴のある患者
投与量の減量、投与間隔の延長を考慮すること。症状が悪化又は再発を促すおそれがある。また、高い血中濃度が持続し、作用及び副作用が増強するおそれがある。[16.6.2参照]
9.3 肝機能障害患者
9.3.1 重篤な肝障害のある患者
投与しないこと。重篤な転帰をとるおそれがある。[2.6参照]
9.3.2 肝障害のある患者あるいはその既往歴のある患者(重篤な肝障害のある患者を除く)
肝機能が悪化するおそれがある。また、高い血中濃度が持続し、作用及び副作用が増強するおそれがある。[16.6.1参照]
9.5 妊婦
9.5.1 妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
トラマドールは胎盤関門を通過し、新生児に痙攣発作、身体的依存及び退薬症候、並びに胎児死亡及び死産が報告されている。また、動物実験で、トラマドールは器官形成、骨化及び出生児の生存に影響を及ぼすことが報告されている。
トラマドールは胎盤関門を通過し、新生児に痙攣発作、身体的依存及び退薬症候、並びに胎児死亡及び死産が報告されている。また、動物実験で、トラマドールは器官形成、骨化及び出生児の生存に影響を及ぼすことが報告されている。
9.5.2 妊娠後期の女性へのアセトアミノフェンの投与により胎児に動脈管収縮を起こすことがある。
9.5.3 アセトアミノフェンは妊娠後期のラットで胎児に軽度の動脈管収縮を起こすことが報告されている。
9.6 授乳婦
授乳を避けさせること。トラマドールは、乳汁中へ移行することが報告されている。
9.7 小児等
9.7.1 12歳未満の小児
投与しないこと。海外において、12歳未満の小児で死亡を含む重篤な呼吸抑制のリスクが高いとの報告がある。[2.1参照]
9.7.2 12歳以上の小児
12歳以上の小児に対する有効性及び安全性を指標とした臨床試験は実施していない。
9.7.3 肥満、閉塞性睡眠時無呼吸症候群又は重篤な肺疾患を有する小児
投与しないこと。重篤な呼吸抑制のリスクが増加するおそれがある。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。生理機能が低下していることが多く、代謝・排泄が遅延し副作用があらわれやすい。
10. 相互作用
相互作用序文
トラマドールは、主にCYP2D6及びCYP3A4によって代謝される。
薬物代謝酵素用語
CYP2D6
薬物代謝酵素用語
CYP3A4
10.1 併用禁忌
| MAO阻害剤 セレギリン塩酸塩 (エフピー) ラサギリンメシル酸塩 (アジレクト) サフィナミドメシル酸塩 (エクフィナ) [2.3参照] | 外国において、セロトニン症候群(錯乱、激越、発熱、発汗、運動失調、反射異常亢進、ミオクローヌス、下痢等)を含む中枢神経系(攻撃的行動、固縮、痙攣、昏睡、頭痛)、呼吸器系(呼吸抑制)及び心血管系(低血圧、高血圧)の重篤な副作用が報告されている。MAO阻害剤を投与中の患者又は投与中止後14日以内の患者には投与しないこと。また、本剤投与中止後にMAO阻害剤の投与を開始する場合には、2〜3日間の間隔を空けることが望ましい。 | 相加的に作用が増強され、また、中枢神経のセロトニンが蓄積すると考えられる。 |
| ナルメフェン塩酸塩 セリンクロ [2.4参照] | 離脱症状を起こすおそれがある。また、鎮痛作用が減弱するおそれがある。 ナルメフェン塩酸塩を投与中の患者又は投与中止後1週間以内の患者には投与しないこと。 | μオピオイド受容体への競合的阻害による。 |
10.2 併用注意
| オピオイド鎮痛剤 中枢神経抑制剤 フェノチアジン系薬剤 催眠鎮静剤等 | 痙攣閾値の低下や呼吸抑制の増強を来すおそれがある。 | 中枢神経抑制作用が相加的に増強されると考えられる。 |
| 三環系抗うつ剤 セロトニン作用薬 選択的セロトニン再取り込み阻害剤(SSRI)等 | セロトニン症候群(錯乱、激越、発熱、発汗、運動失調、反射異常亢進、ミオクローヌス、下痢等)があらわれるおそれがある。また、痙攣発作の危険性を増大させるおそれがある。 | 相加的に作用が増強され、また、中枢神経のセロトニンが蓄積すると考えられる。 |
| リネゾリド | セロトニン症候群(錯乱、激越、発熱、発汗、運動失調、反射異常亢進、ミオクローヌス、下痢等)があらわれるおそれがある。また、痙攣発作の危険性を増大させるおそれがある。 | リネゾリドの非選択的、可逆的MAO阻害作用により、相加的に作用が増強され、また、中枢神経のセロトニンが蓄積すると考えられる。 |
| メチルチオニニウム塩化物水和物(メチレンブルー) | セロトニン症候群(錯乱、激越、発熱、発汗、運動失調、反射異常亢進、ミオクローヌス、下痢等)があらわれるおそれがある。 | メチルチオニニウム塩化物水和物のモノアミン酸化酵素阻害作用によりセロトニン作用が増強される。 |
| カルバマゼピン フェノバルビタール フェニトイン プリミドン リファンピシン イソニアジド | トラマドールの血中濃度が低下し作用が減弱する可能性がある。 また、これらの薬剤の長期連用者では肝代謝酵素が誘導され、アセトアミノフェン代謝物による肝障害を生じやすくなるとの報告がある。 | これらの薬剤の肝代謝酵素誘導作用により、トラマドールの代謝が促進される。また、アセトアミノフェンから肝毒性を持つN-アセチル-p-ベンゾキノンイミンへの代謝が促進される。 |
| アルコール(飲酒) [9.1.12参照] | 呼吸抑制が生じるおそれがある。 また、アルコール多量常飲者がアセトアミノフェンを服用したところ肝不全を起こしたとの報告がある。 | 相加的に作用が増強されると考えられる。 アルコール常飲によるCYP2E1の誘導により、アセトアミノフェンから肝毒性を持つN-アセチル-p-ベンゾキノンイミンへの代謝が促進される。 |
| キニジン | 相互に作用が増強するおそれがある。 | 機序不明 |
| クマリン系抗凝血剤 ワルファリン | 出血を伴うプロトロンビン時間の延長等のクマリン系抗凝血剤の作用を増強することがある。 | 機序不明 |
| ジゴキシン | ジゴキシン中毒が発現したとの報告がある。 | 機序不明 |
| オンダンセトロン塩酸塩水和物 | 本剤の鎮痛作用を減弱させるおそれがある。 | 本剤の中枢におけるセロトニン作用が抑制されると考えられる。 |
| ブプレノルフィン ペンタゾシン等 | 本剤の鎮痛作用を減弱させるおそれがある。また、退薬症候を起こすおそれがある。 | 本剤が作用するμ-オピオイド受容体の部分アゴニストであるため。 |
| エチニルエストラジオール含有製剤 | アセトアミノフェンの血中濃度が低下するおそれがある。 | エチニルエストラジオールは肝におけるアセトアミノフェンのグルクロン酸抱合を促進すると考えられる。 |
| エチニルエストラジオール含有製剤 | エチニルエストラジオールの血中濃度が上昇するおそれがある。 | アセトアミノフェンはエチニルエストラジオールの硫酸抱合を阻害すると考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(頻度不明)
呼吸困難、喘鳴、血管浮腫、蕁麻疹等があらわれることがある。
11.1.2 痙攣(0.2%)
11.1.3 意識消失(0.2%)
11.1.4 依存性(頻度不明)
長期使用時に、耐性、精神的依存及び身体的依存が生じることがある。本剤の中止又は減量時において、激越、不安、神経過敏、不眠症、運動過多、振戦、胃腸症状、パニック発作、幻覚、錯感覚、耳鳴等の退薬症候が生じることがある。[8.2参照]
11.1.5 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)、急性汎発性発疹性膿疱症(頻度不明)
11.1.6 間質性肺炎(頻度不明)
咳嗽、呼吸困難、発熱、肺音の異常等が認められた場合には、速やかに胸部X線、胸部CT、血清マーカー等の検査を実施すること。異常が認められた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.7 間質性腎炎、急性腎障害(頻度不明)
11.1.8 喘息発作の誘発(頻度不明)
11.1.9 劇症肝炎、肝機能障害、黄疸(頻度不明)
劇症肝炎、AST、ALT、γ-GTPの上昇等を伴う肝機能障害、黄疸があらわれることがある。[8.6参照]
11.1.10 顆粒球減少症(頻度不明)
11.1.11 呼吸抑制(頻度不明)
11.1.12 薬剤性過敏症症候群(頻度不明)
初期症状として発疹、発熱がみられ、更に肝機能障害、リンパ節腫脹、白血球増加、好酸球増多、異型リンパ球出現等を伴う遅発性の重篤な過敏症状があらわれることがある。なお、ヒトヘルペスウイルス6(HHV-6)等のウイルスの再活性化を伴うことが多く、投与中止後も発疹、発熱、肝機能障害等の症状が再燃あるいは遷延化することがあるので注意すること。
11.2 その他の副作用
| 5%以上 | 1%以上 5%未満 | 1%未満 | 頻度不明 | |
| 感染症及び寄生虫症 | 腎盂腎炎 | |||
| 血液及びリンパ系障害 | 貧血 | |||
| 代謝及び栄養障害 | 食欲不振 | 高脂血症、低血糖症 | ||
| 精神障害 | 不眠症 | 不安、幻覚 | 錯乱、多幸症、神経過敏、健忘、離人症、うつ病、薬物乱用、インポテンス、悪夢、異常思考、せん妄 | |
| 神経系障害 | 傾眠(25.9%)、浮動性めまい(18.9%)、頭痛 | 味覚異常 | 筋緊張亢進、感覚鈍麻、錯感覚、注意力障害、振戦、筋不随意運動、第4脳神経麻痺、片頭痛 | 運動失調、昏迷、会話障害、運動障害 |
| 眼障害 | 視覚異常 | 縮瞳、散瞳 | ||
| 耳及び迷路障害 | 耳不快感、耳鳴、回転性めまい | |||
| 心臓障害 | 動悸 | 不整脈、頻脈 | ||
| 血管障害 | 高血圧、ほてり | 低血圧、起立性低血圧 | ||
| 呼吸器、胸郭及び縦隔障害 | 呼吸困難、嗄声 | |||
| 胃腸障害 | 悪心(41.4%)、嘔吐(26.2%)、便秘(21.2%)、胃不快感 | 腹痛、下痢、口内炎、口内乾燥、消化不良、胃炎 | 逆流性食道炎、口唇炎、胃腸障害、腹部膨満、胃潰瘍、鼓腸、メレナ、上部消化管出血 | 嚥下障害、舌浮腫 |
| 肝胆道系障害 | 肝機能検査異常 | |||
| 皮膚及び皮下組織障害 | そう痒症 | 発疹、多汗症、冷汗 | ||
| 腎及び尿路障害 | 排尿困難 | アルブミン尿、尿閉 | 乏尿 | |
| 全身障害及び投与局所様態 | 異常感 | 口渇、倦怠感、発熱、浮腫 | 胸部不快感、無力症、悪寒 | 疲労、胸痛、失神、離脱症候群 |
| 臨床検査 | 体重減少、血中CPK増加、血中尿素増加、血中トリグリセリド増加、血中ビリルビン増加、尿中血陽性、尿中ブドウ糖陽性 | 好酸球数増加、白血球数増加、ヘモグロビン減少、尿中蛋白陽性、血中クレアチニン増加、血中ブドウ糖増加、血小板数増加、血中クレアチニン減少、血中尿酸増加、好中球百分率増加 | ||
| 傷害、中毒及び処置合併症 | 転倒・転落 |
13. 過量投与
13.1 症状
トラマドールの過量投与による重篤な症状は、呼吸抑制、嗜眠、昏睡、痙攣発作、心停止である。
アセトアミノフェンの大量投与により、肝毒性のおそれがある。また、アセトアミノフェンの過量投与時に肝臓・腎臓・心筋の壊死が起こったとの報告がある。過量投与による主な症状は、胃腸過敏症、食欲不振、悪心、嘔吐、倦怠感、蒼白、発汗等である。[1.2参照]
アセトアミノフェンの大量投与により、肝毒性のおそれがある。また、アセトアミノフェンの過量投与時に肝臓・腎臓・心筋の壊死が起こったとの報告がある。過量投与による主な症状は、胃腸過敏症、食欲不振、悪心、嘔吐、倦怠感、蒼白、発汗等である。[1.2参照]
13.2 処置
緊急処置として、気道を確保し、症状に応じた呼吸管理と循環の管理を行うこと。
トラマドールの過量投与による呼吸抑制等の症状が疑われる場合には、ナロキソンが有効な場合があるが、痙攣発作を誘発するおそれがある。また、トラマドールは透析によりほとんど除去されない。
アセトアミノフェンの過量投与による症状が疑われる場合には、アセチルシステインの投与を考慮すること。[1.2参照]
トラマドールの過量投与による呼吸抑制等の症状が疑われる場合には、ナロキソンが有効な場合があるが、痙攣発作を誘発するおそれがある。また、トラマドールは透析によりほとんど除去されない。
アセトアミノフェンの過量投与による症状が疑われる場合には、アセチルシステインの投与を考慮すること。[1.2参照]
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.1.2 小児の手の届かない所に保管するよう指導すること。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 アセトアミノフェンの類似化合物(フェナセチン)の長期投与により、血色素異常を起こすことがある。
15.1.2 腎盂及び膀胱腫瘍の患者を調査したところ、類似化合物(フェナセチン)製剤を長期・大量に使用(例:総服用量1.5〜27kg、服用期間4〜30年)していた人が多いとの報告がある。
15.1.3 非ステロイド性消炎鎮痛剤を長期投与されている女性において、一時的な不妊が認められたとの報告がある。
15.1.4 遺伝的にCYP2D6の活性が過剰であることが判明している患者(Ultra-rapid Metabolizer)では、トラマドールの活性代謝物の血中濃度が上昇し、呼吸抑制等の副作用が発現しやすくなるおそれがある。
15.2 非臨床試験に基づく情報
15.2.1 類似化合物(フェナセチン)の長期・大量投与した動物実験で、腫瘍発生が認められたとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男性にトラマドール塩酸塩/アセトアミノフェン配合錠1〜3錠注)(トラマドール塩酸塩として37.5、75及び112.5mg、アセトアミノフェン(APAP)として325、650及び975mg)を単回経口投与したとき、投与量にかかわらず、トラマドール【(±)-TRAM】及びAPAPは速やかに吸収され、(±)-TRAM及びAPAPの血漿中濃度はそれぞれ投与後約1〜2時間及び約1時間にCmaxに達した後、それぞれ約5〜5.5時間及び約3時間のt1/2で低下した。両薬物の薬物動態は用量比例性を示した。また、(±)-TRAMは速やかに活性代謝物O-脱メチルトラマドール【(±)-M1】に代謝され、(±)-M1の血漿中濃度は投与後約2時間にCmaxに達した後、約6.5時間のt1/2で低下した。血漿中(±)-TRAM及び(±)-M1の各鏡像異性体【(+)-体及び(−)-体】の薬物動態パラメータは類似していた1)。
注)本剤の承認された1回最高用量は2錠である。
| 対象 | トラマドール塩酸塩/APAP配合錠 | Cmax (ng/mL) | tmax (h) | AUC∞ (ng・h/mL) | t1/2 (h) |
| (±)-TRAM | 1錠 | 119.8(34.3) | 1.8(0.5〜3.0) | 938.2(360.7) | 5.1(0.8) |
| 2錠 | 263.8(45.6) | 1.0(0.5〜1.5) | 2004.3(580.5) | 5.6(1.0) | |
| 3錠注) | 424.5(146.1) | 1.3(1.0〜3.0) | 3274.3(1070.4) | 5.6(1.1) | |
| (±)-M1 | 1錠 | 34.2(10.6) | 1.8(0.5〜3.0) | 359.4(63.7) | 6.4(0.9) |
| 2錠 | 65.6(24.4) | 1.8(1.0〜4.0) | 680.9(142.2) | 6.3(0.9) | |
| 3錠注) | 95.7(26.3) | 1.8(1.0〜3.0) | 1083.8(224.3) | 6.3(0.9) | |
| APAP | 1錠 | 5.0(2.0)a | 0.8(0.5〜1.5) | 17.1(4.8)b | 2.8(0.6) |
| 2錠 | 9.2(2.3)a | 1.0(0.5〜1.5) | 38.9(12.4)b | 3.3(0.9) | |
| 3錠注) | 15.1(4.3)a | 0.8(0.5〜1.5) | 62.3(18.1)b | 3.3(1.0) |
16.1.2 反復投与
健康成人男性にトラマドール塩酸塩/APAP配合錠1回1又は2錠(トラマドール塩酸塩として37.5又は75mg、APAPとして325又は650mg)を1日4回(6時間ごと)反復経口投与(トラマドール塩酸塩/APAP配合錠1錠:5日間、トラマドール塩酸塩/APAP配合錠2錠:3日間)したとき、血漿中(±)-TRAM及び(±)-M1濃度は反復経口投与開始後48時間までに、また血漿中APAP濃度は反復経口投与開始後24時間までに定常状態に達しており、蓄積性は認められなかった1)。
| 対象 | トラマドール塩酸塩/APAP配合錠 | Cmax (ng/mL) | tmax (h) | AUCτ (ng・h/mL) | RA | t1/2 (h) |
| (±)-TRAM | 1錠 | 290.6(72.9) | 1.0(0.5〜1.5) | 1141.2(265.8) | 1.3(0.5) | 6.6(1.0) |
| 2錠 | 542.6(114.4) | 1.3(1.0〜2.0) | 2355.8(533.3) | 1.3(0.3) | 6.5(0.6) | |
| (±)-M1 | 1錠 | 78.5(18.7) | 1.3(0.5〜6.0) | 325.2(88.0) | 0.9(0.1) | 7.4(1.4) |
| 2錠 | 142.0(29.3) | 1.3(0.5〜2.0) | 666.6(103.8) | 0.9(0.2) | 6.7(0.9) | |
| APAP | 1錠 | 6.7(1.6)a | 0.5(0.5〜1.0) | 17.4(2.8)b | 1.0(0.1) | 4.3(2.7) |
| 2錠 | 11.0(2.9)a | 0.8(0.5〜1.5) | 30.4(4.9)b | 0.9(0.1) | 3.3(1.1) |
16.1.3 配合による影響
健康成人男性にトラマドール塩酸塩/APAP配合錠2錠(トラマドール塩酸塩として75mg、APAPとして650mg)、トラマドール塩酸塩2カプセル(75mg)又はAPAP 2カプセル(650mg)をそれぞれ単回経口投与したとき、トラマドール塩酸塩/APAP配合錠を投与したときの(±)-TRAM、(±)-M1及びAPAPの薬物動態パラメータは、トラマドール塩酸塩及びAPAPをそれぞれ単独で投与したときと同様の値を示し、(±)-TRAM、(±)-M1及びAPAPの薬物動態にトラマドール塩酸塩及びAPAPの配合による影響は認められなかった1)。
16.1.4 生物学的同等性試験
トアラセット配合錠「サワイ」とトラムセット配合錠を健康成人男子にそれぞれ1錠(トラマドール塩酸塩37.5mg、アセトアミノフェン325mg)空腹時単回経口投与(クロスオーバー法)し、トラマドール及びアセトアミノフェンの血漿中濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された2)。
| Cmax (μg/mL) | Tmax (hr) | T1/2 (hr) | AUC0-24hr (μg・hr/mL) | ||
| トラマドール | トアラセット配合錠「サワイ」 | 0.149±0.042 | 1.1±0.5 | 5.6±1.4 | 0.876±0.294 |
| トラムセット配合錠 | 0.153±0.046 | 1.2±0.6 | 5.5±1.4 | 0.879±0.297 | |
| アセトアミノフェン | トアラセット配合錠「サワイ」 | 5.57±2.21 | 0.9±0.5 | 2.9±0.7 | 15.15±3.99 |
| トラムセット配合錠 | 5.84±2.60 | 1.0±0.6 | 2.9±0.8 | 15.07±3.92 |
血漿中濃度ならびにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2 吸収
16.2.1 食事による影響
健康成人にトラマドール塩酸塩/APAP配合錠3錠注)(トラマドール塩酸塩として112.5mg、APAPとして975mg)を高脂肪食後及び空腹時にそれぞれ単回経口投与したとき、(±)-TRAM、(±)-M1及びAPAPの薬物動態に食事による顕著な影響は認められなかった3)(外国人データ)。
16.3 分布
16.4 代謝
16.5 排泄
健康成人男性にトラマドール塩酸塩/APAP配合錠1〜3錠注)を単回経口投与及びトラマドール塩酸塩/APAP配合錠1回1又は2錠を1日4回(6時間ごと)反復経口投与したとき、(±)-TRAM、(±)-M1及びAPAPの累積尿中排泄率(単回:投与後48時間、反復:最終投与後48時間)は、それぞれ投与量の18.2〜20.3%、9.4〜14.8%及び2.5〜3.3%であり、投与量及び反復投与による影響は認められなかった1)。
16.6 特定の背景を有する患者
16.6.1 肝機能障害
(1)トラマドール
(2)アセトアミノフェン
16.6.2 腎機能障害
(1)トラマドール
(2)アセトアミノフェン
17. 臨床成績
17.1 有効性及び安全性に関する試験
<非がん性慢性疼痛>
17.1.1 国内第III相試験
腰痛症又は変形性関節症と診断され、非ステロイド性消炎鎮痛剤の経口投与により十分な鎮痛効果が得られない慢性疼痛患者187例(トラマドール塩酸塩/APAP配合錠群94例、プラセボ群93例)を対象に、非盲検下でトラマドール塩酸塩/APAP配合錠1回1〜2錠を1日4回2週間投与した後、二重盲検期への移行規準を満たした患者に、トラマドール塩酸塩/APAP配合錠又はプラセボをランダムに割り付けて4週間投与したとき、二重盲検下での鎮痛効果不十分をイベントとしたイベント発生までの期間はプラセボ群と比較しトラマドール塩酸塩/APAP配合錠群で有意に長かった(ログランク検定、p=0.0001)。
非盲検期の副作用発現率は、79.1%(219/277例)であった。主な副作用は、悪心125例(45.1%)、傾眠77例(27.8%)、嘔吐76例(27.4%)、便秘51例(18.4%)、浮動性めまい44例(15.9%)であった13)。
非盲検期の副作用発現率は、79.1%(219/277例)であった。主な副作用は、悪心125例(45.1%)、傾眠77例(27.8%)、嘔吐76例(27.4%)、便秘51例(18.4%)、浮動性めまい44例(15.9%)であった13)。
17.1.2 国内長期投与試験
各種疾患(腰痛症、変形性関節症、関節リウマチ、頸肩腕症候群、帯状疱疹後神経痛、糖尿病性神経障害性疼痛など)に伴う慢性疼痛を有し、非ステロイド性消炎鎮痛剤の経口投与により十分な鎮痛効果が得られない患者190例を対象に、トラマドール塩酸塩/APAP配合錠1回1〜2錠を1日4回、適宜増減して非盲検下で最長52週間投与したときのVAS値の平均値は、前観察期の65.80mmに対して、治療期28週には29.93mmに低下し、その後、治療期52週までほぼ一定の値で推移した。
副作用発現率は、96.3%(183/190例)であった。主な副作用は、悪心102例(53.7%)、便秘74例(38.9%)、嘔吐71例(37.4%)、浮動性めまい51例(26.8%)、傾眠38例(20.0%)であった14)。
副作用発現率は、96.3%(183/190例)であった。主な副作用は、悪心102例(53.7%)、便秘74例(38.9%)、嘔吐71例(37.4%)、浮動性めまい51例(26.8%)、傾眠38例(20.0%)であった14)。
<抜歯後の疼痛>
17.1.3 国内第III相試験
骨削除及び歯冠分割を必要とする下顎埋伏智歯抜歯術を施行し、抜歯後疼痛を認めた患者328例(トラマドール塩酸塩/APAP配合錠群132例、トラマドール塩酸塩群66例、アセトアミノフェン群130例)を対象に、二重盲検下でトラマドール塩酸塩/APAP配合錠2錠、トラマドール塩酸塩75mg又はアセトアミノフェン650mgを単回投与したとき、投与後8時間までの痛みの改善度の総和(投与後の痛みの改善度を「改善なし」〜「完全改善」の5段階で、0.5〜8時間まで経時的に評価したときの累積値)の平均値は、トラマドール塩酸塩/APAP配合錠群17.7、トラマドール塩酸塩群12.4、アセトアミノフェン群13.3であり、トラマドール塩酸塩/APAP配合錠群と各単剤群の間に有意差が認められた(FisherのLSD法、いずれもp<0.0001)。また、トラマドール塩酸塩/APAP配合錠投与後に奏効するまでの時間(痛みの程度が「なし」又は「軽度」に改善するまでの時間)の中央値は約30分であり、その後に疼痛が再発した患者における効果持続時間(奏効後に痛みの程度が「中等度」又は「高度」に悪化するまでの時間)の中央値は約270分であった。
副作用発現率は、57.6%(76/132例)であった。主な副作用は、傾眠39例(29.5%)、悪心18例(13.6%)、浮動性めまい12例(9.1%)、嘔吐9例(6.8%)であった15)。
副作用発現率は、57.6%(76/132例)であった。主な副作用は、傾眠39例(29.5%)、悪心18例(13.6%)、浮動性めまい12例(9.1%)、嘔吐9例(6.8%)であった15)。
| 薬剤群 | 解析例数 | 投与後8時間までの痛みの改善度の総和 | ||
| 平均値±標準偏差 | 中央値 (最小;最大) | FisherのLSD法 | ||
| トラマドール塩酸塩/APAP配合錠 2錠 | 132 | 17.7±7.91 | 18.5 (0.0;32.0) | / |
| トラマドール塩酸塩75mg | 66 | 12.4±8.36 | 12.5 (0.0;29.5) | p<0.0001 |
| アセトアミノフェン650mg | 130 | 13.3±8.07 | 14.0 (0.0;30.5) | p<0.0001 |
18. 薬効薬理
18.1 作用機序
18.1.1 トラマドール
18.1.2 アセトアミノフェン
18.2 鎮痛作用
19. 有効成分に関する理化学的知見
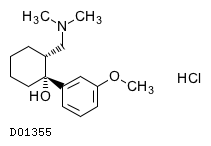
19.1. トラマドール塩酸塩
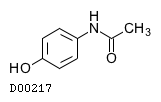
19.2. アセトアミノフェン
22. 包装
PTP
100錠(10錠×10)、500錠(10錠×50)
バラ
200錠
23. 主要文献
- 国内第I相臨床試験(トラムセット配合錠:2011年4月22日承認、申請資料概要2.7.6.3)
- 渡辺糺他, 新薬と臨床, 67 (10), 1231-1245, (2018)
- 海外第I相臨床試験(トラムセット配合錠:2011年4月22日承認、申請資料概要2.7.6.2)
- トラマドールの蛋白結合率の検討(トラムセット配合錠:2011年4月22日承認、申請資料概要2.7.2.2.1)
- Gazzard, B. G.et al., J. Pharm. Pharmacol., 25, 964-967, (1973) »PubMed
- トラマドールの代謝酵素の検討(トラムセット配合錠:2011年4月22日承認、申請資料概要2.7.2.2.1, 2.7.2.3.1)
- Thummel, K. E.et al., Biochem. Pharmacol., 45, 1563-1569, (1993) »PubMed
- Raucy, J. L.et al., Arch. Biochem. Biophys., 271, 270-283, (1989) »PubMed
- たか折修二他監訳:グッドマン・ギルマン薬理書, 第11版, 864-865, (2007), (廣川書店)
- トラマドールの薬物動態(特別な患者集団)(トラムセット配合錠:2011年4月22日承認、申請資料概要2.7.2.3)
- Zapater, P.et al., Aliment. Pharmacol. Ther., 20, 29-36, (2004) »PubMed
- Prescott, L. F.et al., Eur. J. Clin. Pharmacol., 36, 291-297, (1989) »PubMed
- 国内第III相試験(トラムセット配合錠:2011年4月22日承認、申請資料概要2.7.6.6)
- 国内第III相試験(トラムセット配合錠:2011年4月22日承認、申請資料概要2.7.6.17)
- 国内第II/III相試験(トラムセット配合錠:2011年4月22日承認、申請資料概要2.5.4.6, 2.7.6.19)
- Raffa, R. B.et al., J. Pharmacol. Exp. Ther., 260, 275-285, (1992) »PubMed
- Raffa, R. B., Am. J. Med., 101 (suppl. 1A), 40S-46S, (1996)
- Bjorkman, R.et al., Pain, 57, 259-264, (1994) »PubMed
- Pelissier, T.et al., J. Pharmacol. Exp. Ther., 278, 8-14, (1996) »PubMed
- Tallarida, R. J.et al., Life Sciences, 58, PL-23-PL-28, (1996)
- アジュバント関節炎ラットにおけるトラマドール塩酸塩及びアセトアミノフェン併用投与による鎮痛作用(トラムセット配合錠:2011年4月22日承認、申請資料概要2.6.2.2.3.2)
24. 文献請求先及び問い合わせ先
文献請求先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
製品情報問い合わせ先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
26. 製造販売業者等
26.1 製造販売元
沢井製薬株式会社
大阪市淀川区宮原5丁目2-30