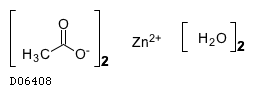医薬品情報
| 総称名 | 酢酸亜鉛 |
|---|---|
| 一般名 | 酢酸亜鉛水和物 |
| 欧文一般名 | Zinc Acetate Hydrate |
| 製剤名 | 酢酸亜鉛顆粒 |
| 薬効分類名 | ウィルソン病治療剤(銅吸収阻害剤) 低亜鉛血症治療剤 |
| 薬効分類番号 | 3929 |
| ATCコード | A16AX05 |
| KEGG DRUG |
D06408
酢酸亜鉛水和物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年2月 作成(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| 酢酸亜鉛顆粒5%「サワイ」 | ZINC ACETATE Granules[SAWAI] | 沢井製薬 | 39290A4D1036 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
5. 効能または効果に関連する注意
<低亜鉛血症>
食事等による亜鉛摂取で十分な効果が期待できない患者に使用すること。
6. 用法及び用量
<ウィルソン病(肝レンズ核変性症)>
成人には、亜鉛として、通常1回50mgを1日3回経口投与する。なお、年齢、症状に応じて適宜増減するが、最大投与量は1日250mg(1回50mgを1日5回投与)とする。
6歳以上の小児には、亜鉛として、通常1回25mgを1日3回経口投与する。
1歳以上6歳未満の小児には、亜鉛として、通常1回25mgを1日2回経口投与する。
なお、いずれの場合も、食前1時間以上又は食後2時間以上あけて投与すること。
<低亜鉛血症>
通常、成人及び体重30kg以上の小児では、亜鉛として、1回25〜50mgを開始用量とし1日2回経口投与する。
通常、体重30kg未満の小児では、亜鉛として、1回0.5〜0.75mg/kgを開始用量とし1日2回経口投与するが、患者の状態により1回25mgの1日1回経口投与から開始することもできる。
なお、血清亜鉛濃度や患者の状態により適宜増減するが、最大投与量は以下のとおりとする。
| 対象 | 最大投与量(1日あたり) |
| 成人及び体重30kg以上の小児 | 150mg(1回50mgを1日3回) |
| 体重10kg以上30kg未満の小児 | 75mg(1回25mgを1日3回) |
| 体重10kg未満の小児 | 25mg(1回12.5mgを1日2回、又は1回25mgを1日1回) |
いずれの場合も、食後に投与すること。
7. 用法及び用量に関連する注意
<ウィルソン病(肝レンズ核変性症)>
7.1 症候性のウィルソン病患者で初期治療として本剤を使用する場合、トリエンチン塩酸塩等のキレート剤と併用すること。ただし、無症候性のウィルソン病患者には初期治療として本剤単独投与でもよい1)。[10.2参照]
7.2 食物と同時摂取した場合、本剤の効果が遅延するおそれがある。
7.3 妊婦に投与する場合は、1ヵ月毎に尿中銅排泄量検査を行い、銅欠乏をきたすことがないよう、亜鉛として1回25mgに減量するなど尿中銅排泄量に応じて用量を調節すること。[9.5.2、11.1.1参照]
7.4 本剤の投与開始初期には、少なくとも1ヵ月毎に尿中銅排泄量検査を行い、尿中銅排泄量に応じて用量を調節すること。また、本剤投与継続中も症状推移を勘案しながら、定期的に検査を行うこと。[11.1.1参照]
| 項目 | 参考値 |
| 尿中銅排泄量(スポット尿中銅濃度) | 50〜125μg/24時間(0.1μg/mg・クレアチニン以下) |
7.5 本剤の用量を変更する場合は、尿中銅排泄量検査に加え、必要に応じて尿中亜鉛排泄量検査及び肝機能検査(AST、ALT等)を行うこと。
| 項目 | 参考値 |
| 尿中亜鉛排泄量(スポット尿中亜鉛濃度) | 2,000μg/24時間 以上(1.8μg/mg・クレアチニン以上) |
<低亜鉛血症>
7.6 本剤投与開始時及び用量変更時には、血清亜鉛濃度の確認を行うこと。なお、血清亜鉛濃度を測定するための採血は本剤を服薬する前に行うことが望ましい。
8. 重要な基本的注意
<効能共通>
8.1 本剤投与により、アミラーゼ及びリパーゼの異常が長期に持続する場合には、膵機能検査(腫瘍マーカーを含む)を考慮すること。
<低亜鉛血症>
8.2 血清亜鉛濃度や患者の状態に留意し、本剤を漫然と投与しないこと。
8.3 本剤投与により血清銅濃度が低下する可能性があるため、本剤投与中は血清銅濃度を定期的に確認することが望ましい。[11.1.1参照]
9. 特定の背景を有する患者に関する注意
9.3 肝機能障害患者
肝機能障害患者を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.5 妊婦
<効能共通>
9.5.1 妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
<ウィルソン病(肝レンズ核変性症)>
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。亜鉛が乳汁中に移行し、授乳中の乳児に亜鉛誘発性の銅欠乏が発現するおそれがある。
9.7 小児等
<ウィルソン病(肝レンズ核変性症)>
9.7.1 低出生体重児、新生児、乳児又は幼児を対象とした臨床試験は実施していない。
<低亜鉛血症>
9.7.2 低出生体重児又は新生児を対象とした臨床試験は実施していない。
9.8 高齢者
一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
| ポラプレジンク | 本剤の効果を増強させるおそれがある。 | 亜鉛含有製剤であるため。 |
| キレート剤 ペニシラミン トリエンチン塩酸塩[7.1参照] | 本剤及びキレート剤の効果を減弱するおそれがあるので、1時間以上あけて投与すること。 | 同時投与した場合、本剤がキレートされ、本剤及びキレート剤の吸収率が低下する可能性がある。 |
| テトラサイクリン系抗生物質 キノロン系抗菌剤 セフジニル 経口鉄剤 ビスホスホネート系製剤 エルトロンボパグ オラミン ドルテグラビルナトリウム | 本剤及びこれらの薬剤の効果を減弱するおそれがあるので、時間をあけて投与すること。 | 同時投与した場合、本剤及びこれらの薬剤の吸収率が低下する可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 銅欠乏症(頻度不明)
11.1.2 胃潰瘍(頻度不明)
出血を伴う胃潰瘍があらわれることがある。
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 頻度不明 | |
| 消化器 | 胃不快感、悪心、口内炎、嘔吐、腹痛、下痢、心窩部不快感、便秘 | 胃炎、口腔内痛、口腔内不快感 | |
| 肝胆道系 | 肝腫大、Al-P増加、AST増加、ALT増加、総ビリルビン増加、アンモニア増加、γ-グルタミルトランスフェラーゼ増加 | ||
| 膵臓 | リパーゼ増加(27.6%) アミラーゼ増加(17.1%) | 急性膵炎 | |
| 血液 | 白血球数減少、白血球数増加、血小板数減少、平均赤血球ヘモグロビン濃度減少 | 貧血 | |
| 皮膚 | アレルギー性皮膚炎、そう痒症 | 湿疹、発疹 | |
| その他 | 血清鉄減少(15.5%) | 総コレステロール減少、アルブミン減少、尿潜血陽性、尿中蛋白陽性、HDL-コレステロール減少、トリグリセリド増加、総蛋白減少、麦粒腫、膀胱炎、頭痛、血清鉄増加、血清銅減少、咳嗽、発熱 | めまい、食欲減退、変色便、倦怠感 |
13. 過量投与
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
ウィルソン病患者23例に酢酸亜鉛水和物カプセルを単回投与したときの薬物動態パラメータ(服薬前と服薬後との差に基づく値)及び平均血清中亜鉛濃度(実測値)の推移は以下のとおりであった8)。
| 年齢(例数):用量 | Cmax | tmax | t1/2 | AUC0-12 |
| 全体(23) | 42.3 | 1.995 | 2.059 | 118.67 |
| 16歳以上(16):50mg単回 | 51.2 | 2.158 | 2.067 | 175.32 |
| 6歳以上〜16歳未満(6):25mg単回 | 29.3 | 1.817 | 2.056 | 50.90 |
| 1歳以上〜6歳未満(1):25mg単回 | 18.0 | − | − | 37.00 |
16.1.2 生物学的同等性試験
健康成人男性30例に酢酸亜鉛水和物顆粒5%及び酢酸亜鉛水和物錠50mg(いずれも亜鉛として50mg)をクロスオーバー法により絶食時に単回経口投与したときの薬物動態パラメータ(服薬前と服薬後との差に基づく値)は以下のとおりであった。AUC0-24及びCmaxの対数の平均値の差について90%信頼区間はlog(0.80)〜log(1.25)の範囲内であったことから、生物学的に同等であることが確認された9)。
| 投与製剤 | AUC0-24(μg・h/dL) | Cmax(μg/dL) |
| 酢酸亜鉛水和物顆粒5% | 672.4±165.4 | 144.7±31.1 |
| 酢酸亜鉛水和物錠50mg | 685.6±177.5 | 144.2±35.3 |
16.1.3 生物学的同等性試験
<酢酸亜鉛顆粒5%「サワイ」>
酢酸亜鉛顆粒5%「サワイ」とノベルジン錠50mgを健康成人男性にそれぞれ亜鉛として50mg空腹時単回経口投与(クロスオーバー法)し、血清中亜鉛濃度を測定した。投与前値で補正した値より得られた薬物動態パラメータ(△AUC、△Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された10)。
| 製剤投与量(亜鉛として) | △Cmax(μg/dL) | △Tmax(hr) | △T1/2(hr) | △AUC0-8hr(μg・hr/dL) | |
| 酢酸亜鉛顆粒5%「サワイ」 | 1g(50mg) | 118.6±29.0 | 2.3±0.7 | 0.8±0.3 | 425.4±99.1 |
| ノベルジン錠50mg | 1錠(50mg) | 124.5±24.0 | 2.6±0.6 | 0.8±0.2 | 436.3±76.3 |
血清中濃度ならびに△AUC、△Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.5 排泄
ウィルソン病患者35例に酢酸亜鉛水和物カプセルを投与したときの24時間尿中亜鉛排泄量は以下のとおりであった8)。
| 年齢(例数):用法・用量 | 4週後 | 24週後 |
| 全体(35) | 2,535.6±1,153.74 | 3,918.1±1,826.40 |
| 16歳以上(20):150mg/日(50mg×3回) | 2,553.4±1,192.93 | 4,515.3±1,772.68 |
| 6歳以上〜16歳未満(15):75mg/日(25mg×3回) | 2,511.9±1,140.31 | 3,121.9±1,627.19 |
ウィルソン病患者37例に酢酸亜鉛水和物カプセルを投与したときのスポット尿中亜鉛排泄量は以下のとおりであった8)11)。
| 年齢(例数):用法・用量 | 投与開始前 | 4週後 | 12週後 | 24週後 | 48週後 |
| 全体(37) | 2.1640±1.90316 | 3.9296±1.69023 | 3.9504±1.34670 | 4.3634±1.45465 | 4.0000±1.66166 |
| 16歳以上(20):150mg/日(50mg×3回) | 1.4541±0.90904 | 3.3098±0.83202 | 3.2941±0.98218 | 4.3821±1.47796 | 3.7777±1.67382 |
| 6歳以上〜16歳未満(15):75mg/日(25mg×3回) | 2.2568±1.21081 | 3.9594±0.81727 | 4.5351±1.29246 | 3.9287±0.80445 | 3.9860±1.54069 |
| 1歳以上〜6歳未満(2):50mg/日(25mg×2回) | 8.5666±1.40452 | 9.9040±1.12323 | 6.1287±0.58331 | 7.4358±1.97333 | 6.3280±1.05098 |
17. 臨床成績
17.1 有効性及び安全性に関する試験
<ウィルソン病(肝レンズ核変性症)>
17.1.1 国内第III相試験
ウィルソン病患者37例(16歳以上20例、6歳以上〜16歳未満15例、1歳以上〜6歳未満2例)を対象に酢酸亜鉛水和物カプセル(16歳以上の患者は50mg×3回/日、6歳以上〜16歳未満の患者は25mg×3回/日、1歳以上〜6歳未満の患者は25mg×2回/日)を48週間投与した臨床試験の結果は以下のとおりであった。
主要評価項目であるALTの平均値の推移は以下のとおりで、各年齢区分で安定した推移を示した。
35例のウィルソン病患者(6歳以上)で検討された24時間尿中銅排泄量は以下のとおりで、4週後、24週後とも管理閾値(125μg/24時間)以下に維持された。
| 年齢(例数):用法・用量 | 4週後 | 24週後 |
| 16歳以上(20):150mg/日(50mg×3回) 6歳以上〜16歳未満(15):75mg/日(25mg×3回) | 60.571±93.0539 | 52.209±35.2677 |
37例のウィルソン病患者で検討されたスポット尿中銅排泄量は以下のとおりで、投与4週後以降有意に減少した。
| 年齢(例数):用法・用量 | 投与開始前 | 4週後 | 12週後 | 24週後 | 48週後 |
| 16歳以上(20):150mg/日(50mg×3回) 6歳以上〜16歳未満(15):75mg/日(25mg×3回) 1歳以上〜6歳未満(2):50mg/日(25mg×2回) | 0.5431±0.94768 | 0.0677±0.05120 | 0.0677±0.04371 | 0.0688±0.04977 | 0.0644±0.04421 |
17.1.2 切り替え投与、非盲検試験
ノベルジン錠25mg又は50mgで治療中のウィルソン病患者を対象に、切り替え前と同一の用法・用量に従って酢酸亜鉛顆粒5%「サワイ」へ切り替えを行い4週間投与した結果、主要評価項目であるALTの平均値の推移は以下のとおりであり、切り替え前後で同程度であった。
切り替え前後ともに副作用は認められなかった12)。
<低亜鉛血症>
17.1.3 国内第III相試験(比較試験)
低亜鉛血症患者56例(24歳以上93歳以下)を対象に酢酸亜鉛水和物錠(25mg×2回/日)又はプラセボを8週間投与したプラセボ対照二重盲検試験において、血清亜鉛濃度の投与開始時から投与8週後/中止時の変化量では、両群間に有意差が認められた(p<0.001)。
| 酢酸亜鉛水和物錠群(30例) | プラセボ群(26例) | |
| 変化量(最小二乗平均)a) (95%信頼区間) | 23.7(19.1〜28.3) | 1.3(-3.7〜6.2) |
| 群間差a) (95%信頼区間) | 22.4(15.6、29.2) | |
| t検定 | p<0.001 | |
副作用の発現頻度は12.9%(4/31例)であり、悪心6.5%(2/31例)、そう痒症6.5%(2/31例)、血中鉄増加3.2%(1/31例)、咳嗽3.2%(1/31例)、湿性咳嗽3.2%(1/31例)であった13)。
17.1.4 国内第III相試験(用量増減法確認試験)
低亜鉛血症患者43例(4歳以上82歳以下)を対象に、酢酸亜鉛水和物錠(開始用量:体重30kg以上の患者は25mg×2回/日又は50mg×2回/日、30kg未満の患者は25mg×1回/日)を最大24週間投与し、目標血清亜鉛濃度(80以上200μg/dL未満)到達までの用量調節方法及び到達後の維持効果を検討した臨床試験において、目標血清亜鉛濃度を8週間維持できた症例の割合は86.0%(37/43例)であった。
副作用の発現頻度は44.2%(19/43例)であり、主な副作用(5%以上)は、リパーゼ増加14.0%(6/43例)、嘔吐7.0%(3/43例)、血中銅減少7.0%(3/43例)であった14)。
副作用の発現頻度は44.2%(19/43例)であり、主な副作用(5%以上)は、リパーゼ増加14.0%(6/43例)、嘔吐7.0%(3/43例)、血中銅減少7.0%(3/43例)であった14)。
17.1.5 国内第III相試験(小児)
小児低亜鉛血症患者12例を対象に、酢酸亜鉛水和物顆粒(開始用量:1.0mg/kg/日又は1.5mg/kg/日)を最大28週間投与した臨床試験において、目標血清亜鉛濃度(80μg/dL以上)を同一投与量で8週間維持できた症例の割合は91.7%(11/12例)であった。
副作用の発現頻度は33.3%(4/12例)であり、便秘16.7%(2/12例)、ALT増加16.7%(2/12例)、嘔吐8.3%(1/12例)であった15)。
副作用の発現頻度は33.3%(4/12例)であり、便秘16.7%(2/12例)、ALT増加16.7%(2/12例)、嘔吐8.3%(1/12例)であった15)。
17.2 製造販売後調査等
<ウィルソン病(肝レンズ核変性症)>
17.2.1 特定使用成績調査
安全性解析対象症例707例の副作用の発現頻度は49.1%(347/707例)で、5例(0.7%)以上発現した主な副作用は、悪心84例(11.9%)、リパーゼ増加62例(8.8%)、アミラーゼ増加61例(8.6%)、ALT増加43例(6.1%)、AST増加33例(4.7%)、腹部不快感31例(4.4%)等であった。観察期間中に妊娠が1回以上「あり」と報告された症例は29例収集され、副作用は5例6件(流産、稽留流産、羊水過少、子宮頚管短縮、人工流産、帝王切開)であった。出生児32例及び人工流産した胎児1例には、5例13件の異常(多発性先天異常、心音異常、尿道下裂等)が認められた16)。(再審査終了時)
17.2.2 製造販売後臨床試験
国内第III相長期投与試験の被験者を対象に、酢酸亜鉛水和物カプセル承認後から投与終了までの安全性の検討を目的とした製造販売後臨床試験を実施した。副作用の発現頻度は14.7%(5/34例)であり、認められた副作用は、血中鉄減少5.9%(2/34例)、ALT増加、AST増加、血中クロール増加及びリパーゼ増加が各2.9%(1/34例)であった17)。
18. 薬効薬理
18.1 作用機序
<ウィルソン病(肝レンズ核変性症)>
18.2 血中亜鉛濃度低下の改善効果
19. 有効成分に関する理化学的知見
19.1. 酢酸亜鉛水和物
21. 承認条件
<効能共通>
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
バラ
50g
23. 主要文献
- Brewer, G. J. et al., Harrison's Principles of Internal Medicine,20th Edition, 2982-2984, (2018), (McGraw-Hill)
- Brewer, G. J. et al., Hepatology, 31 (2), 364-370, (2000) »PubMed
- Keen, C. L. et al., Drug-Nutr. Interact., 2 (1), 17-34, (1983) »PubMed
- Cohen, N. L. et al., Drug-Nutr. Interact., 2 (3), 203-210, (1983) »PubMed
- Lewis, M. R. et al., J. Toxicol. Clin. Toxicol., 36, 99-101, (1998) »PubMed
- Cowan, G. A. B., Br. Med. J., 1, 451-452, (1947) »PubMed
- Burkhart, K. K. et al., Ann. Emerg. Med., 19 (10), 1167-1170, (1990) »PubMed
- ウィルソン病に対する国内第III相試験[1](ノベルジンカプセル:2008年1月25日承認、申請資料概要2.7.6(10))
- 錠剤と顆粒剤の生物学的同等性試験(ノベルジン顆粒/錠:2021年1月22日承認、審査報告書)
- 社内資料:生物学的同等性試験
- ウィルソン病に対する国内第III相試験[2](ノベルジンカプセル:2008年1月25日承認、申請資料概要2.7.6(13))
- 社内資料:ノベルジン錠からの切り替え試験
- 低亜鉛血症に対する国内第III相二重盲検比較試験(ノベルジン錠/カプセル:2017年3月24日承認、申請資料概要2.7.6.1)
- 低亜鉛血症に対する国内第III相用量増減法確認試験(ノベルジン錠/カプセル:2017年3月24日承認、申請資料概要2.7.6.2)
- 小児低亜鉛血症に対する国内第III相試験(ノベルジン顆粒/錠:2021年1月22日承認、審査報告書)
- 特定使用成績調査(ノベルジン錠:2020年12月9日公表、再審査報告書)
- 製造販売後臨床試験(ノベルジン錠:2020年12月9日公表、再審査報告書)
- Yuzbasiyan-Gurkan, V. et al., J. Lab. Clin. Med., 120 (3), 380-386, (1992) »PubMed
- Lee, D. Y. et al., J. Lab. Clin. Med., 114 (6), 639-645, (1989) »PubMed
- 作用機序(ノベルジンカプセル:2008年1月25日承認、申請資料概要2.6.1)
- Sunar, F. et al., Pak. J. Pharm. Sci., 22, 150-154, (2009) »PubMed
- Riggio, O. et al., Hepatology, 16, 785-789, (1992) »PubMed
- Gandhi, M. S. et al., J. Cardiovasc. Pharmacol., 52, 245-252, (2008) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
製品情報問い合わせ先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
26. 製造販売業者等
26.1 製造販売元
沢井製薬株式会社
大阪市淀川区宮原5丁目2-30