医薬品情報
| 総称名 | メルカゾール |
|---|---|
| 一般名 | チアマゾール |
| 欧文一般名 | Thiamazole |
| 薬効分類名 | 抗甲状腺剤 |
| 薬効分類番号 | 2432 |
| ATCコード | H03BB02 |
| KEGG DRUG |
D00401
チアマゾール
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年6月 改訂(第3版)

|
1.警告 2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 16.薬物動態 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| メルカゾール錠2.5mg | MERCAZOLE TABLETS | あすか製薬 | 2432001F2021 | 10.1円/錠 | 処方箋医薬品注) |
| メルカゾール錠5mg | MERCAZOLE TABLETS | あすか製薬 | 2432001F1033 | 10.1円/錠 | 処方箋医薬品注) |
1. 警告
1.1 重篤な無顆粒球症が主に投与開始後2ヶ月以内に発現し、死亡に至った症例も報告されている。少なくとも投与開始後2ヶ月間は、原則として2週に1回、それ以降も定期的に白血球分画を含めた血液検査を実施し、顆粒球の減少傾向等の異常が認められた場合には、直ちに投与を中止し、適切な処置を行うこと。また、一度投与を中止して投与を再開する場合にも同様に注意すること。[8.1、8.2、11.1.1参照]
1.2 本剤投与に先立ち、無顆粒球症等の副作用が発現する場合があること及びこの検査が必要であることを患者に説明するとともに、下記について患者を指導すること。
・無顆粒球症の症状(咽頭痛、発熱等)があらわれた場合には速やかに主治医に連絡すること。
・少なくとも投与開始後2ヶ月間は原則として2週に1回、定期的な血液検査を行う必要があるので、通院すること。
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
チアマゾールとして、通常成人に対しては初期量1日30mgを3〜4回に分割経口投与する。症状が重症のときは、1日40〜60mgを使用する。機能亢進症状がほぼ消失したなら、1〜4週間毎に漸減し、維持量1日5〜10mgを1〜2回に分割経口投与する。
通常小児に対しては初期量5歳以上〜10歳未満では1日10〜20mg、10歳以上〜15歳未満では1日20〜30mgを2〜4回に分割経口投与する。機能亢進症状がほぼ消失したなら、1〜4週間毎に漸減し、維持量1日5〜10mgを1〜2回に分割経口投与する。
通常妊婦に対しては初期量1日15〜30mgを3〜4回に分割経口投与する。機能亢進症状がほぼ消失したなら、1〜4週間毎に漸減し、維持量1日5〜10mgを1〜2回に分割経口投与する。正常妊娠時の甲状腺機能検査値を低下しないよう、2週間毎に検査し、必要最低限量を投与する。
なお、年齢、症状により適宜増減する。
8. 重要な基本的注意
8.1 本剤を新たに投与開始する場合には、無顆粒球症等の重大な副作用が主に投与開始後2ヶ月以内にあらわれることがあるので、本剤の有効性と安全性を十分に考慮し、本剤の投与が適切と判断される患者に投与すること。[1.1、11.1.1参照]
8.3 肝機能障害、黄疸があらわれることがあるので、肝機能検査値に注意するなど観察を十分に行うこと。[11.1.3参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.3 肝機能障害患者
肝障害を悪化させるおそれがある。
9.5 妊婦
9.5.1 妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。妊娠中の投与により、新生児に頭皮欠損症・頭蓋骨欠損症、さい帯ヘルニア、さい腸管の完全または部分的な遺残(さい腸管ろう、メッケル憩室等)、気管食道ろうを伴う食道閉鎖症、後鼻孔閉鎖症等があらわれたとの報告がある。また、妊娠中の投与により、胎児に甲状腺機能抑制、甲状腺腫を起こすことがある。本剤はヒト胎盤を通過することが報告されている。
9.5.2 妊婦又は妊娠している可能性のある女性に投与する場合には、定期的に甲状腺機能検査を実施し、甲状腺機能を適切に維持するよう投与量を調節すること。
9.5.3 新生児に出生後しばらくは、甲状腺機能抑制、甲状腺機能亢進があらわれることがある。
9.6 授乳婦
授乳を避けさせること。ヒト母乳中へ移行(血清とほぼ同等レベル)し、乳児の甲状腺機能に影響を与えることがある。
9.8 高齢者
用量に注意すること。一般に生理機能が低下していることが多い。
10. 相互作用
10.2 併用注意
| クマリン系抗凝血剤 ワルファリンカリウム | 併用開始時、中止時及び病態の変化に応じて血液凝固能が変化するので、血液凝固能検査値の変動に十分注意し、必要があれば抗凝血剤の用量調節を行う。 | 甲状腺機能が亢進すると凝固因子の合成・代謝亢進により、相対的にクマリン系抗凝血剤の効果は増強する。本剤投与により甲状腺機能が正常化すると、増強されていたクマリン系抗凝血剤の効果が減弱するとの報告がある。 |
| ジギタリス製剤 ジゴキシン等 | 併用開始時、中止時及び病態の変化に応じてジギタリス製剤の血中濃度が変動するので、血中濃度の変動に十分注意し、必要があればジギタリス製剤の用量調節を行う。 | 甲状腺機能亢進時には、代謝・排泄が促進されているため、ジギタリス製剤の血中濃度が正常時に比較して低下する。本剤投与により甲状腺機能が正常化すると、ジギタリス製剤の血中濃度が上昇するとの報告がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 汎血球減少、再生不良性貧血、無顆粒球症、白血球減少(いずれも頻度不明)
11.1.2 低プロトロンビン血症、第VII因子欠乏症、血小板減少、血小板減少性紫斑病(いずれも頻度不明)[9.1.1参照]
11.1.3 肝機能障害、黄疸(いずれも頻度不明)[8.3参照]
11.1.4 多発性関節炎(頻度不明)
多発性や移動性の関節炎があらわれることがある。
11.1.5 SLE様症状(頻度不明)
発熱、紅斑、筋肉痛、関節痛、リンパ節腫脹、脾腫等があらわれることがある。
11.1.6 インスリン自己免疫症候群(頻度不明)
低血糖等があらわれることがある。
11.1.7 間質性肺炎(頻度不明)
発熱、咳嗽、呼吸困難、胸部X線異常等を伴う間質性肺炎があらわれることがあるので、このような症状があらわれた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.8 抗好中球細胞質抗体(ANCA)関連血管炎症候群(頻度不明)
本剤投与中に急速進行性腎炎症候群(初発症状:血尿、蛋白尿等)や肺出血(初発症状:咳嗽、喀血、呼吸困難等)、発熱、関節痛、関節腫脹、皮膚潰瘍、紫斑等のANCA関連血管炎症候群による障害があらわれることがある。このような症状があらわれた場合には、直ちに投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.9 横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇を特徴とする横紋筋融解症があらわれることがあるので、このような場合には投与を中止し、適切な処置を行うこと。また、横紋筋融解症による急性腎障害の発症に注意すること。
11.1.10 急性膵炎(頻度不明)
上腹部痛、背部痛、発熱、嘔吐等の症状、膵酵素異常が認められた場合には投与を中止し、適切な処置を行うこと。
11.2 その他の副作用
| 頻度不明 | |
| 肝臓 | AST上昇、ALT上昇等 |
| 皮膚 | 脱毛、色素沈着、そう痒感、紅斑、多形紅斑等 |
| 消化器 | 悪心・嘔吐、下痢、食欲不振等 |
| 精神神経系 | 頭痛、めまい、末梢神経異常等 |
| 過敏症注) | 発疹、蕁麻疹、発熱等 |
| 筋・骨格 | こむらがえり、筋肉痛、関節痛 |
| 血液 | 好酸球増多 |
| その他 | CK上昇、倦怠感、リンパ節腫脹、唾液腺肥大、浮腫、味覚異常(味覚減退を含む) |
13. 過量投与
13.1 症状
甲状腺腫、甲状腺機能低下があらわれることがある。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 健康成人男性に本剤(フィルムコーティング錠5mg)1錠又は糖衣錠(5mg)1錠を絶食時単回経口投与した結果、両製剤の生物学的同等性が確認された。薬物動態パラメータ及び血漿中濃度は以下のとおりであった1)。
| 投与量 | 例数 | AUC0-48(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | t1/2(hr) |
| 本剤(5mg) | 24 | 1179±146 | 128.5±25.6 | 1.0±0.6 | 7.5±0.9 |
| 糖衣錠(5mg) | 24 | 1204±186 | 129.8±23.6 | 1.3±0.4 | 7.4±0.7 |
16.1.2 甲状腺機能正常者11例に60mgを単回経口投与したところ、平均血漿中濃度は投与1時間後に920ng/mLと最高になり、24時間後にほぼ消失した2)(外国データ)。
16.2 吸収
ラットに14C-チアマゾール20mg/kgを経口、腹腔内、静脈内投与した結果、経口、腹腔内投与における吸収は同傾向を示した3)。
16.3 分布
ラットに14C-チアマゾール20mg/kgを経口、腹腔内、静脈内投与した結果、特定組織への親和性は認められず、血漿蛋白結合率は5%であった3)。
16.4 代謝
ラットに14C-チアマゾール20mg/kgを経口、腹腔内、静脈内投与した結果、主要代謝産物はグルクロナイド抱合体で、その量は投与量に対し尿中で36〜48%、胆汁中で4%であった3)。
16.5 排泄
16.8 その他
メルカゾール錠2.5mgは、「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン」に基づき、メルカゾール錠5mgを標準製剤としたとき、溶出挙動が等しく、生物学的に同等とみなされた4)。
18. 薬効薬理
18.1 作用機序
甲状腺のペルオキシダーゼを阻害することにより、ヨウ素のサイログロブリンへの結合を阻止し、さらにヨードサイロシンのトリヨードサイロニン(T3)、サイロキシン(T4)への縮合を阻害することによって甲状腺ホルモンの生成を阻害する。
18.2 ヨウ素化阻害作用
羊の甲状腺を用いた実験で、チアマゾールはヨウ素に対し強い競合阻害を示した5)。
18.3 基礎代謝抑制作用
乾燥甲状腺末投与による甲状腺機能亢進症ラットにチアマゾールを投与すると、基礎代謝亢進が著しく抑制される5)。
18.4 末梢組織酸化抑制作用
乾燥甲状腺末投与及び正常ラットの心臓homogenateのcytochrome酸化酵素、コハク酸脱水素酵素の活性は、チアマゾール投与により抑制されることから末梢組織の酸化機能も抑制する6)。
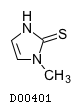
19. 有効成分に関する理化学的知見
19.1. チアマゾール
20. 取扱い上の注意
アルミピロー包装開封後は遮光して保存すること。
22. 包装
<メルカゾール錠2.5mg>
100錠[10錠(PTP)×10]
500錠[10錠(PTP)×50]
<メルカゾール錠5mg>
100錠[10錠(PTP)×10]
500錠[10錠(PTP)×50]
23. 主要文献
24. 文献請求先及び問い合わせ先
文献請求先
あすか製薬株式会社
くすり相談室
〒108-8532
東京都港区芝浦二丁目5番1号
電話:0120-848-339
FAX:03-5484-8358
製品情報問い合わせ先
あすか製薬株式会社
くすり相談室
〒108-8532
東京都港区芝浦二丁目5番1号
電話:0120-848-339
FAX:03-5484-8358
26. 製造販売業者等
26.1 製造販売元
あすか製薬株式会社
東京都港区芝浦二丁目5番1号
26.2 販売元
武田薬品工業株式会社
大阪市中央区道修町四丁目1番1号