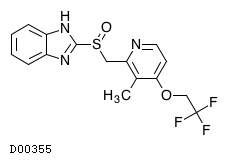
医薬品情報
| 総称名 | ランソプラゾール |
|---|---|
| 一般名 | ランソプラゾール |
| 欧文一般名 | Lansoprazole |
| 薬効分類名 | プロトンポンプインヒビター |
| 薬効分類番号 | 2329 |
| ATCコード | A02BC03 |
| KEGG DRUG |
D00355
ランソプラゾール
|
| KEGG DGROUP |
DG01646
プロトンポンプ阻害薬 (PPI)
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年2月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ランソプラゾールOD錠15mg「ケミファ」 (後発品) | Lansoprazole OD Tablets 15mg"Chemiphar" | シオノケミカル | 2329023F1110 | 21.1円/錠 | 処方箋医薬品注) |
| ランソプラゾールOD錠30mg「ケミファ」 (後発品) | Lansoprazole OD Tablets 30mg"Chemiphar" | シオノケミカル | 2329023F2116 | 36円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対する過敏症の既往歴のある患者
2.2 アタザナビル硫酸塩、リルピビリン塩酸塩を投与中の患者[10.1参照]
4. 効能または効果
<ランソプラゾールOD錠15mg「ケミファ」>
○胃潰瘍、十二指腸潰瘍、吻合部潰瘍、逆流性食道炎、Zollinger-Ellison症候群、非びらん性胃食道逆流症、低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制、非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制
○下記におけるヘリコバクター・ピロリの除菌の補助
<ランソプラゾールOD錠30mg「ケミファ」>
○下記におけるヘリコバクター・ピロリの除菌の補助
5. 効能または効果に関連する注意
ランソプラゾールOD錠15mg「ケミファ」
<低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制>
5.1 血栓・塞栓の形成抑制のために低用量のアスピリンを継続投与している患者を投与対象とし、投与開始に際しては、胃潰瘍又は十二指腸潰瘍の既往を確認すること。
<非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制>
5.2 関節リウマチ、変形性関節症等における疼痛管理等のために非ステロイド性抗炎症薬を長期継続投与している患者を投与対象とし、投与開始に際しては、胃潰瘍又は十二指腸潰瘍の既往を確認すること。
<ヘリコバクター・ピロリの除菌の補助>
5.3 進行期胃MALTリンパ腫に対するヘリコバクター・ピロリ除菌治療の有効性は確立していない。
5.4 特発性血小板減少性紫斑病に対しては、ガイドライン等を参照し、ヘリコバクター・ピロリ除菌治療が適切と判断される症例にのみ除菌治療を行うこと。
5.5 早期胃癌に対する内視鏡的治療後胃以外には、ヘリコバクター・ピロリ除菌治療による胃癌の発症抑制に対する有効性は確立していない。
5.6 ヘリコバクター・ピロリ感染胃炎に用いる際には、ヘリコバクター・ピロリが陽性であること及び内視鏡検査によりヘリコバクター・ピロリ感染胃炎であることを確認すること。
ランソプラゾールOD錠30mg「ケミファ」
<ヘリコバクター・ピロリの除菌の補助>
5.3 進行期胃MALTリンパ腫に対するヘリコバクター・ピロリ除菌治療の有効性は確立していない。
5.4 特発性血小板減少性紫斑病に対しては、ガイドライン等を参照し、ヘリコバクター・ピロリ除菌治療が適切と判断される症例にのみ除菌治療を行うこと。
5.5 早期胃癌に対する内視鏡的治療後胃以外には、ヘリコバクター・ピロリ除菌治療による胃癌の発症抑制に対する有効性は確立していない。
5.6 ヘリコバクター・ピロリ感染胃炎に用いる際には、ヘリコバクター・ピロリが陽性であること及び内視鏡検査によりヘリコバクター・ピロリ感染胃炎であることを確認すること。
6. 用法及び用量
ランソプラゾールOD錠15mg「ケミファ」
<胃潰瘍、十二指腸潰瘍、吻合部潰瘍、Zollinger-Ellison症候群>
通常、成人にはランソプラゾールとして1回30mgを1日1回経口投与する。なお、通常、胃潰瘍、吻合部潰瘍では8週間まで、十二指腸潰瘍では6週間までの投与とする。
<逆流性食道炎>
通常、成人にはランソプラゾールとして1回30mgを1日1回経口投与する。なお、通常8週間までの投与とする。
さらに、再発・再燃を繰り返す逆流性食道炎の維持療法においては、1回15mgを1日1回経口投与するが、効果不十分の場合は、1日1回30mgを経口投与することができる。
さらに、再発・再燃を繰り返す逆流性食道炎の維持療法においては、1回15mgを1日1回経口投与するが、効果不十分の場合は、1日1回30mgを経口投与することができる。
<非びらん性胃食道逆流症(OD錠15mgのみ)>
通常、成人にはランソプラゾールとして1回15mgを1日1回経口投与する。なお、通常4週間までの投与とする。
<低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制(OD錠15mgのみ)>
通常、成人にはランソプラゾールとして1回15mgを1日1回経口投与する。
<非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制(OD錠15mgのみ)>
通常、成人にはランソプラゾールとして1回15mgを1日1回経口投与する。
<ヘリコバクター・ピロリの除菌の補助>
通常、成人にはランソプラゾールとして1回30mg、アモキシシリン水和物として1回750mg(力価)及びクラリスロマイシンとして1回200mg(力価)の3剤を同時に1日2回、7日間経口投与する。
なお、クラリスロマイシンは、必要に応じて適宜増量することができる。ただし、1回400mg(力価)1日2回を上限とする。
なお、クラリスロマイシンは、必要に応じて適宜増量することができる。ただし、1回400mg(力価)1日2回を上限とする。
プロトンポンプインヒビター、アモキシシリン水和物及びクラリスロマイシンの3剤投与によるヘリコバクター・ピロリの除菌治療が不成功の場合は、これに代わる治療として、通常、成人にはランソプラゾールとして1回30mg、アモキシシリン水和物として1回750mg(力価)及びメトロニダゾールとして1回250mgの3剤を同時に1日2回、7日間経口投与する。
ランソプラゾールOD錠30mg「ケミファ」
<胃潰瘍、十二指腸潰瘍、吻合部潰瘍、Zollinger-Ellison症候群>
通常、成人にはランソプラゾールとして1回30mgを1日1回経口投与する。なお、通常、胃潰瘍、吻合部潰瘍では8週間まで、十二指腸潰瘍では6週間までの投与とする。
<逆流性食道炎>
通常、成人にはランソプラゾールとして1回30mgを1日1回経口投与する。なお、通常8週間までの投与とする。
さらに、再発・再燃を繰り返す逆流性食道炎の維持療法においては、1回15mgを1日1回経口投与するが、効果不十分の場合は、1日1回30mgを経口投与することができる。
さらに、再発・再燃を繰り返す逆流性食道炎の維持療法においては、1回15mgを1日1回経口投与するが、効果不十分の場合は、1日1回30mgを経口投与することができる。
<ヘリコバクター・ピロリの除菌の補助>
通常、成人にはランソプラゾールとして1回30mg、アモキシシリン水和物として1回750mg(力価)及びクラリスロマイシンとして1回200mg(力価)の3剤を同時に1日2回、7日間経口投与する。
なお、クラリスロマイシンは、必要に応じて適宜増量することができる。ただし、1回400mg(力価)1日2回を上限とする。
なお、クラリスロマイシンは、必要に応じて適宜増量することができる。ただし、1回400mg(力価)1日2回を上限とする。
プロトンポンプインヒビター、アモキシシリン水和物及びクラリスロマイシンの3剤投与によるヘリコバクター・ピロリの除菌治療が不成功の場合は、これに代わる治療として、通常、成人にはランソプラゾールとして1回30mg、アモキシシリン水和物として1回750mg(力価)及びメトロニダゾールとして1回250mgの3剤を同時に1日2回、7日間経口投与する。
7. 用法及び用量に関連する注意
ランソプラゾールOD錠15mg「ケミファ」
<逆流性食道炎>
7.1 維持療法において、1日1回30mgの投与は、1日1回15mg投与中に再発した例など15mgでは効果が不十分な場合に限る。
<非びらん性胃食道逆流症>
7.2 投与開始2週後を目安として効果を確認し、症状の改善傾向が認められない場合には、酸逆流以外の原因が考えられるため他の適切な治療への変更を考慮すること。[15.1.5参照]
ランソプラゾールOD錠30mg「ケミファ」
<逆流性食道炎>
7.1 維持療法において、1日1回30mgの投与は、1日1回15mg投与中に再発した例など15mgでは効果が不十分な場合に限る。
8. 重要な基本的注意
<胃潰瘍、十二指腸潰瘍、吻合部潰瘍>
8.1 長期の使用経験は十分でないので、維持療法には用いないことが望ましい。
<逆流性食道炎>
8.2 維持療法においては、再発・再燃を繰り返す患者に対し投与することとし、本来維持療法の必要のない患者に投与することのないよう留意すること。また、1日1回30mg又は15mgの投与により寛解状態が長期にわたり継続する症例で、減量又は投与中止により再発するおそれがないと判断される場合は1日1回15mgに減量又は中止すること。なお、維持療法中は定期的に内視鏡検査を実施するなど観察を十分に行うことが望ましい。
<非びらん性胃食道逆流症>
8.3 問診により胸やけ、呑酸等の酸逆流症状が繰り返しみられること(1週間あたり2日以上)を確認のうえ投与すること。
なお、本剤の投与が胃癌、食道癌等の悪性腫瘍及び他の消化器疾患による症状を隠蔽することがあるので、内視鏡検査等によりこれらの疾患でないことを確認すること。
なお、本剤の投与が胃癌、食道癌等の悪性腫瘍及び他の消化器疾患による症状を隠蔽することがあるので、内視鏡検査等によりこれらの疾患でないことを確認すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 薬物過敏症の既往歴のある患者
9.3 肝機能障害患者
本剤の代謝、排泄が遅延することがある。
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物試験(ラット)で母乳中へ移行することが報告されている1)。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
低用量から投与を開始するなど慎重に投与すること。一般に高齢者では酸分泌能は低下しており、その他生理機能の低下もある。
10. 相互作用
相互作用序文
本剤は主として肝薬物代謝酵素CYP2C19又はCYP3A4で代謝される。
また、本剤の胃酸分泌抑制作用により、併用薬剤の吸収を促進又は抑制することがある。
また、本剤の胃酸分泌抑制作用により、併用薬剤の吸収を促進又は抑制することがある。
薬物代謝酵素用語
CYP2C19
薬物代謝酵素用語
CYP3A4
10.1 併用禁忌
10.2 併用注意
| テオフィリン | テオフィリンの血中濃度が低下することがある。 | 本剤が肝薬物代謝酵素を誘導し、テオフィリンの代謝を促進することが考えられている。 |
| タクロリムス水和物 | タクロリムスの血中濃度が上昇することがある。 | 本剤が肝薬物代謝酵素におけるタクロリムスの代謝を競合的に阻害するためと考えられている。 |
| ジゴキシン メチルジゴキシン | 左記薬剤の作用を増強する可能性がある。 | 本剤の胃酸分泌抑制作用によりジゴキシンの加水分解が抑制され、ジゴキシンの血中濃度が上昇する可能性がある。 |
| イトラコナゾール チロシンキナーゼ阻害剤 ゲフィチニブ ボスチニブ水和物 ニロチニブ塩酸塩水和物 エルロチニブ塩酸塩 アカラブルチニブ セリチニブ ダサチニブ水和物 ダコミチニブ水和物 ラパチニブトシル酸塩水和物 カプマチニブ塩酸塩水和物 | 左記薬剤の作用を減弱する可能性がある。 ボスチニブ水和物との併用は可能な限り避けること。 | 本剤の胃酸分泌抑制作用により左記薬剤の血中濃度が低下する可能性がある。 |
| 酸化マグネシウム | 酸化マグネシウムの緩下作用が減弱するおそれがある。 | 本剤の胃酸分泌抑制作用による胃内pH上昇により酸化マグネシウムの溶解度が低下するためと考えられる。 |
| メトトレキサート | メトトレキサートの血中濃度が上昇することがある。高用量のメトトレキサートを投与する場合は、一時的に本剤の投与を中止することを考慮すること。 | 機序は不明である。 |
| フェニトイン ジアゼパム | 左記薬剤の作用を増強する可能性がある。 | これらの薬剤の代謝、排泄が遅延することが類薬(オメプラゾール)で報告されている。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
<効能共通>
11.1.1 アナフィラキシー(全身発疹、顔面浮腫、呼吸困難等)(0.1%未満注1))、ショック(0.1%未満注1))
11.1.2 汎血球減少、無顆粒球症、溶血性貧血(0.1%未満注1))、顆粒球減少(0.14%注1))、血小板減少(0.15%注1))、貧血(0.14%注1))
11.1.3 肝機能障害(0.1%未満注1))
黄疸、AST、ALTの上昇等を伴う重篤な肝機能障害があらわれることがある。
11.1.4 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(0.1%未満注1))
11.1.5 間質性肺炎(0.1%未満注1))
発熱、咳嗽、呼吸困難、肺音の異常(捻髪音)等があらわれた場合には、速やかに胸部X線等の検査を実施し、本剤の投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.6 尿細管間質性腎炎(頻度不明)
急性腎障害に至ることもあるので、腎機能検査値(BUN、クレアチニン上昇等)に注意すること。
11.1.7 視力障害(頻度不明)
<ヘリコバクター・ピロリの除菌の補助>
11.1.8 偽膜性大腸炎等の血便を伴う重篤な大腸炎(0.1%未満注1))
ヘリコバクター・ピロリの除菌に用いるアモキシシリン水和物、クラリスロマイシンでは、偽膜性大腸炎等の血便を伴う重篤な大腸炎があらわれることがあるので、腹痛、頻回の下痢があらわれた場合には直ちに投与を中止するなど適切な処置を行うこと。
注1)発現頻度は承認時までの臨床試験又は製造販売後調査の結果に基づく。
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | 発疹、そう痒 | 多形紅斑 | |
| 皮膚 | 亜急性皮膚エリテマトーデス | ||
| 肝臓 | AST、ALT、Al-P、LDH、γ-GTPの上昇 | ||
| 血液 | 好酸球増多 | ||
| 消化器 | 便秘、下痢、口渇、腹部膨満感、大腸炎(collagenous colitis等注3)を含む) | 悪心、嘔吐、食欲不振、腹痛、カンジダ症、味覚異常、口内炎 | 舌炎 |
| 精神神経系 | 頭痛、眠気 | うつ状態、不眠、めまい、振戦 | |
| その他 | 発熱、総コレステロール、尿酸の上昇 | 女性化乳房、浮腫、倦怠感、舌・口唇のしびれ感、四肢のしびれ感、筋肉痛、脱毛 | かすみ目、脱力感、関節痛、低ナトリウム血症、低マグネシウム血症、低カリウム血症、低カルシウム血症 |
| 5%以上 | 1〜5%未満 | 1%未満 | |
| 消化器 | 軟便(13.7%)、下痢(9.1%) | 味覚異常、腹部膨満感 | 悪心、嘔吐、腹痛、便秘、口内炎、舌炎、口渇、胸やけ、胃食道逆流、食欲不振 |
| 肝臓 | AST、ALT、Al-P、LDH、γ-GTP、ビリルビンの上昇 | ||
| 血液 | 好中球減少、好酸球増多、白血球増多、貧血 | 血小板減少 | |
| 過敏症 | 発疹 | そう痒 | |
| 精神神経系 | 頭痛、眠気、めまい、不眠、しびれ感、うつ状態 | ||
| その他 | トリグリセライド、尿酸の上昇、総コレステロールの上昇・低下、尿蛋白陽性、尿糖陽性 | 倦怠感 |
| 5%以上 | 1〜5%未満 | |
| 消化器 | 下痢(13.2%)、味覚異常(8.7%) | 悪心、嘔吐、口内炎、腹痛、排便回数増加 |
| 肝臓 | AST、ALTの上昇 | |
| 過敏症 | 発疹 | |
| 精神神経系 | 頭痛、めまい |
12. 臨床検査結果に及ぼす影響
<ヘリコバクター・ピロリの除菌の補助>
ランソプラゾール等のプロトンポンプインヒビターやアモキシシリン水和物、クラリスロマイシン等の抗生物質及びメトロニダゾールの服用中や投与終了直後では、13C-尿素呼気試験の判定結果が偽陰性になる可能性があるため、13C-尿素呼気試験による除菌判定を行う場合には、これらの薬剤の投与終了後4週以降の時点で実施することが望ましい。
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.1.2 本剤は舌の上にのせて唾液を浸潤させると崩壊するため、水なしで服用可能である。また、水で服用することもできる。
15. その他の注意
15.1 臨床使用に基づく情報
<効能共通>
15.1.1 本剤の長期投与中に良性の胃ポリープを認めたとの報告がある。
15.1.2 本剤の投与が胃癌による症状を隠蔽することがあるので、悪性でないことを確認のうえ投与すること。
15.1.3 海外における複数の観察研究で、プロトンポンプインヒビターによる治療において骨粗鬆症に伴う股関節骨折、手関節骨折、脊椎骨折のリスク増加が報告されている。特に、高用量及び長期間(1年以上)の治療を受けた患者で、骨折のリスクが増加した。
15.1.4 海外における主に入院患者を対象とした複数の観察研究で、プロトンポンプインヒビターを投与した患者においてクロストリジウム・ディフィシルによる胃腸感染のリスク増加が報告されている。
<非びらん性胃食道逆流症>
15.1.5 食道内酸逆流の高リスクである中高齢者、肥満者、裂孔ヘルニア所見ありのいずれにも該当しない場合には本剤の治療効果が得られにくいことが臨床試験により示されている。[7.2参照]
<低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制>
15.1.6 低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発リスクは、ヘリコバクター・ピロリ感染陽性及び加齢により高まる可能性のあることが臨床試験により示唆されている。
15.2 非臨床試験に基づく情報
15.2.1 ラットに52週間強制経口投与した試験で、50mg/kg/日群(臨床用量の約100倍)において1例に良性の精巣間細胞腫が認められている3)。さらに、24ヵ月間強制経口投与した試験で、15mg/kg/日以上の群において良性の精巣間細胞腫の発生増加が、また、5mg/kg/日以上の群において胃のカルチノイド腫瘍が認められており、加えて、雌ラットの15mg/kg/日以上及び雄ラットの50mg/kg/日以上の群において網膜萎縮の発生頻度の増加が認められている。
精巣間細胞腫及び網膜萎縮については、マウスのがん原性試験、イヌ、サルの毒性試験では認められず、ラットに特有な変化と考えられる。
精巣間細胞腫及び網膜萎縮については、マウスのがん原性試験、イヌ、サルの毒性試験では認められず、ラットに特有な変化と考えられる。
15.2.2 ラットにランソプラゾール(15mg/kg/日以上)、アモキシシリン水和物(2,000mg/kg/日)を4週間併用経口投与した試験、及びイヌにランソプラゾール(100mg/kg/日)、アモキシシリン水和物(500mg/kg/日)、クラリスロマイシン(25mg/kg/日)を4週間併用経口投与した試験で、アモキシシリン水和物を単独あるいは併用投与した動物に結晶尿が認められているが、結晶はアモキシシリン水和物が排尿後に析出したものであり、体内で析出したものではないことが確認されている。
16. 薬物動態
16.1 血中濃度
16.1.1 反復投与
健康成人(6例)に1回30mg又は15mg(いずれもカプセル剤)を1日1回7日間朝絶食下に反復経口投与した時の血清中濃度の推移、尿中排泄率から体内蓄積性はないものと考えられる4)。
16.1.2 ランソプラゾール、アモキシシリン水和物及びクラリスロマイシン併用時の薬物動態
健康成人(6例)にランソプラゾールとして1回30mg(カプセル剤)、アモキシシリン水和物として1回1,000mg(力価)及びクラリスロマイシンとして1回400mg(力価)の3剤を同時に経口投与した時注)、ランソプラゾールの未変化体の薬物動態学的パラメータは下表のとおりである。
| 絶食下 | |
| Tmax(h) | 1.7±0.5 |
| Cmax(ng/mL) | 1,104±481 |
| T1/2(h) | 1.9±1.9 |
| AUC(ng・h/mL) | 5,218±6,284 |
なお、3剤併用時の3剤各々の血清中濃度は単独投与時の血清中濃度とほぼ同様の推移を示した。
また、健康成人(7例)に3剤を同様の用量で同時に1日2回7日間反復経口投与した時の薬物動態から、蓄積性はないと考えられる5)。
また、健康成人(7例)に3剤を同様の用量で同時に1日2回7日間反復経口投与した時の薬物動態から、蓄積性はないと考えられる5)。
注)ヘリコバクター・ピロリ感染に対する承認用法・用量と異なる。[6.参照]
16.1.3 生物学的同等性試験
<ランソプラゾールOD錠15mg「ケミファ」>
ランソプラゾールOD錠15mg「ケミファ」とタケプロンOD錠15を、クロスオーバー法によりそれぞれ1錠(ランソプラゾールとして15mg)健康成人男子に絶食後、水あり及び水なし単回経口投与して血清中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された6)。
(1)OD錠15mg、水で服用
| 判定パラメータ | 参考パラメータ | |||
| AUC0-24(ng・h/mL) | Cmax(ng/mL) | Tmax(h) | T1/2(h) | |
| ランソプラゾールOD錠15mg「ケミファ」 | 1302.6±452.1 | 490.9±138.7 | 1.8±1.1 | 1.3±0.3 |
| タケプロンOD錠15 | 1272.1±418.6 | 529.8±140.6 | 1.7±0.7 | 1.3±0.3 |
(2)OD錠15mg、水なしで服用
| 判定パラメータ | 参考パラメータ | |||
| AUC0-24(ng・h/mL) | Cmax(ng/mL) | Tmax(h) | T1/2(h) | |
| ランソプラゾールOD錠15mg「ケミファ」 | 1339.6±579.3 | 453.8±132.7 | 2.1±0.9 | 1.3±0.4 |
| タケプロンOD錠15 | 1294.7±529.0 | 460.4±193.5 | 2.1±1.2 | 1.4±0.4 |
血清中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
<ランソプラゾールOD錠30mg「ケミファ」>
ランソプラゾールOD錠30mg「ケミファ」とタケプロンOD錠30を、クロスオーバー法によりそれぞれ1錠(ランソプラゾールとして30mg)健康成人男子に絶食後、水あり及び水なし単回経口投与して血清中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された6)。
(3)OD錠30mg、水で服用
| 判定パラメータ | 参考パラメータ | |||
| AUC0-24(ng・h/mL) | Cmax(ng/mL) | Tmax(h) | T1/2(h) | |
| ランソプラゾールOD錠30mg「ケミファ」 | 2529.7±1130.9 | 893.6±276.6 | 2.0±0.7 | 1.1±0.3 |
| タケプロンOD錠30 | 2409.2±1327.7 | 948.9±371.6 | 2.1±1.2 | 1.1±0.3 |
(4)OD錠30mg、水なしで服用
| 判定パラメータ | 参考パラメータ | |||
| AUC0-24(ng・h/mL) | Cmax(ng/mL) | Tmax(h) | T1/2(h) | |
| ランソプラゾールOD錠30mg「ケミファ」 | 2641.9±1155.0 | 897.3±248.1 | 2.1±0.8 | 1.4±0.5 |
| タケプロンOD錠30 | 2925.7±1323.4 | 1021.5±318.7 | 1.7±0.8 | 1.4±0.5 |
血清中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.5 排泄
健康成人(6例)に1回30mg(カプセル剤)を絶食下又は食後に、また、1回15mg(カプセル剤)を絶食下に経口投与した場合、尿中には代謝物として排泄され、ランソプラゾールの未変化体は検出されなかった。投与後24時間までの尿中排泄率は13.1〜23.0%であった4)。
16.7 薬物相互作用
ランソプラゾールと水酸化アルミニウムゲル・水酸化マグネシウムを同時に服用すると、ランソプラゾールの血漿中濃度が低下することが外国で報告されている7)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<胃潰瘍、十二指腸潰瘍、吻合部潰瘍、逆流性食道炎、Zollinger-Ellison症候群>
17.1.1 国内第II/III相試験(一般臨床試験及び二重盲検試験)
成人患者を対象に、1日1回30mgを一般臨床試験では主として2〜8週間、二重盲検比較対照試験では8週間(胃潰瘍)及び6週間(十二指腸潰瘍)経口投与した臨床試験において、最終内視鏡判定が行われたランソプラゾール投与群1,109例の疾患別治癒率は下表のとおりである8)9)10)11)12)13)14)15)16)17)18)19)20)21)22)23)24)25)26)27)28)。
| 疾患名 | 例数 | 治癒例数(治癒率) |
| 胃潰瘍 | 575 | 505(87.8) |
| 十二指腸潰瘍 | 445 | 418(93.9) |
| 吻合部潰瘍 | 19 | 17(89.5) |
| 逆流性食道炎 | 67 | 61(91.0) |
| Zollinger-Ellison症候群 | 3 | 3(100) |
| 計 | 1,109 | 1,004(90.5) |
<非びらん性胃食道逆流症>
17.1.2 国内第III相試験(二重盲検試験)
成人患者を対象に、1日1回15mgを経口投与した二重盲検比較対照試験の結果、投与開始後4週間での胸やけの無症状日数の割合(中央値)はランソプラゾール投与群で67.9%(69例)、プラセボ群で42.9%(72例)である。
副作用発現頻度はランソプラゾール投与群で8.6%(6/70)であった31)。
副作用発現頻度はランソプラゾール投与群で8.6%(6/70)であった31)。
<低用量アスピリン投与時における胃潰瘍又は十二指腸潰瘍の再発抑制>注1)
17.1.3 国内第III相試験(二重盲検試験)及び長期継続投与試験
低用量アスピリン(1日81〜324mg)の長期投与を必要とし、かつ胃潰瘍又は十二指腸潰瘍の既往歴を有する成人患者を対象としたランソプラゾール投与群(1日1回15mg経口投与)と対照群との二重盲検比較対照試験の結果、中間解析時におけるKaplan-Meier法により推定した治療開始361日時点の胃潰瘍又は十二指腸潰瘍の累積発症率は、ランソプラゾール投与群9.5%(95%信頼区間:0.00〜23.96)、対照群57.7%(95%信頼区間:29.33〜85.98)であり、対照群に対するハザード比は0.0793(95%信頼区間:0.0239〜0.2631)(logrank検定:p<0.00001)であった。また、最終解析時におけるKaplan-Meier法により推定した治療開始361日時点の胃潰瘍又は十二指腸潰瘍の累積発症率は、ランソプラゾール投与群3.7%(95%信頼区間:0.69〜6.65)、対照群31.7%(95%信頼区間:23.86〜39.57)であり、対照群に対するハザード比は0.0989(95%信頼区間:0.0425〜0.2300)(logrank検定:p<0.0001)であった。
さらに、上記試験後非盲検下でランソプラゾールを継続して、あるいは、対照群をランソプラゾールに切り替えて、1日1回15mgを24週間経口投与した長期継続投与試験において、胃潰瘍又は十二指腸潰瘍の発症は認められなかった32)33)。
副作用発現頻度はランソプラゾール投与群で16.2%(55/339)であり、主な副作用は、便秘4.1%(14/339)、下痢3.2%(11/339)であった32)。
さらに、上記試験後非盲検下でランソプラゾールを継続して、あるいは、対照群をランソプラゾールに切り替えて、1日1回15mgを24週間経口投与した長期継続投与試験において、胃潰瘍又は十二指腸潰瘍の発症は認められなかった32)33)。
副作用発現頻度はランソプラゾール投与群で16.2%(55/339)であり、主な副作用は、便秘4.1%(14/339)、下痢3.2%(11/339)であった32)。
注1)非ステロイド性抗炎症薬長期投与時の試験成績は含まれていない。
<非ステロイド性抗炎症薬投与時における胃潰瘍又は十二指腸潰瘍の再発抑制>
17.1.4 国内第III相試験(二重盲検試験)及び長期継続投与試験
関節リウマチ、変形性関節症等の疼痛管理のために、非ステロイド性抗炎症薬の長期投与を必要とし、かつ胃潰瘍又は十二指腸潰瘍の既往歴を有する成人患者を対象としたランソプラゾール投与群(1日1回15mg経口投与)と対照群との二重盲検比較対照試験の結果、Kaplan-Meier法により推定した治療開始361日時点の胃潰瘍又は十二指腸潰瘍の累積発症率は、ランソプラゾール投与群12.7%(95%信頼区間:5.85〜19.59)、対照群36.9%(95%信頼区間:27.51〜46.35)であり、対照群に対するハザード比は0.2510(95%信頼区間:0.1400〜0.4499)(logrank検定:p<0.0001)であった。
副作用発現頻度はランソプラゾール投与群で15.3%(28/183)であり、主な副作用は下痢4.4%(8/183)、高ガストリン血症2.7%(5/183)であった34)。
副作用発現頻度はランソプラゾール投与群で15.3%(28/183)であり、主な副作用は下痢4.4%(8/183)、高ガストリン血症2.7%(5/183)であった34)。
<胃潰瘍又は十二指腸潰瘍におけるヘリコバクター・ピロリ感染>
17.1.5 国内第III相試験(二重盲検試験)
ヘリコバクター・ピロリ陽性の胃潰瘍又は十二指腸潰瘍の成人患者を対象とした除菌の臨床試験(ランソプラゾール、アモキシシリン水和物及びクラリスロマイシンの3剤投与)における除菌注2)率は下表のとおりである。
| 各薬剤の1回投与量 | 投与回数 | 除菌率 |
| ランソプラゾール 30mg アモキシシリン水和物 750mg(力価) クラリスロマイシン 200mg(力価) | 2回/日 | 87.5%(84/96例) |
| ランソプラゾール 30mg アモキシシリン水和物 750mg(力価) クラリスロマイシン 400mg(力価) | 2回/日 | 89.2%(83/93例) |
| 各薬剤の1回投与量 | 投与回数 | 除菌率 |
| ランソプラゾール 30mg アモキシシリン水和物 750mg(力価) クラリスロマイシン 200mg(力価) | 2回/日 | 91.1%(82/90例) |
| ランソプラゾール 30mg アモキシシリン水和物 750mg(力価) クラリスロマイシン 400mg(力価) | 2回/日 | 83.7%(82/98例) |
除菌率は基本解析対象集団を対象とした。
副作用発現頻度は50.5%(217/430)であり、主な副作用は軟便13.7%(59/430)、下痢8.8%(38/430)であった35)。
なお、米国及び英国で行われたヘリコバクター・ピロリ陽性の十二指腸潰瘍等に対する除菌の臨床試験注3)においても、同程度の除菌率が認められている36)37)。
なお、米国及び英国で行われたヘリコバクター・ピロリ陽性の十二指腸潰瘍等に対する除菌の臨床試験注3)においても、同程度の除菌率が認められている36)37)。
注2)培養法及び組織診断法の結果がいずれも陰性。
注3)各薬剤の投与量、投与期間は下記のとおりであり、国内の承認用法・用量と異なる。[6.参照]
米国
ランソプラゾールとして1回30mg、アモキシシリン水和物として1回1,000mg(力価)及びクラリスロマイシンとして1回500mg(力価)の3剤を1日2回、10日間又は14日間経口投与
英国
ランソプラゾールとして1回30mg、アモキシシリン水和物として1回1,000mg(力価)及びクラリスロマイシンとして1回250mg(力価)の3剤を1日2回、7日間経口投与
17.3 その他
17.3.1 血清ガストリンに及ぼす影響
1日1回30mgを、胃潰瘍患者には8週間経口投与した場合、血清ガストリン値の有意な上昇が認められるが、投与終了4週後に回復する26)。
17.3.2 内分泌機能に及ぼす影響
胃潰瘍及び十二指腸潰瘍患者に1日1回30mgを8週間経口投与した場合、プロラクチン、コルチゾール、GH、TSH、T3、T4、LH、FSH、DHEA-S、テストステロン、エストラジオールに殆ど影響を及ぼさない27)。
17.3.3 胃粘膜の内分泌細胞密度に及ぼす影響
胃潰瘍及び十二指腸潰瘍患者に1日1回30mgを8週間経口投与した場合、胃粘膜の内分泌細胞密度に影響を及ぼさない28)。
18. 薬効薬理
18.1 作用機序
18.2 胃酸分泌抑制作用
18.2.1 ペンタガストリン刺激分泌
健康成人への1日1回30mg単回並びに7日間経口投与により著明な胃酸分泌抑制作用が認められ、この作用は投与24時間後も持続する4)。
18.2.2 インスリン刺激分泌
健康成人への1日1回30mg7日間経口投与により著明な胃酸分泌抑制作用が認められる42)。
18.2.3 夜間分泌
健康成人への1日1回30mg7日間経口投与により胃酸分泌の明らかな抑制が認められる43)。
18.2.4 24時間分泌
健康成人における24時間胃液採取試験で、1日1回30mg7日間経口投与により1日を通して胃酸分泌の著明な抑制が認められる44)。
18.2.5 24時間胃内pHモニタリング
18.2.6 24時間下部食道内pHモニタリング
逆流性食道炎患者への1日1回30mg7〜9日間経口投与により胃食道逆流現象の著明な抑制作用が認められる22)。
18.3 ヘリコバクター・ピロリ除菌の補助作用
19. 有効成分に関する理化学的知見
19.1. ランソプラゾール
22. 包装
<ランソプラゾールOD錠15mg「ケミファ」>
100錠[10錠(PTP)×10、乾燥剤入り]
140錠[14錠(PTP)×10、乾燥剤入り]
500錠[10錠(PTP)×50、乾燥剤入り]
<ランソプラゾールOD錠30mg「ケミファ」>
100錠[10錠(PTP)×10、乾燥剤入り]
23. 主要文献
- 三輪 清 他, 薬理と治療, 18, 3413-3435, (1990)
- Schardein J.L. et al., 薬理と治療, 18 (Suppl.10), 2773-2783, (1990)
- Atkinson J.E. et al., 薬理と治療, 18 (Suppl.10), 2713-2745, (1990)
- 立野政雄 他, 臨床医薬, 7, 51-62, (1991)
- ランソプラゾール・アモキシシリン水和物・クラリスロマイシン併用投与時の薬物動態(タケプロンカプセル等:2000年9月22日承認、申請資料概要へ.3.(1))
- シオノケミカル株式会社:生物学的同等性に関する資料(社内資料)
- Delhotal-Landes B. et al., Eur J Drug Metab Pharmacokinet., 3, 315-320, (1991)
- 竹本忠良 他, 臨床成人病, 21, 769-783, (1991)
- 竹本忠良 他, 臨床成人病, 21, 975-993, (1991)
- 竹本忠良 他, 臨床成人病, 21, 995-1013, (1991)
- 竹本忠良 他, Modern Physician., 11, 117-125, (1991)
- 竹本忠良 他, Modern Physician., 11, 253-260, (1991)
- 中村 肇 他, Therapeutic Research., 11, 4039-4045, (1990)
- 安武晃一 他, 消化器科, 13, 602-610, (1990)
- 浅香正博 他, 薬理と治療, 19, 953-966, (1991)
- 児玉 正 他, 薬理と治療, 18, 4891-4900, (1990)
- 森瀬公友 他, 薬理と治療, 19, 327-338, (1991)
- 湯川永洋 他, 薬理と治療, 18, 4919-4924, (1990)
- 興梠憲男 他, Therapeutic Research., 12, 917-928, (1991)
- 園田孝志 他, 薬理と治療, 18, 4911-4918, (1990)
- 西村善也 他, 薬理と治療, 18, 4901-4909, (1990)
- 関口利和 他, Therapeutic Research., 12, 191-213, (1991)
- 岸清一郎 他, Progress in Medicine., 10, 3197-3206, (1990)
- 竹本忠良 他, 臨床成人病, 21, 327-345, (1991)
- 竹本忠良 他, 臨床成人病, 21, 613-631, (1991)
- 牧山和也 他, 薬理と治療, 19, 307-325, (1991)
- 三澤 正 他, Therapeutic Research., 12, 175-189, (1991)
- 小越和栄 他, 薬理と治療, 19, 933-946, (1991)
- 遠藤光夫 他, 臨床成人病, 29, 805-817, (1999)
- 遠藤光夫 他, 臨床成人病, 29, 959-977, (1999)
- 国内第III相臨床試験(二重盲検試験)(タケプロンカプセル15、タケプロンOD錠15:2006年6月15日承認、審査報告書)
- 国内第III相臨床試験(二重盲検試験)[1](タケプロンカプセル15、タケプロンOD錠15:2010年7月23日承認、審査報告書)
- 長期継続投与試験(タケプロンカプセル15、タケプロンOD錠15:2010年7月23日承認、申請資料概要2.7.3.2)
- 国内第III相臨床試験(二重盲検試験)[2](タケプロンカプセル15、タケプロンOD錠15:2010年7月23日承認、審査報告書)
- Hp陽性の胃潰瘍又は十二指腸潰瘍に対するランソプラゾール・アモキシシリン水和物・クラリスロマイシンの3剤療法(タケプロンカプセル等:2000年9月22日承認、申請資料概要ト.1.4)
- 米国で実施した臨床試験(タケプロンカプセル等:2000年9月22日承認、申請資料概要ト.3.1))
- 英国で実施した臨床試験(タケプロンカプセル等:2000年9月22日承認、申請資料概要ト.3.3))
- Satoh H. et al., J.Pharmacol.Exp.Ther., 248, 806-815, (1989)
- Nagaya H. et al., Jpn.J.Pharmacol., 55, 425-436, (1991) »DOI
- Nagaya H. et al., J.Pharmacol.Exp.Ther., 248, 799-805, (1989)
- Nagaya H. et al., J.Pharmacol.Exp.Ther., 252, 1289-1295, (1990)
- 杉山 貢 他, 消化器科, 14, 183-193, (1991)
- 松尾 裕 他, 薬理と治療, 18, 4865-4876, (1990)
- 多田正弘 他, 臨床成人病, 21, 633-640, (1991)
- Hongo M. et al., Dig.Dis.Sci., 37, 882-890, (1992)
- 浜向伸治 他, 薬理と治療, 19, 925-931, (1991)
- 木平 健 他, 日本消化器病学会雑誌, 88, 672-680, (1991) »DOI
- ランソプラゾール・アモキシシリン水和物・クラリスロマイシン併用投与時の体内動態及び抗菌作用まとめ(タケプロンカプセル等:2000年9月22日承認、申請資料概要へ.4)
- 中尾雅文 他, Helicobacter Research., 1, 49-55, (1997)
- Cederbrant G. et al., J.Antimicrob.Chemother., 34, 1025-1029, (1994)
24. 文献請求先及び問い合わせ先
文献請求先
日本ケミファ株式会社
安全管理部
〒101-0032
東京都千代田区岩本町2丁目2-3
電話:0120-47-9321
03-3863-1225
03-3863-1225
FAX:03-3861-9567
製品情報問い合わせ先
日本ケミファ株式会社
安全管理部
〒101-0032
東京都千代田区岩本町2丁目2-3
電話:0120-47-9321
03-3863-1225
03-3863-1225
FAX:03-3861-9567
26. 製造販売業者等
26.1 製造販売元
シオノケミカル株式会社
東京都中央区八重洲2丁目10番10号
26.2 販売元
日本ケミファ株式会社
東京都千代田区岩本町2丁目2-3