医薬品情報
| 総称名 | ワコビタール |
|---|---|
| 一般名 | フェノバルビタールナトリウム |
| 欧文一般名 | Phenobarbital sodium |
| 製剤名 | フェノバルビタールナトリウム坐剤 |
| 薬効分類名 | 小児用催眠・鎮静・抗けいれん剤 |
| 薬効分類番号 | 1125 |
| ATCコード | N03AA02 |
| KEGG DRUG |
D00701
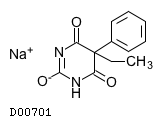
フェノバルビタールナトリウム
|
| KEGG DGROUP |
DG00845
フェノバルビタール
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年2月 改訂(第2版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 15.その他の注意 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 25.保険給付上の注意 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ワコビタール坐剤15 | WAKOBITAL Suppositories | 高田製薬 | 1125700J1025 | 30.2円/個 | 劇薬, 向精神薬(第三種向精神薬), 習慣性医薬品, 処方箋医薬品 |
| ワコビタール坐剤30 | WAKOBITAL Suppositories | 高田製薬 | 1125700J3028 | 40.5円/個 | 劇薬, 向精神薬(第三種向精神薬), 習慣性医薬品, 処方箋医薬品 |
| ワコビタール坐剤50 | WAKOBITAL Suppositories | 高田製薬 | 1125700J4032 | 52円/個 | 劇薬, 向精神薬(第三種向精神薬), 習慣性医薬品, 処方箋医薬品 |
| ワコビタール坐剤100 | WAKOBITAL Suppositories | 高田製薬 | 1125700J5039 | 65.8円/個 | 劇薬, 向精神薬(第三種向精神薬), 習慣性医薬品, 処方箋医薬品 |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分又はバルビツール酸系化合物に対して過敏症の患者
2.2 急性間欠性ポルフィリン症の患者[ポルフィリン合成が増加し、症状が悪化するおそれがある。]
2.3 ボリコナゾール、イサブコナゾニウム硫酸塩、タダラフィル(肺高血圧症を適応とする場合)、マシテンタン、チカグレロル、ドラビリン、アルテメテル・ルメファントリン、ダルナビル・コビシスタット、リルピビリン、ミフェプリストン・ミソプロストール、ニルマトレルビル・リトナビル、リルピビリン・テノホビル アラフェナミド・エムトリシタビン、ビクテグラビル・エムトリシタビン・テノホビル アラフェナミド、ダルナビル・コビシスタット・エムトリシタビン・テノホビル アラフェナミド、エルビテグラビル・コビシスタット・エムトリシタビン・テノホビル アラフェナミド、ソホスブビル・ベルパタスビル、ドルテグラビル・リルピビリン、カボテグラビルを投与中の患者[10.1参照]
4. 効能または効果
6. 用法及び用量
フェノバルビタールナトリウムとして、通常小児では1日4〜7mg/kgを標準として直腸内に挿入する。
なお、症状、目的に応じ適宜増減する。
なお、症状、目的に応じ適宜増減する。
8. 重要な基本的注意
<効能共通>
8.2 連用により薬物依存を生じることがあるので、てんかんの治療に用いる場合以外は、漫然とした継続投与による長期使用を避けること。投与を継続する場合には、治療上の必要性を十分に検討すること。[9.1.6、9.1.7、11.1.3参照]
8.3 眠気、注意力・集中力・反射運動能力等の低下が起こることがあるので、本剤投与中の患者の行動には十分注意すること。
<熱性けいれんおよびてんかんのけいれん発作>
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 虚弱者
9.1.2 呼吸機能の低下している患者
呼吸抑制を起こすことがある。[11.1.6参照]
9.1.3 頭部外傷後遺症又は進行した動脈硬化症の患者
本剤の作用が強くあらわれることがある。
9.1.4 心障害のある患者
血圧低下や心拍数減少を起こすおそれがある。
9.1.5 アルコール中毒のある患者
中枢抑制作用が増強される。
9.1.6 薬物依存の傾向又は既往歴のある患者
9.1.7 重篤な神経症の患者
9.1.8 甲状腺機能低下症の患者
甲状腺機能の異常をきたすおそれがある1)。
9.2 腎機能障害患者
症状の悪化、また血中濃度上昇のおそれがある。[8.1参照]
9.3 肝機能障害患者
9.5 妊婦
9.5.1 妊婦又は妊娠している可能性のある女性には投与しないこと。妊娠中に単独、又は併用投与された患者の中に、口唇裂、口蓋裂、心奇形、大動脈縮窄症等を有する児を出産した例が多いとの疫学的調査報告がある。[2.4参照]
9.5.2 妊娠中の投与により、新生児に出血傾向、呼吸抑制等を起こすことがある。[2.4参照]
9.5.3 分娩前に連用した場合、出産後新生児に離脱症状(多動、振戦、反射亢進、過緊張等)があらわれることがある。[2.4参照]
注)本剤は小児用の製剤である。
9.6 授乳婦
授乳を避けさせること。ヒト母乳中へ移行し、新生児、乳児に傾眠、哺乳量低下を起こすことがある。
注)本剤は小児用の製剤である。
9.7 小児等
9.7.1 新生児、低出生体重児
生後5日までの新生児では、直腸よりの吸収が極めて微量のことがある。しかし、吸収されたときは半減期が極めて長い。
9.8 高齢者
10. 相互作用
相互作用序文
本剤は薬物代謝酵素CYP3A等の誘導作用を有する3)。
薬物代謝酵素用語
CYP3A
10.1 併用禁忌
| ボリコナゾール ブイフェンド イサブコナゾニウム硫酸塩 クレセンバ タダラフィル 肺高血圧症を適応とする場合:アドシルカ マシテンタン オプスミット チカグレロル ブリリンタ ドラビリン ピフェルトロ アルテメテル・ルメファントリン リアメット配合錠 ダルナビル・コビシスタット プレジコビックス配合錠 リルピビリン エジュラント [2.3参照] | これらの薬剤の代謝が促進され、血中濃度が低下するおそれがある。 | 本剤の肝薬物代謝酵素(CYP3A)誘導作用による。 |
| ミフェプリストン・ミソプロストール メフィーゴ [2.3参照] | ミフェプリストンの代謝が促進され、血中濃度が低下し効果が減弱するおそれがあるので、本剤の影響がなくなるまで投与しないこと。 | 本剤の肝薬物代謝酵素(CYP3A)誘導作用による。 |
| ニルマトレルビル・リトナビル パキロビッド [2.3参照] | ニルマトレルビル及びリトナビルの血中濃度が低下し、作用の減弱や耐性出現のおそれがある。 | 本剤の肝薬物代謝酵素(CYP3A)誘導作用による。 |
| リルピビリン・テノホビル アラフェナミド・エムトリシタビン オデフシィ配合錠 [2.3参照] | リルピビリン及びテノホビル アラフェナミドの血中濃度が低下するおそれがある。 | 本剤の肝薬物代謝酵素(CYP3A)誘導作用及びP糖蛋白誘導作用による。 |
| ビクテグラビル・エムトリシタビン・テノホビル アラフェナミド ビクタルビ配合錠 [2.3参照] | ビクテグラビル及びテノホビル アラフェナミドの血中濃度が低下するため、この薬剤の効果が減弱し、この薬剤に対する耐性が発現する可能性がある。 | 本剤の肝薬物代謝酵素(CYP3A)誘導作用及びP糖蛋白誘導作用による。 |
| ダルナビル・コビシスタット・エムトリシタビン・テノホビル アラフェナミド シムツーザ配合錠 [2.3参照] | ダルナビル、コビシスタット及びテノホビル アラフェナミドの血中濃度が低下するおそれがある。 | 本剤の肝薬物代謝酵素(CYP3A)誘導作用及びP糖蛋白誘導作用による。 |
| エルビテグラビル・コビシスタット・エムトリシタビン・テノホビルアラフェナミド ゲンボイヤ配合錠 [2.3参照] | エルビテグラビル、コビシスタット及びテノホビル アラフェナミドの血中濃度が低下するおそれがある。 | 本剤の肝薬物代謝酵素(CYP3A)誘導作用及びP糖蛋白誘導作用による。 |
| ソホスブビル・ベルパタスビル エプクルーサ配合錠 [2.3参照] | ソホスブビル及びベルパタスビルの血中濃度が低下するおそれがある。 | 本剤の肝薬物代謝酵素(CYP3A)誘導作用及びP糖蛋白誘導作用による。 |
| ドルテグラビル・リルピビリン ジャルカ配合錠 [2.3参照] | ドルテグラビル及びリルピビリンの血中濃度が低下するおそれがある。 | 本剤の肝薬物代謝酵素(CYP3A)誘導作用及びUGT1A1誘導作用による。 |
| カボテグラビル ボカブリア [2.3参照] | カボテグラビルの血漿中濃度が低下し、効果が減弱するおそれがある。 | 本剤のUGT1A1誘導作用による。 |
10.2 併用注意
| 中枢神経抑制剤 フェノチアジン誘導体、バルビツール酸誘導体、トランキライザー、トピラマート等 抗ヒスタミン剤 ジフェンヒドラミン等 アルコール | 相互に作用が増強されることがあるので、減量するなど注意すること。 | 相加的中枢神経抑制作用による。 |
| MAO阻害剤 | 相互に作用が増強されることがあるので、減量するなど注意すること。 | 機序不明 |
| 三環系抗うつ剤 イミプラミン等 四環系抗うつ剤 マプロチリン等 | (1)相互に作用が増強されることがあるので、減量するなど注意すること。 (2)これらの抗うつ剤の血中濃度が低下することがある。注) | (1)相加的中枢神経抑制作用による。 (2)本剤の肝薬物代謝酵素誘導作用による。 |
| メチルフェニデート | 本剤の血中濃度が上昇することがあるので、本剤を減量するなど注意すること。 | メチルフェニデートが肝代謝を抑制すると考えられている。 |
| バルプロ酸 | (1)本剤の血中濃度が上昇し、作用が増強されることがある。 (2)バルプロ酸の血中濃度が低下することがある。注) (3)バルプロ酸による高アンモニア血症の発現リスクが高まるおそれがある。 | (1)バルプロ酸が肝代謝を抑制する。 (2)本剤の肝薬物代謝酵素誘導作用による。 (3)機序不明 |
| スチリペントール | (1)本剤の血中濃度が上昇し、作用が増強されることがある。 (2)スチリペントールの血中濃度が低下することがある。注) | (1)スチリペントールの薬剤が肝代謝を抑制する。 (2)本剤の肝薬物代謝酵素誘導作用による。 |
| クロバザム | (1)本剤の血中濃度が上昇することがある。 (2)クロバザムの血中濃度が低下することがある。注) | (1)機序不明 (2)本剤の肝薬物代謝酵素誘導作用による。 |
| イリノテカン | イリノテカンの活性代謝物の血中濃度が低下し、作用が減弱することがあるので、併用を避けることが望ましい。 | 本剤の肝薬物代謝酵素誘導作用による。 |
| 主にCYP3Aの基質となる薬剤 アゼルニジピン、 イグラチモド、 イマチニブ、 カルバマゼピン、 シクロスポリン、 ゾニサミド、 タクロリムス、 フェロジピン、 ベラパミル、 モンテルカスト等 副腎皮質ホルモン剤 デキサメタゾン等 卵胞ホルモン剤・黄体ホルモン剤 ノルゲストレル・エチニルエストラジオール等 PDE5阻害剤 タダラフィル 勃起不全、前立腺肥大症に伴う排尿障害を適応とする場合:シアリス、ザルティア シルデナフィル、 バルデナフィル | これらの薬剤の血中濃度が低下し、作用が減弱することがあるので用量に注意すること。注) | 本剤の肝薬物代謝酵素誘導作用による。 |
| アミノフィリン水和物、 クロラムフェニコール、 テオフィリン、 パロキセチン、 フレカイニド、 メトロニダゾール | これらの薬剤の血中濃度が低下し、作用が減弱することがあるので用量に注意すること。注) | 本剤の肝薬物代謝酵素誘導作用による。 |
| ラモトリギン、 デフェラシロクス、 カナグリフロジン、 ラルテグラビル | これらの薬剤の血中濃度が低下することがある。注) | 本剤がこれらの薬剤のグルクロン酸抱合を促進する。 |
| ルフィナミド | これらの薬剤の血中濃度が低下することがある。注) | 機序不明 |
| アピキサバン | これらの薬剤の血中濃度が低下することがある。注) | 本剤の肝薬物代謝酵素誘導作用及びP糖蛋白誘導作用による。 |
| レジパスビル・ソホスブビル、 グレカプレビル・ピブレンタスビル、 テノホビル アラフェナミド | これらの薬剤の血中濃度が低下することがある。注) | 本剤のP糖蛋白誘導作用による。 |
| ドルテグラビル、 ドルテグラビル・ラミブジン、 ドルテグラビル・アバカビル・ラミブジン | ドルテグラビルの血中濃度が低下するおそれがある。 | 本剤の肝薬物代謝酵素(CYP3A4)誘導作用及びUGT1A1誘導作用による。 |
| レナカパビルナトリウム | レナカパビルの血漿中濃度が低下する可能性があり、レナカパビルの効果が減弱し、レナカパビルに対する耐性が発現する可能性がある。本剤との併用は推奨されない。 | 本剤の中程度の肝薬物代謝酵素(CYP3A)誘導作用、P糖蛋白誘導作用及びUGT1A1誘導作用による。 |
| ドキシサイクリン | ドキシサイクリンの血中濃度半減期が短縮することがある。 | 本剤の肝薬物代謝酵素誘導作用による。 |
| クマリン系抗凝血剤 ワルファリン | クマリン系抗凝血剤の作用が減弱することがあるので、通常より頻回に血液凝固時間の測定を行い、クマリン系抗凝血剤の量を調整すること。 | 本剤の肝薬物代謝酵素誘導作用による。 |
| アルベンダゾール | アルベンダゾールの活性代謝物の血中濃度が低下し、効果が減弱することがある。 | 機序不明 |
| 利尿剤 チアジド系降圧利尿剤等 | 起立性低血圧が増強されることがあるので、減量するなど注意すること。 | 機序は不明であるが、高用量の本剤は血圧を低下させることがある。 |
| アセタゾラミド | くる病、骨軟化症があらわれやすい。 | 本剤によるビタミンDの不活性化促進、又はアセタゾラミドによる腎尿細管障害、代謝性アシドーシス等が考えられている。 |
| アセトアミノフェン | 本剤の長期連用者は、アセトアミノフェンの代謝物による肝障害を生じやすくなる。 | 本剤の肝薬物代謝酵素誘導作用により、アセトアミノフェンから肝毒性を持つN-アセチル-p-ベンゾキノンイミンへの代謝が促進されると考えられている。 |
| セイヨウオトギリソウ(St.John's Wort,セント・ジョーンズ・ワート)含有食品 | 本剤の代謝が促進され血中濃度が低下するおそれがあるので、本剤投与時はセイヨウオトギリソウ含有食品を摂取しないよう注意すること。 | セイヨウオトギリソウの肝薬物代謝酵素誘導作用によると考えられている。 |
| リオチロニンナトリウム、 レボチロキシンナトリウム水和物 | これらの薬剤の血中濃度を低下させることがあるので、併用する場合にはこれらの薬剤を増量するなど慎重に投与すること。 | 本剤は甲状腺ホルモンの異化を促進すると考えられている。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)4)、皮膚粘膜眼症候群(Stevens-Johnson症候群)、紅皮症(剥脱性皮膚炎)(いずれも頻度不明)
発熱、紅斑、水疱・びらん、そう痒感、咽頭痛、眼充血、口内炎等の異常が認められた場合には、投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.2 過敏症症候群(頻度不明)
初期症状として発疹、発熱がみられ、更にリンパ節腫脹、肝機能障害等の臓器障害、白血球増加、好酸球増多、異型リンパ球出現等を伴う遅発性の重篤な過敏症状があらわれることがある。なお、ヒトヘルペスウイルス6(HHV-6)等のウイルスの再活性化を伴うことが多く、発疹、発熱、肝機能障害等の症状が再燃あるいは遷延化することがあるので注意すること。
11.1.3 依存性(頻度不明)
11.1.4 顆粒球減少、血小板減少(いずれも頻度不明)[8.1参照]
11.1.5 肝機能障害(頻度不明)
11.2 その他の副作用
| 0.1〜1%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | 猩紅熱様発疹、麻疹様発疹、中毒疹様発疹 | ||
| 血液 | 血小板減少、巨赤芽球性貧血 | ||
| 肝臓 | AST・ALT・γ-GTP上昇等の肝機能障害 | 黄疸 | |
| 腎臓 | 蛋白尿等の腎障害注1) | ||
| 精神神経系 | 眠気、ふらつき | 脱力感、運動失調、精神機能低下 | アステリキシス(asterixis)5)6)、眩暈、頭痛、せん妄、昏迷、鈍重、構音障害、知覚異常、興奮、多動 |
| 消化器 | 下痢 | 食欲不振 | |
| 骨・歯 | くる病注2)、骨軟化症注2)、歯牙の形成不全注2)、低カルシウム血症 | ||
| 内分泌系 | 甲状腺機能検査値(血清T4値等)の異常1) | ||
| その他 | 血清葉酸値の低下、ヘマトポルフィリン尿注1)、発熱 |
13. 過量投与
13.1 症状
中枢神経系及び心血管系抑制。血中濃度40〜45μg/mL以上で眠気、眼振、運動失調が起こり、重症の中毒では昏睡状態となる。呼吸は早期より抑制され、脈拍は弱く、皮膚には冷汗があり、体温は下降する。肺の合併症や腎障害の危険性もある。
13.2 処置
呼吸管理。炭酸水素ナトリウム投与による尿アルカリ化、利尿剤投与により薬物の排泄を促進させる。重症の場合は、血液透析や血液灌流を考慮すること。
14. 適用上の注意
14.1 薬剤投与時の注意
直腸内投与のみに使用し、経口投与はしないこと。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 血清免疫グロブリン(IgA、IgG等)の異常があらわれることがある7)。
15.1.2 本剤と他の抗てんかん薬(フェニトイン、カルバマゼピン)との間に交差過敏症(過敏症症候群を含む皮膚過敏症)を起こしたとの報告がある。
15.2 非臨床試験に基づく情報
ラット及びマウスに長期間大量投与(ラット:25mg/kg、マウス:75mg/kg)したところ、対照群に比較して肝腫瘍の発生が有意に増加したとの報告がある。
17. 臨床成績
17.1 有効性及び安全性に関する試験
18. 薬効薬理
18.1 作用機序
ワコビタール坐剤は中枢神経系に対し抑制作用をあらわす。特に大脳皮質の介在ニューロン及び脳幹網様体賦活系を抑制して鎮静作用を示し、更に強く抑制されると自然睡眠に類似した催眠作用を示す。また、大脳皮質運動領を特異的に抑制して強い抗けいれん作用を示し、特に大発作や皮質焦点性てんかん発作を抑える16)。
18.2 薬理作用
18.2.1 鎮静・催眠作用
ワコビタール坐剤をマウスに投与した実験で自発運動量減少作用、筋の懸垂力低下作用、正向反射抑制作用等の中枢抑制作用を示す。
18.2.2 抗けいれん作用
ワコビタール坐剤をマウスに投与した実験で、Bemegrideけいれんに対し抑制作用を示す。
19. 有効成分に関する理化学的知見
19.1. フェノバルビタールナトリウム
22. 包装
<ワコビタール坐剤15>
50個[5個×10]
<ワコビタール坐剤30>
50個[5個×10]
<ワコビタール坐剤50>
50個[5個×10]
<ワコビタール坐剤100>
50個[5個×10]
23. 主要文献
- 有田忠司他, 精神医学, 27 (11), 1297-1304, (1985)
- A.V.Delgado-Escueta,et al., NEUROLOGY., 42 (Suppl 5), 149-160, (1992)
- 岩橋和彦他, 臨床精神薬理, 1 (7), 721-727, (1998)
- 松本鐐一他, 皮膚科の臨床, 12 (11), 973-983, (1970)
- 金山隆夫他, 精神神経学雑誌, 83 (7), 448-458, (1981) »PubMed
- 竹下久由他, 精神医学, 26 (12), 1299-1308, (1984)
- 久野保夫他, 小児科臨床, 31 (9), 1681-1684, (1978)
- 根岸宏邦他, 小児科臨床, 31 (5), 125-128, (1968)
- 美濃真他, 小児科臨床, 31 (5), 129-132, (1978)
- 加藤英夫他, 小児科臨床, 31 (7), 170-175, (1978)
- 中島春美, 小児科臨床, 31 (7), 176-180, (1978)
- 遠藤晴久他, 小児科臨床, 31 (8), 687-697, (1978)
- 菊池辰夫他, 小児科臨床, 31 (8), 698-704, (1978)
- 有泉基水他, 小児科臨床, 33 (8), 1739-1748, (1980)
- 竹重博子他, 小児科臨床, 34 (7), 1659-1664, (1981)
- 熊谷洋他, 臨床薬理学大系第一巻, 88-103, (1965)
24. 文献請求先及び問い合わせ先
文献請求先
高田製薬株式会社
文献請求窓口
〒336-8666
さいたま市南区沼影1丁目11番1号
電話:0120-989-813
FAX:048-816-4183
製品情報問い合わせ先
高田製薬株式会社
文献請求窓口
〒336-8666
さいたま市南区沼影1丁目11番1号
電話:0120-989-813
FAX:048-816-4183
25. 保険給付上の注意
25.1 投薬期間制限医薬品に関する情報
本剤は厚生労働省告示第97号(平成20年3月19日付)に基づき、投薬量は1回14日分を限度とされています。
26. 製造販売業者等
26.1 製造販売元
高田製薬株式会社
さいたま市西区宮前町203番地1