医薬品情報
| 総称名 | イトリゾール |
|---|---|
| 一般名 | イトラコナゾール |
| 欧文一般名 | Itraconazole |
| 製剤名 | イトラコナゾールカプセル |
| 薬効分類名 | 経口抗真菌剤 |
| 薬効分類番号 | 6290 |
| ATCコード | J02AC02 |
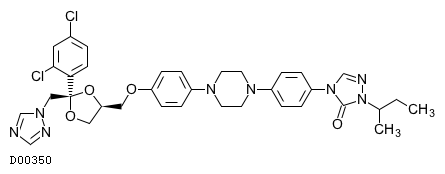
| KEGG DRUG |
D00350
イトラコナゾール
|
| KEGG DGROUP |
DG01523
トリアゾール系抗真菌薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年8月 改訂(第7版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| イトリゾールカプセル50 | ITRIZOLE Capsules 50 | ヤンセンファーマ | 6290004M1029 | 111.7円/カプセル | 処方箋医薬品※ |
2. 禁忌
次の患者には投与しないこと
2.1 ピモジド、キニジン、ベプリジル、トリアゾラム、シンバスタチン、アゼルニジピン、アゼルニジピン・オルメサルタン メドキソミル、ニソルジピン、エルゴタミン・カフェイン・イソプロピルアンチピリン、ジヒドロエルゴタミン、エルゴメトリン、メチルエルゴメトリン、バルデナフィル、エプレレノン、ブロナンセリン、シルデナフィル(レバチオ)、タダラフィル(アドシルカ)、スボレキサント、イブルチニブ、チカグレロル、ロミタピド、イバブラジン、ベネトクラクス(再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)の用量漸増期)、ルラシドン塩酸塩、アナモレリン塩酸塩、フィネレノン、ボクロスポリン、イサブコナゾニウム硫酸塩、アリスキレン、ダビガトラン、リバーロキサバンを投与中の患者[10.1参照]
2.5 妊婦又は妊娠している可能性のある女性[9.5参照]
4. 効能または効果
[適応菌種]
[適応症]
5. 効能または効果に関連する注意
<表在性皮膚真菌症(爪白癬以外)>
5.1 難治性あるいは汎発性の病型に使用すること。
<爪白癬(パルス療法)>
5.2 本剤は抗菌薬であるため、新しい爪が伸びてこない限り、一旦変色した爪所見を回復させるものではない。
6. 用法及び用量
<内臓真菌症(深在性真菌症)>
通常、成人にはイトラコナゾールとして100〜200mgを1日1回食直後に経口投与する。なお、年齢、症状により適宜増減する。ただし、イトラコナゾール注射剤からの切り替えの場合、1回200mgを1日2回(1日用量400mg)食直後に経口投与する。
<深在性皮膚真菌症>
通常、成人にはイトラコナゾールとして100〜200mgを1日1回食直後に経口投与する。なお、年齢、症状により適宜増減する。ただし、1日最高用量は200mgとする。
<表在性皮膚真菌症(爪白癬以外)>
通常、成人にはイトラコナゾールとして50〜100mgを1日1回食直後に経口投与する。ただし、爪カンジダ症及びカンジダ性爪囲爪炎に対しては、100mgを1日1回食直後に経口投与する。なお、年齢、症状により適宜増減する。ただし、1日最高用量は200mgとする。
<爪白癬(パルス療法)>
通常、成人にはイトラコナゾールとして1回200mgを1日2回(1日量400mg)食直後に1週間経口投与し、その後3週間休薬する。これを1サイクルとし、3サイクル繰り返す。なお、必要に応じ適宜減量する。
7. 用法及び用量に関連する注意
<効能共通>
7.1 本剤はイトラコナゾール内用液と生物学的に同等ではなく、イトラコナゾール内用液はバイオアベイラビリティが向上しているため、イトラコナゾール内用液から本剤への切り替えについては、イトラコナゾールの血中濃度が低下することがあるので、イトラコナゾール内用液の添加剤であるヒドロキシプロピル-β-シクロデキストリンに起因する胃腸障害(下痢、軟便等)による異常を認めた場合などを除き、原則として切り替えを行わないこと。
<爪白癬(パルス療法)>
7.2 減量時の有効率に関しては、「17.臨床成績」の項を参照のこと。
<爪カンジダ症、カンジダ性爪囲爪炎>
7.3 長期(6ヵ月程度)にわたって投与しても症状の改善が認められない場合には、本剤の投与を中止する。
8. 重要な基本的注意
<効能共通>
8.1 本剤の投与に際しては、肝疾患の既往歴、薬物過敏症、アレルギー既往歴等について十分な問診を行い、これらの現症又は既往歴のある患者については、投与中止又は慎重投与について考慮すること。[2.3、2.4、9.1.1、9.3.1、9.3.3参照]
8.2 肝障害、胆汁うっ滞、黄疸があらわれることがあるので、定期的に肝機能検査を行うことが望ましい。[11.1.2参照]
8.3 本剤投与開始にあたっては、あらかじめワルファリン服用の有無を確認し、ワルファリンと併用する場合は、プロトロンビン時間測定及びトロンボテストの回数を増やすなど慎重に投与すること。[10.2参照]
<内臓真菌症(深在性真菌症)>
8.5 イトラコナゾール注射剤から本剤400mg/日長期継続投与へ切り替えた場合、高い血中濃度が持続するので、投与期間中には、血液検査等を定期的に行うことが望ましい。
<爪白癬(パルス療法)>
8.6 本剤は投与終了後も爪甲中に長期間貯留することから、効果判定は爪の伸長期間を考慮して行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.2 うっ血性心不全又はその既往歴のある患者
うっ血性心不全の悪化又は再発を来すおそれがある。虚血性心疾患、基礎心疾患(弁膜症等)、慢性閉塞性肺疾患、腎不全、その他の浮腫性疾患等うっ血性心不全を起こすおそれのある患者に対して本剤を投与する場合には、その危険性について十分に説明するとともに、下肢浮腫、呼吸困難等の異常が認められた場合には直ちに受診するよう患者を指導すること。[11.1.1参照]
9.2 腎機能障害患者
9.2.1 腎機能障害のある患者で、コルヒチンを投与中の患者
9.2.2 腎機能障害のある患者(コルヒチンを投与中の患者を除く)
本剤及び代謝物等の排泄が遅延し、副作用があらわれやすくなるおそれがある。
9.3 肝機能障害患者
9.3.1 重篤な肝疾患の現症、既往歴のある患者
9.3.2 肝機能障害のある患者で、コルヒチンを投与中の患者
9.3.3 肝機能障害のある患者(コルヒチンを投与中の患者又は重篤な肝疾患のある患者を除く)
9.4 生殖能を有する者
妊娠する可能性のある女性には、本剤投与中及び投与終了後一定期間は、適切な避妊を行うよう指導すること。
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ヒトで母乳中へ移行することが報告されている3)。
9.7 小児等
重症な感染症例で治療上の有益性が危険性を上回ると判断される場合にのみ使用すること。
承認時までの臨床試験(効能・効果追加承認時を含む)及び再審査期間内に得られた小児に対する使用例数は65症例(1歳以上7歳未満22例、7歳以上15歳未満43例)であり、副作用は4例に下痢、低カリウム血症、AST、LDH、カリウムの上昇が認められた。
承認時までの臨床試験(効能・効果追加承認時を含む)及び再審査期間内に得られた小児に対する使用例数は65症例(1歳以上7歳未満22例、7歳以上15歳未満43例)であり、副作用は4例に下痢、低カリウム血症、AST、LDH、カリウムの上昇が認められた。
9.8 高齢者
消化器症状等副作用があらわれた場合は減量又は休薬するなど慎重に投与すること。高齢者では生理機能が低下していることが多く、副作用があらわれやすい。
10. 相互作用
相互作用序文
本剤は、主に肝チトクロームP450 3A4(CYP3A4)によって代謝される。また、本剤は、CYP3A4及びP糖蛋白に対して阻害作用を示す。他の薬剤との相互作用はすべての薬剤との組み合わせについて検討されているわけではなく、下表における併用薬剤は包括的なものではない。そのため、他剤による治療中に新たに本剤を併用したり、本剤による治療中に新たに他の薬剤を併用する場合には、併用薬剤の添付文書情報(代謝経路、相互作用経路、潜在的リスク及び併用時の具体的な対処方法等)を確認するとともに患者の状態を十分に観察し、慎重に投与すること。また、本剤投与終了後の血漿中薬物濃度は、本剤の投与量及び投与期間に応じて徐々に低下するため、本剤によって代謝が影響される薬剤の投与開始に際しては患者の状態を十分に観察し、慎重に投与すること。なお、パルス療法中の患者において休薬期間中に新たに他の薬剤を併用する場合にも、患者の状態を十分に観察し、慎重に投与すること。
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
P糖蛋白
10.1 併用禁忌
| ピモジド キニジン4)5) ベプリジル6) ベプリコール [2.1参照] | これらの薬剤の血中濃度上昇により、QT延長が発現する可能性がある。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| トリアゾラム7) ハルシオン [2.1参照] | トリアゾラムの血中濃度上昇、作用の増強、作用時間の延長があらわれることがある。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| シンバスタチン8) リポバス [2.1参照] | シンバスタチンの血中濃度上昇により、横紋筋融解症があらわれやすくなる。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| アゼルニジピン カルブロック アゼルニジピン・オルメサルタン メドキソミル レザルタス配合錠 ニソルジピン9) [2.1参照] | これらの薬剤の血中濃度を上昇させることがある。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| エルゴタミン・カフェイン・イソプロピルアンチピリン クリアミン配合錠 ジヒドロエルゴタミン エルゴメトリン メチルエルゴメトリン パルタンM [2.1参照] | これらの薬剤の血中濃度上昇により、血管攣縮等の副作用が発現するおそれがある。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| バルデナフィル レビトラ [2.1参照] | バルデナフィルのAUCが増加しCmaxが上昇するとの報告がある。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| エプレレノン10) セララ [2.1参照] | エプレレノンの血中濃度を上昇させるおそれがある。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| ブロナンセリン ロナセン [2.1参照] | ブロナンセリンの血中濃度が上昇し、作用が増強するおそれがある。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| シルデナフィル11) レバチオ [2.1参照] | シルデナフィルの血中濃度を上昇させるおそれがある(シルデナフィルとリトナビルの併用により、シルデナフィルのCmax及びAUCがそれぞれ3.9倍及び10.5倍に増加したとの報告がある)。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| タダラフィル アドシルカ [2.1参照] | タダラフィルの血中濃度を上昇させるおそれがある(タダラフィルとケトコナゾールの併用により、タダラフィルのAUC及びCmaxがそれぞれ312%及び22%増加したとの報告がある)。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| スボレキサント ベルソムラ [2.1参照] | スボレキサントの作用を著しく増強させるおそれがある。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| イブルチニブ イムブルビカ [2.1参照] | イブルチニブの血中濃度が上昇し、副作用が増強されるおそれがある。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| チカグレロル ブリリンタ [2.1参照] | チカグレロルの血中濃度が上昇し、出血の危険性が増大するおそれがある。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| ロミタピド ジャクスタピッド [2.1参照] | ロミタピドの血中濃度が著しく上昇するおそれがある。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| イバブラジン コララン [2.1参照] | イバブラジンの血中濃度が上昇し、過度の徐脈があらわれることがある。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| ベネトクラクス(再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)の用量漸増期) ベネクレクスタ [2.1参照] | ベネトクラクスの血中濃度が上昇し、腫瘍崩壊症候群の発現が増強する可能性がある。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| ルラシドン塩酸塩 ラツーダ [2.1参照] | ルラシドン塩酸塩の血中濃度が上昇し、作用が増強するおそれがある。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| アナモレリン塩酸塩 エドルミズ [2.1参照] | アナモレリン塩酸塩の血中濃度が上昇し、副作用の発現が増強するおそれがある。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| フィネレノン ケレンディア [2.1参照] | フィネレノンの血中濃度が著しく上昇するおそれがある。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| ボクロスポリン ルプキネス [2.1参照] | ボクロスポリンの血中濃度が上昇し、作用が増強するおそれがある。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| イサブコナゾニウム硫酸塩 クレセンバ [2.1参照] | イサブコナゾールの血中濃度が上昇し、作用が増強するおそれがある。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| アリスキレン12) ラジレス [2.1参照] | イトラコナゾールカプセルの併用投与(空腹時)により、アリスキレンのCmax及びAUCがそれぞれ約5.8倍及び約6.5倍に上昇したとの報告がある。 | 本剤のP糖蛋白阻害作用により、アリスキレンの排泄が阻害されると考えられる。 |
| ダビガトラン プラザキサ [2.1参照] | ダビガトランの血中濃度が上昇し、出血の危険性が増大することがある。 | 本剤のP糖蛋白阻害作用により、ダビガトランの排泄が阻害されると考えられる。 |
| リバーロキサバン イグザレルト [2.1参照] | リバーロキサバンの血中濃度が上昇し、出血の危険性が増大するおそれがある(リバーロキサバンとケトコナゾールの併用により、リバーロキサバンのAUC及びCmaxがそれぞれ158%及び72%増加したとの報告がある)。 | 本剤のCYP3A4及びP糖蛋白阻害作用により、リバーロキサバンの代謝及び排泄が阻害され、抗凝固作用が増強されると考えられる。 |
10.2 併用注意
| アトルバスタチン13) | アトルバスタチンの血中濃度を上昇させることがあり、横紋筋融解症があらわれやすくなる。必要に応じてアトルバスタチンの投与量を減量するなど用量に注意すること。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| ビンカアルカロイド系抗悪性腫瘍剤 ビンクリスチン14) ビンブラスチン等 | これらの薬剤の血中濃度を上昇させることがあり、ビンカアルカロイド系抗悪性腫瘍剤の副作用が増強されることがある。必要に応じてこれらの薬剤の投与量を減量するなど用量に注意すること。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| メチルプレドニゾロン15) デキサメタゾン16) ブデソニド17) | これらの薬剤の血中濃度を上昇させることがあり、これらの薬剤の副作用が増強されることがある。必要に応じてこれらの薬剤の投与量を減量するなど用量に注意すること。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| コルヒチン [2.2、9.2.1、9.3.2参照] | コルヒチンの血中濃度を上昇させることがあり、コルヒチンの作用が増強されることがある。必要に応じてコルヒチンの投与量を減量するなど用量に注意すること。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| ジソピラミド | ジソピラミドの血中濃度上昇により、QT延長が発現する可能性がある。必要に応じてジソピラミドの投与量を減量するなど用量に注意すること。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| ベンゾジアゼピン系薬剤 ミダゾラム18) ブロチゾラム アルプラゾラム19) | これらの薬剤の血中濃度を上昇させることがある。必要に応じてこれらの薬剤の投与量を減量するなど用量に注意すること。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| 抗精神病薬 ハロペリドール アリピプラゾール20) ペロスピロン21) クエチアピン | これらの薬剤の血中濃度を上昇させることがある。必要に応じてこれらの薬剤の投与量を減量するなど用量に注意すること。 ・本剤とアリピプラゾールの併用により、アリピプラゾールのCmax、AUC、t1/2がそれぞれ19.4%、48.0%、18.6%増加したとの報告がある。 ・本剤とペロスピロンの併用により、ペロスピロンのCmax及びAUCがそれぞれ5.7倍及び6.8倍増加したとの報告がある。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| 免疫抑制剤 シクロスポリン タクロリムス水和物22) | これらの薬剤の血中濃度を上昇させることがある。必要に応じてこれらの薬剤の投与量を減量するなど用量に注意すること。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| 抗悪性腫瘍剤 ドセタキセル水和物23) エベロリムス テムシロリムス ゲフィチニブ ダサチニブ エルロチニブ ラパチニブ ボルテゾミブ イマチニブ スニチニブ ボスチニブ カバジタキセル セリチニブ クリゾチニブ シロリムス(錠) パノビノスタット ポナチニブ ルキソリチニブ アパルタミド トレチノイン(カプセル) ペミガチニブ エヌトレクチニブ | これらの薬剤の血中濃度を上昇させることがある。必要に応じてこれらの薬剤の投与量を減量するなど用量に注意すること。 ・クリゾチニブ反復投与時に本剤を併用投与したとき、クリゾチニブの定常状態におけるAUCtau及びCmaxは単独投与と比べそれぞれ57%及び33%増加した。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| オピオイド系鎮痛剤 フェンタニル オキシコドン24) メサドン | これらの薬剤の血中濃度を上昇させることがある。必要に応じてこれらの薬剤の投与量を減量するなど用量に注意すること。 ・本剤とオキシコドンの併用により、オキシコドンのクリアランスが32%減少し、AUCが51%増加したとの報告がある(オキシコドン注射剤)。また、オキシコドンのAUCが144%上昇したとの報告がある(オキシコドン経口剤)。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| ブプレノルフィン セレギリン25) ガランタミン トルバプタン エレトリプタン サルメテロール シクレソニド フルチカゾン アプレピタント イミダフェナシン26) ソリフェナシン トルテロジン シロスタゾール シナカルセト エバスチン ダルナビル マラビロク オキシブチニン ドンペリドン シロドシン キニーネ ゾピクロン グアンファシン ジエノゲスト | これらの薬剤の血中濃度を上昇させることがある。必要に応じてこれらの薬剤の投与量を減量するなど用量に注意すること。 ・トルバプタンとの併用が避けられない場合は、トルバプタンの減量あるいは、低用量から開始するなど用量に注意すること。 ・本剤とイミダフェナシンの併用により、イミダフェナシンのCmax及びAUCがそれぞれ1.32倍及び1.78倍増加したとの報告がある。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| シルデナフィル バイアグラ | シルデナフィルとエリスロマイシンの併用によりシルデナフィルのCmax、AUCの増加が認められたとの報告がある。必要に応じてシルデナフィルの投与量を減量するなど用量に注意すること。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| タダラフィル シアリス ザルティア | タダラフィルの血中濃度を上昇させるおそれがある(タダラフィルとケトコナゾールの併用により、タダラフィルのAUC及びCmaxがそれぞれ312%及び22%増加したとの報告がある)。必要に応じてタダラフィルの投与量を減量するなど用量に注意すること。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| ワルファリン27) [8.3参照] | ワルファリンの作用が増強し、著しいINR上昇があらわれることがある。必要に応じてワルファリンの投与量を減量するなど用量に注意すること。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| アキシチニブ | アキシチニブの血中濃度が上昇し、副作用の発現頻度及び重症度が増加するおそれがある。やむを得ず併用する際にはアキシチニブの減量を考慮するとともに、患者の状態を慎重に観察し、副作用発現に十分注意すること。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| フェソテロジン | 活性代謝物5-HMTの血漿中濃度の上昇に伴い効果や副作用の増強が予想される。必要に応じてフェソテロジンの投与量を減量するなど用量に注意すること。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| ボセンタン | ボセンタンの血中濃度が上昇し、ボセンタンの副作用が発現しやすくなるおそれがある。必要に応じてボセンタンの投与量を減量するなど用量に注意すること。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| アルテメテル・ルメファントリン | アルテメテル及びルメファントリンの血中濃度が上昇し、QT延長が起こるおそれがある。必要に応じてアルテメテル・ルメファントリンの投与量を減量するなど用量に注意すること。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| デソゲストレル・エチニルエストラジオール | これらの薬剤の血中濃度を上昇させることがある。必要に応じてデソゲストレル・エチニルエストラジオールの投与量を減量するなど用量に注意すること。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| ベネトクラクス(再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)の維持投与期、急性骨髄性白血病) | ベネトクラクスの血中濃度が上昇し、副作用が増強する可能性があるので、ベネトクラクスを減量するとともに患者の状態を慎重に観察すること。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。 |
| ジヒドロピリジン系Ca拮抗剤 ニフェジピン28) ニルバジピン フェロジピン29)等 ベラパミル30) | これらの薬剤の血中濃度を上昇させることがある。また、心機能が低下する可能性がある。必要に応じてこれらの薬剤の投与量を減量するなど用量に注意すること。 | 本剤のCYP3A4に対する阻害作用により、これらの薬剤の代謝が阻害される。また、両剤の心抑制作用が増強する可能性がある。 |
| イリノテカン | イリノテカンの活性代謝物の血中濃度が上昇することがある。必要に応じてイリノテカンの投与量を減量するなど用量に注意すること。 | 本剤のCYP3A4阻害作用により、イリノテカンの活性代謝物の無毒化が阻害されると考えられる。 |
| バルベナジン | バルベナジン及び活性代謝物の血漿中濃度が上昇するおそれがある。バルベナジンの作用が増強することで副作用があらわれるおそれがあるため、観察を十分に行うこと。本剤を併用する場合にはバルベナジンの増量はしないこと。 | 本剤のCYP3A阻害作用により、バルベナジン及び活性代謝物の代謝が阻害されると考えられる。 |
| ニロチニブ | ニロチニブの血中濃度が上昇し、QT延長があらわれることがある。必要に応じてニロチニブの投与量を減量するなど用量に注意すること。 | 本剤のCYP3A4及びP糖蛋白阻害作用により、ニロチニブの代謝及び排泄が阻害されると考えられる。 |
| アピキサバン | アピキサバンの血中濃度を上昇させることがある。必要に応じてアピキサバンの投与量を減量するなど用量に注意すること。 | 本剤のCYP3A4及びP糖蛋白阻害作用により、アピキサバンの代謝及び排泄が阻害されると考えられる。 |
| エドキサバン | エドキサバンの血中濃度を上昇させ、出血の危険性を増大させるおそれがある。必要に応じてエドキサバンの投与量を減量するなど用量に注意すること。 | 本剤のP糖蛋白阻害作用により、エドキサバンのバイオアベイラビリティを上昇させると考えられる。 |
| タラゾパリブ | タラゾパリブの副作用が増強されるおそれがあるので、本剤との併用は可能な限り避けること。やむを得ず併用する場合には、患者の状態を慎重に観察し、副作用の発現に十分注意すること。 | 本剤のP糖蛋白阻害作用により、タラゾパリブの血中濃度が上昇する可能性がある。 |
| ジゴキシン31) ブスルファン32) | これらの薬剤の血中濃度を上昇させることがある。 本剤とブスルファンの併用により、ブスルファンのクリアランスが20%減少したとの報告がある。必要に応じてこれらの薬剤の投与量を減量するなど用量に注意すること。 | 機序不明 |
| ロペラミド | ロペラミドの血中濃度が上昇することがある。必要に応じてロペラミドの投与量を減量するなど用量に注意すること。 | 本剤のCYP3A4及びP糖蛋白阻害作用により、ロペラミドの代謝及び排泄が阻害されると考えられる。 |
| クラリスロマイシン33) リトナビル ホスアンプレナビル/リトナビル エリスロマイシン シプロフロキサシン34) | 本剤の血中濃度が上昇することがある。 本剤とシプロフロキサシンの併用により、イトラコナゾールのCmax及びAUCがそれぞれ53.13%及び82.46%増加したとの報告がある。必要に応じて本剤の投与量を減量するなど用量に注意すること。 | これらの薬剤のCYP3A4に対する阻害作用により、本剤の代謝が阻害される。 |
| ダルナビル/リトナビル | 本剤又はダルナビルの血中濃度が上昇する可能性がある(ダルナビル/リトナビルとケトコナゾールの併用により、ダルナビルとケトコナゾールの血中濃度の上昇が認められたとの報告がある)。必要に応じて本剤又はこれらの薬剤の投与量を調節するなど用量に注意すること。 | 本剤及びこれらの薬剤のCYP3A4に対する阻害作用により、血中濃度の変化が起こる場合がある。 |
| エルビテグラビル・コビシスタット・エムトリシタビン・テノホビル アラフェナミドフマル酸塩 エルビテグラビル・コビシスタット・エムトリシタビン・テノホビル ジソプロキシルフマル酸塩 | 本剤、エルビテグラビル及びコビシスタットの血中濃度が上昇する可能性がある。必要に応じて本剤又はこれらの薬剤の投与量を調節するなど用量に注意すること。 | 本剤及びコビシスタットのCYP3A等阻害作用により、相互に代謝が阻害される。 |
| ダルナビル エタノール付加物・コビシスタット | 本剤、ダルナビル又はコビシスタットの血中濃度が上昇する可能性がある。必要に応じて本剤又はダルナビル エタノール付加物・コビシスタットの投与量を調節するなど用量に注意すること。 | 本剤とダルナビル及びコビシスタットのCYP3A阻害作用により、相互に代謝が阻害される。 |
| ダルナビル エタノール付加物・コビシスタット・エムトリシタビン・テノホビル アラフェナミドフマル酸塩 | 本剤、ダルナビル、コビシスタット又はテノホビル アラフェナミドの血中濃度が上昇する可能性がある。必要に応じて本剤又はダルナビル エタノール付加物・コビシスタット・エムトリシタビン・テノホビル アラフェナミドフマル酸塩の投与量を調節するなど用量に注意すること。 | 本剤とダルナビル、コビシスタット及びテノホビル アラフェナミドのCYP3A及びP糖蛋白阻害作用により、相互に代謝が阻害される。 |
| カルバマゼピン35)36) エトラビリン リファブチン | 本剤の血中濃度が低下することがある。また、これらの薬剤の血中濃度が上昇する可能性がある。必要に応じて本剤又はこれらの薬剤の投与量を調節するなど用量に注意すること。 | これらの薬剤の肝薬物代謝酵素誘導により、本剤の肝代謝が促進される。また、本剤のCYP3A4に対する阻害作用によりこれらの薬剤の代謝が阻害される。 |
| リファンピシン フェニトイン イソニアジド37) フェノバルビタール エファビレンツ ネビラピン38) | 本剤の血中濃度が低下することがある。 本剤とネビラピンの併用により、本剤のCmax、AUC及びt1/2がそれぞれ38%、61%及び31%減少したとの報告がある。必要に応じて本剤の投与量、両剤の投与間隔を調節するなど注意すること。 | これらの薬剤の肝薬物代謝酵素誘導により、本剤の肝代謝が促進される。 |
| H2遮断薬 ファモチジン等 | 本剤の血中濃度が低下することがある。併用する場合には両剤の投与間隔をできる限り空けるなど慎重に投与すること。 | 酸分泌量低下のため本剤の消化管での溶解性が低下し、吸収が低下することがある。 |
| プロトンポンプ阻害剤 オメプラゾール39) ランソプラゾール ラベプラゾール エソメプラゾール ボノプラザンフマル酸塩 | 本剤の血中濃度が低下することがある。必要に応じて本剤の投与量、両剤の投与間隔を調節するなど注意すること。 | 酸分泌量低下のため本剤の消化管での溶解性が低下し、吸収が低下することがある。 |
| 制酸剤40) 乾燥水酸化アルミニウムゲル 乾燥水酸化アルミニウムゲル・水酸化マグネシウム等 | 本剤と制酸剤の併用により、本剤のCmax及びAUCがそれぞれ70%及び66%減少したとの報告がある。必要に応じて本剤の投与量、両剤の投与間隔を調節するなど注意すること。 | 酸分泌量低下のため本剤の消化管での溶解性が低下し、吸収が低下することがある。 |
| メロキシカム41) | 本剤とメロキシカムの併用により、メロキシカムのCmax及びAUCがそれぞれ64%及び37%減少したとの報告がある。必要に応じてメロキシカムの投与量を調節するなど用量に注意すること。 | 本剤がメロキシカムの消化管からの吸収を抑制すると考えられる。 |
| リオシグアト | リオシグアトの血中濃度を上昇させるおそれがある(リオシグアトとケトコナゾールの併用により、リオシグアトのAUC及びCmaxがそれぞれ150%及び46%増加、また、消失半減期が延長したとの報告がある)。本剤との併用が必要な場合は、患者の状態に注意し、必要に応じてリオシグアトの減量を考慮すること。 | 本剤のCYP1A1及びCYP3A4阻害作用により、リオシグアトのクリアランスが低下することが考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 うっ血性心不全(頻度不明)、肺水腫(頻度不明)
下肢浮腫、呼吸困難等の症状に注意すること。[9.1.2参照]
11.1.2 肝障害(0.25%)、胆汁うっ滞(頻度不明)、黄疸(0.1%未満)
11.1.3 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)(頻度不明)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(0.1%未満)、急性汎発性発疹性膿疱症(頻度不明)、剥脱性皮膚炎(頻度不明)、多形紅斑(頻度不明)
11.1.4 ショック(頻度不明)、アナフィラキシー(頻度不明)
チアノーゼ、冷汗、血圧低下、呼吸困難、胸内苦悶等があらわれた場合には投与を中止し、適切な処置を行うこと。
11.1.5 間質性肺炎(頻度不明)
咳嗽、呼吸困難、発熱、肺音の異常(捻髪音)等が認められた場合には、速やかに胸部X線、胸部CT、血清マーカー等の検査を実施し、本剤の投与を中止するとともに、適切な処置を行うこと。
11.1.6 低カリウム血症(0.1%未満)[8.4参照]
11.1.7 偽アルドステロン症(頻度不明)
低カリウム血症、血圧上昇、ナトリウム・体液の貯留、浮腫、体重増加等があらわれることがある。[8.4参照]
発現頻度は、内臓真菌症に対する臨床試験(注射剤を最大2週間投与後、本剤を最大12週間投与)での安全性評価対象例51例(うちカプセル剤継続投与36例)及び使用成績調査を含む。
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 感染症 | 鼻炎 | ||
| 過敏症 | 血管浮腫 | ||
| 循環器 | 不整脈 | 心室性期外収縮、房室ブロック、動悸、狭心症発作、徐脈、心電図異常、血管障害、血圧上昇、頻脈、高血圧、低血圧 | |
| 消化器 | 腹痛、嘔気、便秘、下痢、嘔吐、消化不良、食欲不振、鼓腸放屁 | おくび、舌炎、口内炎、腹部腰背部痛 | 軟便、腹部不快感、口腔内痛、歯周炎、胃炎、胃十二指腸潰瘍 |
| 肝臓 | 肝機能異常、AST増加、ALT増加、LDH増加、γ-GTP増加、ALP増加 | 血中ビリルビン増加、LAP増加 | |
| 呼吸器 | 咽喉頭疼痛、呼吸困難、咳嗽 | ||
| 皮膚 | 発疹、そう痒症 | 紅斑性発疹、脱毛、蕁麻疹、光線過敏性反応 | 白血球破砕性血管炎、湿疹、皮膚乾燥、皮膚腫脹 |
| 精神神経系 | 倦怠感 | 肩こり、不眠、めまい、頭痛、末梢神経障害 | 眠気、錯感覚、感覚鈍麻、不安、傾眠、発声障害、錯乱状態、振戦 |
| 腎臓 | BUNの上昇 | 尿蛋白及び尿糖の陽性、腎障害 | 頻尿、尿失禁、血尿、尿検査異常、尿円柱、尿量減少、腎機能検査値異常注)、腎尿細管障害 |
| 血液 | 好酸球増多、白血球減少、血小板減少 | 貧血 | 白血球増多、顆粒球減少、好中球減少 |
| 生殖器 | 月経異常、勃起不全 | ||
| その他 | 浮腫 | 発熱、ほてり、味覚異常、耳鳴、難聴 | 胸痛、血清病、視覚障害(霧視、複視を含む)、筋痛、関節痛、悪寒、異常感、無力症、腫脹、自傷、体重増加、高血糖、多汗症、顔面浮腫 |
| 臨床検査 | トリグリセライドの上昇 | 血清尿酸上昇、血清カリウムの上昇、血中アミラーゼ増加、総蛋白増加、総コレステロール増加 | 血中リン増加、血中コレステロール減少、血中ナトリウム減少、CRP増加、CK増加 |
13. 過量投与
本剤は血液透析によって除去できない。
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.1.2 服用直前までPTPシートから取り出さないよう指導すること。
15. その他の注意
15.1 臨床使用に基づく情報
類似化合物(ミコナゾール)では血糖降下剤との併用により、著しい血糖低下が認められたとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人に本剤50〜200mgを経口投与したとき、速やかに吸収され、血漿中未変化体濃度は投与後約4〜5時間で最高値に達し、その後二相性で消失し、β相の消失半減期は約14〜28時間であった。主活性代謝物ヒドロキシイトラコナゾールの血漿中濃度は投与後約4〜6時間で最高値に達した後、約10〜21時間の消失半減期で消失した。42)
健康成人(n=5)に本剤を単回経口投与したときの血漿中濃度推移
| 用量(mg) | 対象 | Cmax(ng/mL) | Tmax(hr) | AUC(ng・hr/mL) | t1/2(hr) |
| 50 | 未変化体 | 37.0±14.9 | 4.4±0.9 | 456±184 | 13.8±7.0 |
| 主活性代謝物 | 146.2±43.8 | 4.4±0.9 | 1,819±612 | 21.3±36.0 | |
| 100 | 未変化体 | 132.2±80.7 | 4.8±1.8 | 2,221±1,141 | 24.9±7.7 |
| 主活性代謝物 | 267.4±71.4 | 6.0±1.4 | 6,772±3,221 | 17.4±11.2 | |
| 200 | 未変化体 | 215.6±58.1 | 4.4±0.9 | 4,142±1,272 | 27.9±9.9 |
| 主活性代謝物 | 678.6±62.4 | 5.2±1.8 | 15,028±2,524 | 9.5±2.1 |
16.1.2 反復投与
健康成人に本剤1回200mgを1日2回、15日間反復経口投与したときの血漿中未変化体及びヒドロキシイトラコナゾールのトラフ時の濃度は徐々に上昇し、投与12日目(288時間目)にはほぼ定常状態に達した。t1/2は31.0時間及び22.2時間であった。43)
健康成人(n=12)に本剤1回200mgを1日2回反復経口投与したときの血漿中濃度推移
16.2 吸収
16.2.1 食事による影響
本剤を空腹時に投与したとき、食直後投与時の最高血漿中濃度の約40%であり、ヒドロキシイトラコナゾールも同様の傾向が認められ、食直後投与によってイトラコナゾールの生物学的利用率が向上した42)。
16.3 分布
16.3.1 体組織への分布
患者・健康成人のデータでは、イトラコナゾール100mg経口投与後の肺、腎、肝、皮膚等の組織内未変化体濃度は血漿中濃度よりも高かった。また、皮膚組織内未変化体濃度は、最終投与後1週間は治療濃度域であった。44)(外国人データ)
16.3.2 乳汁移行性
健康女性のデータでは、授乳婦にイトラコナゾール1回200mgを1日2回経口投与したとき、乳汁中に未変化体が検出された3)。(外国人データ)
16.3.3 血漿蛋白結合率
99.8%(in vitro、平衡透析法、0.5μg/mL)45)
16.4 代謝
ヒトにイトラコナゾールを経口投与したとき、肝臓で主に代謝され、主な代謝物はヒドロキシイトラコナゾールである。
初回通過効果の有無及びその割合
あり(割合は不明)
代謝物の活性の有無
ヒドロキシイトラコナゾール(主活性代謝物)は、未変化体と比較してほぼ同等の抗真菌活性を示す46)。
代謝酵素(チトクロームP450)の分子種
CYP3A4
16.5 排泄
健康成人に3H-イトラコナゾール100mg経口投与したとき、投与7日間以内に放射活性の54.1%が糞中に、35.2%が尿中に排泄された44)。(外国人データ)
17. 臨床成績
17.1 有効性及び安全性に関する試験
<内臓真菌症(深在性真菌症)、深在性皮膚真菌症、表在性皮膚真菌症(爪白癬以外)>
17.1.1 国内臨床試験
二重盲検比較試験を含む総計782例における臨床試験の概要は以下のとおりであった47)48)49)50)51)52)53)54)55)56)。
| 疾患名 | 臨床効果 | (有効率) | |
| 内臓真菌症 | |||
| カンジダ血症 | 5/6 | (83.3%) | |
| 肺カンジダ症 | 5/5 | (100.0%) | |
| 食道カンジダ症 | 11/13 | (84.6%) | |
| 尿路カンジダ症 | 7/7 | (100.0%) | |
| 肺アスペルギルス症 | 8/9 | (88.9%) | |
| 肺アスペルギローマ | 17/30 | (56.7%) | |
| クリプトコックス髄膜炎 | 1/2 | (50.0%) | |
| 肺クリプトコックス症 | 1/1 | (100.0%) | |
| 深在性皮膚真菌症 | |||
| スポロトリコーシス | 28/32 | (87.5%) | |
| クロモミコーシス | 6/10 | (60.0%) | |
| 表在性皮膚真菌症 | |||
| 体部白癬 | 112/125 | (89.6%) | |
| 股部白癬 | 51/57 | (89.5%) | |
| 手白癬 | 23/23 | (100.0%) | |
| 足白癬 | 202/250 | (80.8%) | |
| 頭部白癬 | 11/11 | (100.0%) | |
| ケルスス禿瘡 | 15/17 | (88.2%) | |
| 白癬性毛瘡 | 8/8 | (100.0%) | |
| 口腔カンジダ症 | 26/29 | (89.7%) | |
| 皮膚カンジダ症 | 44/46 | (95.7%) | |
| 爪カンジダ症 | 28/32 | (87.5%) | |
| カンジダ性爪囲爪炎 | 18/20 | (90.0%) | |
| カンジダ性毛瘡 | 4/5 | (80.0%) | |
| 慢性皮膚粘膜カンジダ症 | 5/6 | (83.3%) | |
| 癜風 | 25/28 | (89.3%) | |
| マラセチア毛包炎 | 10/10 | (100.0%) | |
| 原因菌 | 真菌学的効果 | (菌陰性化率) |
| Candida albicans | 107/115 | (93.0%) |
| C.glabrata | 3/4 | (75.0%) |
| C.parapsilosis | 5/5 | (100.0%) |
| Aspergillus fumigatus | 14/16 | (87.5%) |
| A.niger | 2/2 | (100.0%) |
| Cryptococcus neoformans | 2/4 | (50.0%) |
| Sporothrix schenckii | 27/31 | (87.1%) |
| Fonsecaea pedrosoi | 5/7 | (71.4%) |
| Trichophyton rubrum | 266/301 | (88.4%) |
| T.mentagrophytes | 54/61 | (88.5%) |
| Microsporum canis | 20/21 | (95.2%) |
| M.gypseum | 3/3 | (100.0%) |
| Epidermophyton floccosum | 3/3 | (100.0%) |
| Malassezia furfur | 31/34 | (91.2%) |
<爪白癬(パルス療法)>
17.1.2 国内第II/III相試験(R051211-CP-JPN-01)
爪白癬患者を対象とし、パルス療法(400mg/日3サイクル投与、200mg/日6サイクル投与、200mg/日3サイクル投与)を行った際の有効率は、それぞれ84.6%(44/52)、66.7%(34/51)、63.8%(30/47)であり、400mg/日3サイクル投与時の主要原因菌であるTrichophyton rubrumの真菌学的効果(菌陰性化率)は62.5%(15/24)であった57)。
安全性解析集団185例中、副作用(臨床検査値異常変動を含む)は25例(13.51%)62件に認められた。その主なものはALT増加9件(4.86%)、AST増加、γ-GTP増加各8件(4.32%)、Al-P増加、LDH増加各3件(1.62%)、腹痛、ビリルビン値増加、鼓腸放屁各2件(1.08%)等であった。
安全性解析集団185例中、副作用(臨床検査値異常変動を含む)は25例(13.51%)62件に認められた。その主なものはALT増加9件(4.86%)、AST増加、γ-GTP増加各8件(4.32%)、Al-P増加、LDH増加各3件(1.62%)、腹痛、ビリルビン値増加、鼓腸放屁各2件(1.08%)等であった。
18. 薬効薬理
18.1 作用機序
真菌のチトクロームP450に特異的に作用して、真菌の細胞膜の主要構成脂質であるエルゴステロールの生合成を阻害する。イトラコナゾールは哺乳類由来のチトクロームP450には影響が少なかった。58)
18.2 抗真菌作用
19. 有効成分に関する理化学的知見
19.1. イトラコナゾール
20. 取扱い上の注意
小児の手の届かない所に保管すること。
22. 包装
56カプセル[8カプセル(PTP)×7]
100カプセル[10カプセル(PTP)×10]
23. 主要文献
- 社内資料:イトラコナゾールの催奇形性試験(ラット)(イトリゾール内用液2006年7月26日承認、CTD2.6.6.6)
- 社内資料:イトラコナゾールの催奇形性試験(マウス)
- 社内資料:イトラコナゾールのヒト乳汁中への排泄(イトリゾール内用液2006年7月26日承認、CTD2.6.4.6)
- Cruccu V,et al., Clin Ter., 146, 383-389, (1995) »PubMed
- Kaukonen KM,et al., Clin Pharmacol Ther., 62, 510-517, (1997) »PubMed
- Gopaul VS,et al., Drug Metab Rev., 36 (Suppl.1), 208, (2004)
- Varhe A,et al., Clin Pharmacol Ther., 56, 601-607, (1994) »PubMed
- Horn M, Arch Dermatol., 132, 1254, (1996) »PubMed
- Heinig R,et al., Eur J Clin Pharmacol., 55, 57-60, (1999) »PubMed
- Cook CS,et al., Xenobiotica., 34, 215-228, (2004) »PubMed
- Muirhead GJ,et al., Br J Clin Pharmacol., 50, 99-107, (2000) »PubMed
- Tapaninen T,et al., J Clin Pharmacol., 51, 359-367, (2011) »PubMed
- Kantola T,et al., Clin Pharmacol Ther., 64, 58-65, (1998) »PubMed
- Boehme A,et al., Onkologie., 17 (Suppl.2), 13, (1994)
- Linthoudt H,et al., J Heart Lung Transplant., 15, 1165, (1996) »PubMed
- Varis T,et al., Clin Pharmacol Ther., 68, 487-494, (2000) »PubMed
- Raaska K,et al., Clin Pharmacol Ther., 72, 362-369, (2002) »PubMed
- Olkkola K,et al., Clin Pharmacol Ther., 55, 481-485, (1994) »PubMed
- Yasui N,et al., Psychopharmacology., 139, 269-273, (1998) »PubMed
- Kubo M,et al., Drug Metab Pharmacokinet., 20, 55-64, (2005) »PubMed
- Masui T,et al., Ther Drug Monit., 28, 73-75, (2006) »PubMed
- Furlan V,et al., Pharm Hosp Fr., 14-16, (1997)
- Royer I,et al., Cancer Res., 56, 58-65, (1996) »PubMed
- Saari TI,et al., Eur J Clin Pharmacol., 66, 387-397, (2010) »PubMed
- Wacher VJ,et al., 7th North American ISSX Meeting., 10, 351, (1996)
- Ohno T,et al., J Clin Pharmacol., 48, 330-334, (2008) »PubMed
- Yeh J,et al., Br Med J., 301, 669, (1990)
- Tailor S,et al., Arch Dermatol., 132, 350-352, (1996) »PubMed
- Neuvonen P,et al., J Am Acad Dermatol., 33, 134-135, (1995) »PubMed
- Kroemer HK,et al., Arch Pharmacol., 348, 332-337, (1993)
- Sachs M,et al., Clin Infect Dis., 16, 400-403, (1993) »PubMed
- Buggia I,et al., Anticancer Res., 16, 2083-2088, (1996) »PubMed
- Hardin TC,et al., Pharmacother., 17, 195, (1997)
- Sriwiriyajan S,et al., Biopharm Drug Dispos., 32, 168-174, (2011) »PubMed
- Bonay M,et al., Drug Safety., 9, 309-311, (1993) »PubMed
- Spina E,et al., Ther Drug Monit., 19, 535-538, (1997) »PubMed
- Pilheu JA,et al., Medicina., 49, 43-47, (1989) »PubMed
- Jaruratanasirikul S,et al., Eur J Clin Pharmacol., 63, 451-456, (2007) »PubMed
- Jaruratanasirikul S,et al., Eur J Clin Pharmacol., 54, 159-161, (1998) »PubMed
- Lohitnavy M,et al., J Clin Pharm Ther., 30, 201-206, (2005) »PubMed
- Hynninen VV,et al., Antimicrob Agents Chemother., 53, 587-592, (2009) »PubMed
- 小口勝司,他, 基礎と臨床, 25, 397-407, (1991)
- 社内資料:イトラコナゾールカプセルの第I相試験
- Heykants J,et al., Recent Trends in the Discovery,Development and Evaluation of Antifungal Agents., 223-249, (1987)
- 社内資料:イトラコナゾールの蛋白結合率の検討(イトリゾール内用液2006年7月26日承認、CTD2.6.4.4)
- 三上 襄,他, Chemotherapy., 42, 290-296, (1994) »DOI
- Itraconazole皮膚科領域研究班, 基礎と臨床, 25, 409-421, (1991)
- Itraconazole皮膚科領域研究班, 基礎と臨床, 25, 423-432, (1991)
- Itraconazole皮膚科領域研究班, 基礎と臨床, 25, 433-448, (1991)
- Itraconazole皮膚科領域研究班, 基礎と臨床, 25, 449-462, (1991)
- Itraconazole皮膚科領域研究班, 基礎と臨床, 25, 463-477, (1991)
- Itraconazole皮膚科領域研究班, 基礎と臨床, 25, 479-496, (1991)
- Itraconazole内科領域研究班, 基礎と臨床, 25, 585-616, (1991)
- Itraconazole内科領域研究班, 基礎と臨床, 25, 618-625, (1991)
- Itraconazole皮膚科領域研究班, 西日本皮膚科, 58, 865-875, (1996) »DOI
- 松本忠彦,他, 西日本皮膚科, 58, 887-895, (1996) »DOI
- 渡辺晋一,他, 日本皮膚科学会雑誌, 114, 55-72, (2004) »DOI
- Vanden Bossche H,et al., Mycoses., 32 (Suppl.1), 35-52, (1989)
- 平谷民雄,他, Jpn J Antibiotics., 44, 581-587, (1991)
- 内田勝久,他, Jpn J Antibiotics., 44, 562-570, (1991) »DOI
- 内田勝久,他, Jpn J Antibiotics., 44, 571-579, (1991) »DOI
- Van Cutsem J, Mycoses., 32 (Suppl.1), 7-13, (1989)
- 内田勝久,他, Jpn J Antibiotics., 44, 588-599, (1991) »DOI
- Van Cutsem J,et al., Rev Infect Dis., 9 (Suppl.1), 15-32, (1987)
- Van Cutsem J, Mycoses., 32 (Suppl.1), 14-34, (1989)
24. 文献請求先及び問い合わせ先
文献請求先
ヤンセンファーマ株式会社
メディカルインフォメーションセンター
〒101-0065
東京都千代田区西神田3-5-2
電話:フリーダイヤル 0120-183-275
製品情報問い合わせ先
ヤンセンファーマ株式会社
メディカルインフォメーションセンター
〒101-0065
東京都千代田区西神田3-5-2
電話:フリーダイヤル 0120-183-275
26. 製造販売業者等
26.1 製造販売元(輸入)
ヤンセンファーマ株式会社
〒101-0065
東京都千代田区西神田3-5-2