医薬品情報
| 総称名 | セルベックス |
|---|---|
| 一般名 | テプレノン |
| 欧文一般名 | Teprenone |
| 製剤名 | テプレノン製剤・テプレノンカプセル |
| 薬効分類名 | 胃炎・胃潰瘍治療剤 |
| 薬効分類番号 | 2329 |
| ATCコード | A02BX15 |
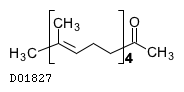
| KEGG DRUG |
D01827
テプレノン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年12月 改訂(第2版)

|
4.効能または効果 6.用法及び用量 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| セルベックス細粒10% | Selbex fine granules | エーザイ | 2329012C1026 | 9.2円/g | |
| セルベックスカプセル50mg | Selbex capsules | エーザイ | 2329012M1021 | 9.9円/カプセル |
4. 効能または効果
6. 用法及び用量
セルベックス細粒10%
細粒10%
通常成人、細粒1.5g(テプレノンとして150mg)を1日3回に分けて食後に経口投与する。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
セルベックスカプセル50mg
カプセル50mg
通常成人、3カプセル(テプレノンとして150mg)を1日3回に分けて食後に経口投与する。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。妊娠中の投与を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
一般に、生理機能が低下していることが多い。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には、投与を中止するなど適切な処置を行うこと。
11.1.1 肝機能障害、黄疸(いずれも頻度不明)
AST、ALT、γ-GTP、Al-Pの上昇等を伴う肝機能障害、黄疸があらわれることがある。
注)発現頻度は製造販売後調査を含む。
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 消化器 | 便秘、下痢、嘔気、口渇、腹痛、腹部膨満感 | ||
| 肝臓 | AST、ALTの上昇 | ||
| 精神神経系 | 頭痛 | ||
| 過敏症 | 発疹、そう痒感 | ||
| その他 | 総コレステロールの上昇、眼瞼の発赤・熱感 | 血小板減少 |
14. 適用上の注意
14.1 薬剤調製時の注意
細粒剤は、合成ケイ酸アルミニウムとの配合により、次第に黄変し、含量が低下するので配合しないこと。
14.2 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
健康成人男子12名に本剤3カプセル、又は細粒1.5g(テプレノンとして150mg注))をクロスオーバー法で食後単回経口投与したときのテプレノン平均血清中濃度推移を下図に示した。また、カプセル及び細粒投与時における最高血清中濃度(Cmax)、血清中濃度−時間曲線下面積(AUC0-32)を以下に示した。なお、両剤形のCmax及びAUC0-32に有意な差は認められなかった。
テプレノン150mg注)の単回経口投与時の平均血清中濃度
| 剤形 | AUC0-32(μg・hr/mL) | Cmax(μg/mL) |
| カプセル50mg(3カプセル) | 7.831±0.822 | 2.195±0.312 |
| 細粒10%(1.5g) | 7.055±0.657 | 1.919±0.253 |
16.2 吸収
16.2.1 食事の影響
健康成人男子(18名)に本剤3カプセル(テプレノンとして150mg注))をクロスオーバー法で食後30分、1時間及び3時間に経口投与し、血漿中濃度を測定し、下図及び下表に示した。血漿中濃度曲線下面積(AUC)は食後30分投与を100%とすると、食後1時間投与では変化なく、食後3時間投与では約23%低下した1)。
テプレノン150mg注)単回投与後の血漿中テプレノン濃度
| AUC0-24(μg・hr/mL) | Cmax(μg/mL) | tmax(hr) | |
| 食後30分 | 4.768±1.368 | 2.087±1.041 | 5.4±0.5 |
| 食後1時間 | 4.858±1.434 | 2.274±0.930 | 5.1±0.6 |
| 食後3時間 | 3.671±1.296 | 1.562±0.852 | 4.3±0.9 |
注)本剤の承認された用法及び用量は、「テプレノンとして150mgを1日3回に分けて食後に経口投与する。」である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
18. 薬効薬理
18.1 作用機序
テプレノンは細胞レベルで糖蛋白質代謝を改善し、粘膜の防御機構として胃粘液(糖蛋白質)合成・分泌を正常化し、粘膜の血流を改善することにより、攻撃因子から胃粘膜を防御しているものと考えられている。
18.2 抗潰瘍作用
18.3 胃粘液増加作用
18.4 熱ショック蛋白(HSP)誘導による細胞保護作用
モルモットにおいて、胃粘膜細胞内のHSP60、70、90を誘導し、細胞保護作用を示すことが確認されている18)。
18.5 胃粘膜プロスタグランジン増加作用
18.6 胃粘膜血流増加並びに改善作用
18.7 胃粘膜保護作用
18.8 胃粘膜増殖帯細胞の恒常性維持作用
18.9 脂質過酸化抑制作用
ラットにおいて熱傷ストレス負荷による胃粘膜障害を抑制すると同時に胃粘膜中の過酸化脂質の増加を抑制する27)。
19. 有効成分に関する理化学的知見
19.1. テプレノン
20. 取扱い上の注意
細粒バラ包装はボトル開栓後、又はアルミ袋開封後光を遮り保存すること。(光により含量が低下することがある。)
22. 包装
<セルベックスカプセル50mg>
100カプセル[10カプセル(PTP)×10]
500カプセル[ボトル]
1,000カプセル[10カプセル(PTP)×100]
<セルベックス細粒10%>
100g[ボトル、乾燥剤セットキャップ]
105g[0.5g分包×3×70]
630g[0.5g分包×3×420]
1kg[500gアルミ袋×2]
23. 主要文献
- 長谷川二郎ら, 消化器科, 7 (6), 740-752, (1987)
- 岩越一彦ら, 基礎と臨床, 20 (16), 8261-8268, (1986)
- 芦沢真六ら, Prog.Med., 3 (S.), 1169-1191, (1983)
- Murakami M.et al., Arzneim.Forsch., 31-1 (5), 799-804, (1981)
- Murakami M.et al., Jpn.J.Pharmacol., 32 (5), 921-924, (1982) »DOI
- 村上 学ら, 消化器科, 7 (6), 613-616, (1987)
- 渡辺敦光ら, 消化器科, 7 (6), 623-630, (1987)
- 小林 隆ら, Ulcer Research, 21 (1), 66-69, (1994)
- 佐藤泰男ら, Prog.Med., 12 (3), 583-586, (1992)
- Terano A.et al., Digestion, 33 (4), 206-210, (1986)
- 中村正彦ら, Prog.Med., 10 (3), 561-568, (1990)
- 滝内比呂也ら, 臨牀と研究, 70 (11), 3666-3670, (1993)
- 内田秀一ら, 医学のあゆみ, 143 (7), 605-606, (1987)
- 西崎 朗ら, 日本消化器病学会雑誌, 87 (10), 2352-2357, (1990) »DOI
- Oketani K.et al., Jpn.J.Pharmacol., 33 (3), 593-601, (1983) »DOI
- 青野 充ら, 日本消化器病学会雑誌, 81 (S.), 2389, (1984)
- Pappas T.N.et al., Gastroenterology, 90 (5), 1578, (1986)
- Hirakawa T.et al., Gastroenterology, 111 (2), 345-357, (1996)
- 荒川哲男ら, 抗分泌薬時代における粘膜保護薬テプレノン療法の意義−メディカルトリビューン, 70-76, (1988)
- 松田泰行ら, 基礎と臨床, 23 (17), 6823-6827, (1989)
- 福澤邦康ら, 新薬と臨牀, 43 (2), 321-325, (1994)
- 中村紀夫ら, 臨牀と研究, 61 (5), 1533-1541, (1984)
- Terano A.et al., Digestion, 35 (3), 182-188, (1986)
- Arakawa T.et al., Digestion, 39 (2), 111-117, (1988)
- 村上 学ら, 日本薬理学雑誌, 79 (6), 591-597, (1982) »PubMed
- Kohli Y.et al., 京都府立医科大学雑誌, 100 (6), 637-644, (1991)
- 竹村俊樹ら, 臨床薬理, 20 (1), 97-98, (1989) »DOI
24. 文献請求先及び問い合わせ先
文献請求先
EAファーマ株式会社
くすり相談室
〒104-0042
東京都中央区入船二丁目1番1号
電話:フリーダイヤル 0120-917-719
製品情報問い合わせ先
EAファーマ株式会社
くすり相談室
〒104-0042
東京都中央区入船二丁目1番1号
電話:フリーダイヤル 0120-917-719
26. 製造販売業者等
26.1 製造販売元
エーザイ株式会社
東京都文京区小石川4-6-10
26.2 販売元
EAファーマ株式会社
東京都中央区入船二丁目1番1号