医薬品情報
| 総称名 | アンカロン |
|---|---|
| 一般名 | アミオダロン塩酸塩 |
| 欧文一般名 | Amiodarone Hydrochloride |
| 薬効分類名 | 不整脈治療剤 |
| 薬効分類番号 | 2129 |
| ATCコード | C01BD01 |
| KEGG DRUG |
D00636
アミオダロン塩酸塩
|
| KEGG DGROUP |
DG01653
抗不整脈薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年7月 改訂(第3版)

|
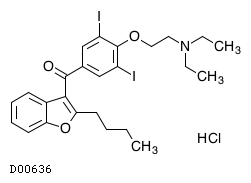
1.警告 2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アンカロン錠100 | Ancaron Tablets | サノフィ | 2129010F1022 | 73.6円/錠 | 毒薬, 処方箋医薬品 |
1. 警告
1.1 施設の限定
本剤の使用は致死的不整脈治療の十分な経験のある医師に限り、諸検査の実施が可能で、緊急時にも十分に対応できる設備の整った施設でのみ使用すること。
1.2 患者の限定
1.3 患者への説明と同意
本剤の使用に当たっては、患者又はその家族に本剤の有効性及び危険性を十分説明し、可能な限り同意を得てから、入院中に投与を開始すること。
1.4 副作用に関する注意
本剤を長期間投与した際、本剤の血漿からの消失半減期は19〜53日と極めて長く、投与を中止した後も本剤が血漿中及び脂肪に長期間存在するため、副作用発現により投与中止、あるいは減量しても副作用はすぐには消失しない場合があるので注意すること。
1.5 相互作用に関する注意
本剤は種々の薬剤との相互作用が報告されており、これらの薬剤を併用する場合、また本剤中止後に使用する場合にも注意すること。[10.参照]
2. 禁忌
次の患者には投与しないこと
2.1 重篤な洞不全症候群のある患者[洞機能抑制作用により、洞不全症候群を増悪させるおそれがある。]
2.2 2度以上の房室ブロックのある患者[刺激伝導抑制作用により、房室ブロックを増悪させるおそれがある。]
2.3 本剤の成分又はヨウ素に対する過敏症の既往歴のある患者
2.4 リトナビル、ニルマトレルビル・リトナビル、ネルフィナビルメシル酸塩、モキシフロキサシン塩酸塩、ラスクフロキサシン塩酸塩(注射剤)、バルデナフィル塩酸塩水和物、シルデナフィルクエン酸塩(勃起不全を効能又は効果とするもの)、トレミフェンクエン酸塩、フィンゴリモド塩酸塩、シポニモド フマル酸又はエリグルスタット酒石酸塩を投与中の患者[10.1参照]
4. 効能または効果
6. 用法及び用量
導入期
通常、成人にはアミオダロン塩酸塩として1日400mgを1〜2回に分けて1〜2週間経口投与する。
維持期
通常、成人にはアミオダロン塩酸塩として1日200mgを1〜2回に分けて経口投与する。
なお、年齢、症状により適宜増減する。
8. 重要な基本的注意
8.1 本剤による副作用発現頻度が高いことから、患者の感受性の個体差に留意して有効最低維持量での投与が望ましい。
なお、副作用の多くは可逆的であり投与中止により消失又は軽快すると報告されているが、本剤の血漿からの消失半減期が長いため、すぐには消失しない場合があるので注意すること。
なお、副作用の多くは可逆的であり投与中止により消失又は軽快すると報告されているが、本剤の血漿からの消失半減期が長いため、すぐには消失しない場合があるので注意すること。
8.2 本剤の投与に際しては、下記の重大な副作用及び発現頻度の高い副作用に十分留意し、頻回に患者の状態を観察するとともに、脈拍、血圧、心電図検査、心エコー検査を定期的に実施すること。
なお、諸検査は以下の表のとおり実施することが望ましい。
なお、諸検査は以下の表のとおり実施することが望ましい。
| 検査項目 | 投与前 | 投与開始1ヵ月後 | 投与中3ヵ月毎 |
| 胸部レントゲン検査又は胸部CT検査 肺機能検査(% DLco) | ○ | ○ | ○ |
| 臨床検査 (血液学的検査) (血液生化学的検査) (尿検査) (甲状腺機能検査) | ○ | ○ | ○ |
| 眼科検査 | ○ | ○ | ○ |
8.2.1 呼吸器
8.2.2 循環器
既存の不整脈を重度に悪化させることがあるほか、Torsade de pointes等新たな不整脈を起こすことがある。また、本剤の薬理作用に基づく徐脈(心停止に至る場合もある)、房室ブロック、脚ブロック、QT延長、洞機能不全等があらわれることがある。不整脈の悪化は投与開始初期又は導入期にあらわれることが多いため、入院にて投与開始し、頻回に心電図検査を行うこと。[11.1.2参照]
8.2.3 肝臓
肝酵素の上昇があらわれることがある。通常は肝酵素値が異常を示すだけであるが、重篤な肝障害が起こる場合もあり、致死的な場合も報告されている。[11.1.3参照]
8.2.4 眼
ほぼ全例で角膜色素沈着があらわれるが、通常は無症候性であり、細隙燈検査でのみ認められる。また、視覚暈輪、羞明、眼がかすむ等の視覚障害及び視神経炎があらわれることがある。
8.2.5 甲状腺
8.3 本剤は心臓ペーシング閾値を上昇させる可能性があるので、恒久的ペースメーカー使用中、あるいは一時的ペーシング中の患者に対しては十分注意して投与すること。また、ペースメーカー使用中の患者に投与する場合は適当な間隔でペーシング閾値を測定すること。異常が認められた場合には直ちに減量又は投与を中止すること。
8.4 植込み型除細動器(ICD)を使用している患者において、ICDの治療対象の不整脈が発現した場合、本剤の徐拍化作用により不整脈が検出されずICDによる治療が行われないおそれがある。ICDを使用している患者に本剤を追加投与した場合又は本剤の投与量の変更を行った場合には、十分に注意して経過観察を行うこと。
8.5 本剤とレジパスビル/ソホスブビル配合剤の併用は可能な限り避けること。ただし、やむを得ず併用する場合には、患者又はその家族に対して併用投与により徐脈等の重篤な不整脈が発現するリスクがあること等を十分説明するとともに、不整脈の徴候又は症状(失神寸前の状態又は失神、浮動性めまい、ふらつき、倦怠感、脱力、極度の疲労感、息切れ、胸痛、錯乱、記憶障害等)が認められた場合には、速やかに担当医師に連絡するよう指導すること。[10.2参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 間質性肺炎、肺胞炎、肺線維症のある患者及び肺拡散能の低下した患者、並びに肺に既往歴のある患者
重篤な肺障害を増悪させるおそれがある。[8.2.1参照]
9.1.2 軽度の刺激伝導障害(1度房室ブロック、脚ブロック等)のある患者
刺激伝導抑制作用により、刺激伝導障害を悪化させるおそれがある。
9.1.3 心電図上QT延長のみられる患者
活動電位持続時間延長作用により、心電図上QT時間を過度に延長させるおそれがある。
9.1.4 重篤なうっ血性心不全のある患者
心不全を増悪させるおそれがある。
9.1.5 甲状腺機能障害又はその既往歴のある患者
甲状腺機能障害を増悪させるおそれがある。[8.2.5参照]
9.1.6 心臓移植待機中の患者
本剤投与の必要性を慎重に検討すること。心臓移植前に本剤を投与した患者において、心臓移植後に原発性移植片機能不全を起こすリスクが増加したとの報告がある1)。
9.2 腎機能障害患者
9.2.1 重篤な腎機能低下のある患者
腎機能を悪化させるおそれがある。
9.3 肝機能障害患者
9.3.1 重篤な肝機能低下のある患者
肝機能を悪化させるおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある患者には投与しないことが望ましい。やむを得ず投与する場合は、本剤投与によるリスクについて患者に十分説明すること。下記のことが報告されている。
・妊娠中の投与により、新生児に先天性の甲状腺腫、甲状腺機能低下症及び甲状腺機能亢進症を起こしたとの報告がある。
・維持療法を受けた後出産した母体及び新生児の血漿中濃度から胎盤通過率は約26%と推定されている。
・動物実験では催奇形作用は認められていない(ラット、ウサギ)が受胎に対する影響(ラット)、胎児体重の低下(ラット)、死亡胎児数の増加(ウサギ)が認められている。
9.6 授乳婦
投与中は授乳を避けること。動物及びヒト母乳中へ移行することが報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
投与に際しては、投与量に十分注意するとともに、心電図、胸部レントゲン検査(必要に応じて肺機能検査)等を定期的に行い、患者の状態をよく観察すること。呼吸機能、肝・腎機能が低下していることが多く、また体重が少ない傾向があるなど、副作用が発現しやすい。
10. 相互作用
相互作用序文
本剤は、主として肝代謝酵素CYP3A4で代謝される。また、本剤の半減期が長いことから、薬物相互作用は併用薬だけでなく、本剤中止後に使用される薬剤についても注意すること。[1.5参照]
薬物代謝酵素用語
CYP3A4
10.1 併用禁忌
| リトナビル ノービア ニルマトレルビル・リトナビル パキロビッド [2.4参照] | 重篤な副作用(不整脈等)を起こすおそれがある。 | 左記薬剤のCYP3A4に対する競合的阻害作用により、本剤の血中濃度が大幅に上昇するおそれがある。 |
| ネルフィナビルメシル酸塩 ビラセプト [2.4参照] | 重篤な又は生命に危険を及ぼすような事象(QT延長、Torsade de pointes等の不整脈や持続的な鎮静)を起こすおそれがある。 | 左記薬剤のCYP3A4に対する競合的阻害作用により、本剤の血中濃度が大幅に上昇するおそれがある。 |
| モキシフロキサシン塩酸塩 アベロックス ラスクフロキサシン塩酸塩(注射剤) ラスビック点滴静注 [2.4参照] | QT延長、心室性不整脈を起こすおそれがある。 | 併用によりQT延長作用が相加的に増加するおそれがある。 |
| バルデナフィル塩酸塩水和物 レビトラ シルデナフィルクエン酸塩(勃起不全を効能又は効果とするもの) バイアグラ [2.4参照] | QT延長を起こすおそれがある。 | 併用によりQT延長作用が相加的に増加するおそれがある。 |
| トレミフェンクエン酸塩 フェアストン [2.4参照] | QT延長を増強し、心室性頻拍(Torsade de pointesを含む)等を起こすおそれがある。 | 併用によりQT延長作用が相加的に増加するおそれがある。 |
| フィンゴリモド塩酸塩 イムセラ ジレニア [2.4参照] | 併用によりTorsade de pointes等の重篤な不整脈を起こすおそれがある。 | これらの薬剤の投与により心拍数が低下するため、併用により不整脈を増強するおそれがある。 |
| シポニモド フマル酸 メーゼント [2.4参照] | 併用によりTorsade de pointes等の重篤な不整脈を起こすおそれがある。 | これらの薬剤の投与により心拍数が低下するため、併用により不整脈を増強するおそれがある。 |
| エリグルスタット酒石酸塩 サデルガ [2.4参照] | 併用によりQT延長等を生じるおそれがある。 | 併用によりQT延長作用が増強すると考えられる。本剤のCYP2D6及びCYP3A阻害作用によりエリグルスタット酒石酸塩の代謝が阻害されるおそれがある。 |
10.2 併用注意
| 抗凝血剤 ワルファリン | プロトロンビン時間の延長、重大な又は致死的な出血が生じることが報告されているため、抗凝血剤を1/3〜1/2に減量し、プロトロンビン時間を厳密に監視すること。 | 本剤によるCYP2C9阻害が考えられる。 また、甲状腺機能が亢進されると、抗凝血剤の作用が増強されることが考えられる。 |
| P糖蛋白を基質とする抗凝固剤 ダビガトランエテキシラートメタンスルホン酸塩 エドキサバントシル酸塩水和物 | これらの薬剤の血中濃度が上昇し、抗凝固作用が増強することが報告されている。 | 本剤によるP糖蛋白阻害が考えられる。 |
| ジゴキシン | ジゴキシン血中濃度が上昇し、臨床的な毒性(洞房ブロック、房室ブロック、憂鬱、胃腸障害、精神神経障害等)を生じることが報告されているため、本剤を投与開始するときはジギタリス治療の必要性を再検討し、ジギタリス用量を1/2に減量するか又は投与を中止すること。 | 本剤による腎外クリアランスの低下、消化管吸収の増加が考えられる。また、甲状腺機能の変化がジゴキシンの腎クリアランスや吸収に影響することなどが考えられる。 |
| キニジン | キニジン血中濃度が上昇し、Torsade de pointesが起こることが報告されているため、キニジンを1/3〜1/2に減量するか又は投与を中止すること。 | 機序不明。 |
| メキシレチン | Torsade de pointesを発現したとの報告がある。 | 機序不明。 |
| ジソピラミド | Torsade de pointesを発現したとの報告がある。 | 本剤は、心刺激伝導作用を延長させることが考えられる。 |
| ソタロール | 併用によりTorsade de pointesを起こすことがある。 | 併用によりQT延長作用が相加的に増加することがある。 |
| プロカインアミド | プロカインアミド、N-アセチルプロカインアミド血中濃度が上昇し、心血管作用が増強されることが報告されているため、プロカインアミドを1/3に減量するか又は投与を中止すること。 | 本剤は、プロカインアミドの肝代謝と腎クリアランスを阻害することが考えられる。 |
| テオフィリン | テオフィリン血中濃度を上昇させるとの報告がある。 | 本剤によるCYP1A2阻害が考えられる。 |
| フェニトイン | フェニトインの血中濃度上昇による精神神経障害があらわれることがある。観察を十分に行い、過量投与の症状があらわれた場合には速やかにフェニトイン投与量を減らすこと。 | 本剤によるCYP2C9阻害が考えられる。 |
| フレカイニド | フレカイニド血中濃度が上昇することが報告されているため、フレカイニドを2/3に減量すること。 | 本剤によるCYP2D6阻害が考えられる。 |
| アプリンジン | アプリンジン血中濃度の上昇、心血管作用の増加の報告がある。 | 本剤によるCYP2D6阻害が考えられる。 |
| CYP3A4で代謝される薬剤 シクロスポリン タクロリムス ジヒドロエルゴタミン エルゴタミン トリアゾラム ミダゾラム 等 | 左記薬剤の血中濃度を上昇させるとの報告がある。 | 本剤によるCYP3A4阻害が考えられる。 |
| CYP3A4で代謝されるHMG-CoA還元酵素阻害剤 シンバスタチン 等 | 併用により筋障害のリスクが増加するとの報告がある。 | 本剤によるCYP3A4阻害により、血中濃度が上昇することがある。 |
| リドカイン | 洞停止、洞房ブロックを発現したとの報告がある。 | 本剤による洞結節の相加的抑制、代謝阻害が考えられる。 |
| フェンタニル | 血圧低下、徐脈を発現したとの報告がある。 | 本剤とフェンタニルには、血圧低下、徐脈作用があり併用により作用が増強されることが考えられる。 |
| 全身麻酔剤 | ハロゲン化吸入麻酔薬の心筋抑制因子及び伝導障害に対する感受性が高くなることがあり、また、アトロピンが不奏効の徐脈、低血圧、伝導障害、心拍出量低下といった潜在的に重度の合併症が報告されている。さらに、非常にまれであるがときに致命的な急性呼吸窮迫症候群が通常手術直後に認められている。 | 機序不明。 |
| 局所麻酔剤 | 心機能抑制作用が増強するおそれがあるので、心電図検査等によるモニタリングを行うこと。 | 併用により作用が増強されることが考えられる。 |
| β遮断薬 メトプロロール プロプラノロール | 徐脈、心停止を発現したとの報告がある。 | 本剤がメトプロロール、プロプラノロールの肝代謝を抑制し、初回通過効果を低下させることが考えられる。 |
| Ca-拮抗剤 ジルチアゼム ベラパミル | 心停止、房室ブロックを発現したとの報告がある。 | 本剤はこれらの薬剤との併用で洞房と房室結節伝導を遅延させ、心筋収縮力を相加的に低下させることが考えられる。 |
| 低カリウム血症を起こす薬剤 利尿剤 副腎皮質ステロイド剤 アムホテリシンB ACTH(テトラコサクチド) | Torsade de pointesを起こすことがある。 | 機序不明。 低カリウム血症が惹起された場合、本剤のQT延長作用が増加されることが考えられる。 |
| シルデナフィルクエン酸塩(肺動脈性肺高血圧症を効能又は効果とするもの) | QT延長を起こすおそれがある。 | 併用によりQT延長作用が相加的に増加するおそれがある。 |
| レジパスビル/ソホスブビル配合剤 [8.5参照] | 徐脈等の不整脈があらわれるおそれがあり、海外の市販後において死亡例も報告されていることから、併用は可能な限り避けること。やむを得ず本剤と併用する場合は、不整脈の徴候の発現等に注意して十分に観察し、異常が認められた場合には適切な対応を行うこと。 | 機序不明。 |
| ヒドロキシクロロキン硫酸塩 | 心室性不整脈を起こすおそれがある。 | 機序不明。 |
| セイヨウオトギリソウ(St.John's Wort、セント・ジョーンズ・ワート)含有食品 | 血中濃度が低下するおそれがあるので、本剤投与時はセイヨウオトギリソウ含有食品を摂取しないよう注意すること。 | セイヨウオトギリソウにより本剤の代謝酵素が誘導され、代謝が促進されることが考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 間質性肺炎(1.0%)、肺線維症(1.0%)、肺胞炎(頻度不明)
11.1.2 既存の不整脈の重度の悪化(3.9%)、Torsade de pointes(頻度不明)、心不全(1.9%)、徐脈(2.9%)、心停止(頻度不明)、完全房室ブロック(頻度不明)、血圧低下(1.0%)
既存の不整脈を重度に悪化させることがあるほか、Torsade de pointes、心不全、徐脈、徐脈からの心停止、完全房室ブロック及び血圧低下があらわれることがある。[8.2.2参照]
11.1.3 劇症肝炎(頻度不明)、肝硬変(頻度不明)、肝障害(頻度不明)
11.1.4 甲状腺機能亢進症(頻度不明)、甲状腺炎(頻度不明)、甲状腺機能低下症(1.0%)
11.1.5 抗利尿ホルモン不適合分泌症候群(SIADH)(頻度不明)
抗利尿ホルモン不適合分泌症候群(SIADH)があらわれることがあるので、低浸透圧血症を伴う低ナトリウム血症、尿中ナトリウム排泄量の増加、痙攣、意識障害等の症状があらわれた場合には投与を中止し、水分摂取の制限等適切な処置を行うこと。
11.1.6 肺胞出血(頻度不明)
11.1.7 急性呼吸窮迫症候群(頻度不明)
本剤投与中の患者の心臓、心臓以外の手術後に、あらわれることがある。
11.1.8 無顆粒球症(頻度不明)、白血球減少(1.0%)
11.2 その他の副作用
| 1%以上 | 1%未満 | 頻度不明 | |
| 精神神経系 | 性欲減退、睡眠障害、不眠症、幻覚 | ||
| 感覚器 | 味覚異常 | 臭覚異常 | |
| 消化器 | 悪心・嘔気(5.8%)、嘔吐、食欲不振 | 胃部不快感、舌アフタ形成 | 便秘 |
| 循環器注1) | QT延長、房室ブロック | 洞機能不全 | 脚ブロック、本剤投与中の患者の開胸手術中、心肺バイパス中止後に血圧低下 |
| 呼吸器 | 肺機能障害、胸部X線異常 | 喘息 | |
| 血液 | 白血球減少、好酸球増加、好中球減少 | ヘモグロビン、ヘマトクリット値の上昇及び低下、白血球増多、血小板減少、血液凝固異常 | |
| 内分泌系 (甲状腺) | 甲状腺機能検査値異常(rT3の上昇、TSHの上昇及び低下、T3の低下、T4の上昇及び低下)(30.8%) | ||
| 自律神経系 | 潮紅、流涎 | ||
| 中枢・末梢神経系 | 振戦 | 頭痛、不随意運動、協調運動低下、歩行障害、運動失調、めまい、知覚異常、頭蓋内圧亢進、末梢性感覚運動ニューロパチー | |
| 皮膚 | 皮疹、手指爪変色 | 光線過敏症、脱毛、日光皮膚炎、皮膚青色化、紫斑、皮膚血管炎、血管神経性浮腫、蕁麻疹 | |
| 眼注2) | 角膜色素沈着(21.2%) | 羞明 | 視覚暈輪、眼がかすむ、視神経炎 |
| 肝臓 | 肝機能検査値異常[AST、ALT、Al-P、LDH、LAP、γ-GTP、の上昇] | 総ビリルビンの上昇 | |
| 腎臓 | BUN上昇、血中クレアチニン上昇、血清Na低下、尿酸の上昇及び低下、血清Na上昇、血清電解質(K、Cl、Ca、P)の上昇及び低下、尿蛋白、尿糖、尿ウロビリノーゲン、尿pH異常 | ||
| その他 | 手指の浮腫、全身倦怠、女性化乳房 | CK上昇、コリンエステラーゼの上昇及び低下、疲労、副睾丸炎、骨髄肉芽腫 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
患者8名にアンカロン400mgを単回経口投与したデータを示す2)。
| Cmax(μg/mL) | Tmax(hr) | T1/2(hr) | AUC(μg・hr/mL) | |
| 患者(n=8) | 1.194 | 4.6 | 13.4 | 9.725 |
16.3 分布
血漿からの消失半減期は、19〜53日と極めて長かった。これはdeep stock compartmentである脂肪からの緩慢な消失による。脂肪の他に、肝及び肺に高く分布し、脳への移行は低かった3)(外国人データ)。
16.4 代謝
アミオダロンは、5つの代謝経路すなわち脱ヨウ素化、O-脱アルキル化、N-脱アルキル化、水酸化及びグルクロン酸抱合により代謝を受けると推定される3)。
16.5 排泄
胆汁を介した糞排泄が主排泄経路と考えられた3)(外国人データ)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
18. 薬効薬理
18.1 作用機序
心筋のK+チャネル遮断作用により活動電位持続時間、有効不応期を延長させる。
また、Na+チャネル遮断作用、Ca2+チャネル遮断作用及び抗アドレナリン作用を併せ持つ。
また、Na+チャネル遮断作用、Ca2+チャネル遮断作用及び抗アドレナリン作用を併せ持つ。
18.2 実験的不整脈に対する作用
18.3 電気生理学的作用
18.4 血行動態への影響
イヌにおいて、αあるいはβ受容体刺激作用を非競合的に阻害し、冠血流量を増加させ、拡張期及び収縮期血圧を低下させ、アトロピンあるいはβ遮断薬で拮抗されない徐脈を生じ、左心室内圧上昇速度の軽度減少と拡張終期圧の増加を惹起した3)。
19. 有効成分に関する理化学的知見
19.1. アミオダロン塩酸塩
20. 取扱い上の注意
アルミピロー包装開封後は、湿気を避けて遮光して保存すること。
22. 包装
100錠[10錠(PTP)×10]
23. 主要文献
- Buchan T A,et al., J Heart Lung Transplant., 40 (7), 642-51, (2021) »PubMed
- 加藤和三 他, 基礎と臨床, 27 (13), 5261-74, (1993)
- Harris,L.,et al., AMIODARONE(Medecine et Sciences Internationales), (1986), (Paris.)
- 加藤和三 他, 臨床医薬, 6 (11), 2311-38, (1990)
- 戸嶋裕徳 他, 臨床医薬, 7 (1), 129-49, (1991)
- Charlier,R.,et al., J.Pharmacol., 1 (2), 175-82, (1970)
- Singh,B.N.,et al., Br.J.Pharmacol., 39, 657-67, (1970) »PubMed
- Pallandi,R.T.,et al., Br.J.Pharmacol., 92, 97-103, (1987) »PubMed
- Kato,R.,et al., Am.Heart J., 115 (2), 351-9, (1988) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
サノフィ株式会社
くすり相談室
〒163-1488
東京都新宿区西新宿三丁目20番2号
電話:フリーダイヤル 0120-109-905
製品情報問い合わせ先
サノフィ株式会社
くすり相談室
〒163-1488
東京都新宿区西新宿三丁目20番2号
電話:フリーダイヤル 0120-109-905
26. 製造販売業者等
26.1 製造販売元
サノフィ株式会社
〒163-1488
東京都新宿区西新宿三丁目20番2号
26.2 提携
大正製薬株式会社