医薬品情報
| 総称名 | ミケラン |
|---|---|
| 一般名 | カルテオロール塩酸塩 |
| 欧文一般名 | Carteolol Hydrochloride |
| 製剤名 | カルテオロール塩酸塩点眼液 |
| 薬効分類名 | 緑内障・高眼圧症治療剤 |
| 薬効分類番号 | 1319 |
| ATCコード | S01ED05 |
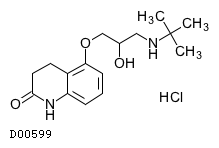
| KEGG DRUG |
D00599
カルテオロール塩酸塩
|
| KEGG DGROUP |
DG03201
眼圧降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2021年7月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ミケラン点眼液1% | Mikelan ophthalmic solution 1% | 大塚製薬 | 1319701Q1021 | 117円/mL | |
| ミケラン点眼液2% | Mikelan ophthalmic solution 2% | 大塚製薬 | 1319701Q2028 | 147.5円/mL |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
緑内障、高眼圧症
6. 用法及び用量
通常、1%製剤を1回1滴、1日2回点眼する。なお、十分な効果が得られない場合は、2%製剤を用いて1回1滴、1日2回点眼する。
8. 重要な基本的注意
全身的に吸収され、β遮断剤全身投与時と同様の副作用があらわれることがあるので、留意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 肺高血圧による右心不全の患者
心機能を抑制し症状が増悪するおそれがある。[11.1.3参照]
9.1.2 うっ血性心不全の患者
心機能を抑制し症状が増悪するおそれがある。[11.1.3参照]
9.1.3 コントロール不十分な糖尿病の患者
血糖値に注意すること。低血糖症状を起こしやすく、かつ症状をマスクすることがある。
9.1.4 糖尿病性ケトアシドーシス及び代謝性アシドーシスのある患者
アシドーシスによる心筋収縮力の抑制を増強するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中への移行が報告されている。
9.7 小児等
9.7.1 小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.7.2 低血糖症状があらわれた場合には、経口摂取可能な状態では角砂糖、あめ等の糖分の摂取、意識障害、痙攣を伴う場合には、ブドウ糖の静注等を行い、十分に経過観察すること。食事摂取不良等体調不良の状態の患児にカルテオロール塩酸塩点眼液1%・2%を投与した症例で低血糖が報告されている。
9.8 高齢者
一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
| β遮断剤 (全身投与) | 全身的なβ遮断作用が増強することがあるので、減量するなど注意すること。 | 相加的にβ遮断作用を増強させる。 |
| 交感神経系に対し抑制的に作用する他の薬剤 レセルピン等 | 過剰の交感神経抑制を来すおそれがあるので、減量するなど注意すること。 | 相加的に交感神経抑制作用を増強させる。 |
| カルシウム拮抗剤 ベラパミル塩酸塩 ジルチアゼム塩酸塩 | 徐脈、房室ブロック等の伝導障害、うっ血性心不全等があらわれることがある。併用する場合には用量に注意すること。 | 相互に作用が増強される。 |
| アドレナリン | 類薬(チモロールマレイン酸塩点眼液)でアドレナリンの散瞳作用が助長されたとの報告がある。 | アドレナリンのβ作用のみが遮断され、α作用が優位になる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 喘息発作(頻度不明)
β-受容体遮断による気管支平滑筋収縮作用により、喘息発作を誘発することがあるので、咳・呼吸困難等の症状があらわれた場合には投与を中止し、適切な処置を行うこと。[2.2参照]
11.1.2 失神(頻度不明)
高度な徐脈に伴う失神があらわれることがある。
11.1.3 房室ブロック、洞不全症候群、洞停止等の徐脈性不整脈、うっ血性心不全、冠攣縮性狭心症(いずれも頻度不明)
11.1.4 眼類天疱瘡(頻度不明)
結膜充血、角膜上皮障害、乾性角結膜炎、結膜萎縮、睫毛内反、眼瞼眼球癒着等があらわれることがある。
11.1.5 脳虚血、脳血管障害(いずれも頻度不明)
11.1.6 全身性エリテマトーデス(頻度不明)
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 頻度不明 | |
| 眼 | 眼刺激症状(しみる感じ、疼痛、灼熱感、かゆみ、乾燥感等) | 霧視、異物感、眼脂、結膜炎、眼瞼炎、眼瞼腫脹、羞明感、角膜障害(角膜炎、角膜びまん性混濁、角膜びらん等)、視力異常、眼瞼発赤 | 眼底黄斑部の浮腫・混濁注1) |
| 循環器 | 徐脈 | 低血圧、不整脈、動悸、胸痛 | |
| 呼吸器 | 呼吸困難 | 鼻症状(くしゃみ、鼻水、鼻づまり)、咳、咽喉頭症状(違和感等) | |
| その他 | 頭痛、不快感、倦怠感、めまい、悪心、味覚異常(苦味等)、皮膚炎、発疹 | 血糖値の低下、筋肉痛、こわばり(四肢等)、脱力感、抑うつ、重症筋無力症の増悪 |
14. 適用上の注意
14.1 薬剤交付時の注意
患者に対し以下の点に注意するよう指導すること。
・薬液汚染防止のため、点眼のとき、容器の先端が直接目に触れないように注意すること。
・患眼を開瞼して結膜のう内に点眼し、1〜5分間閉瞼して涙のう部を圧迫させた後、開瞼すること。
・他の点眼剤を併用する場合には、少なくとも5分以上間隔をあけてから点眼すること。
16. 薬物動態
16.1 血中濃度
16.1.1 単回点眼
・カルテオロール塩酸塩2%点眼液を健康成人(11例)の両眼に20μLずつ単回点眼した時の血漿中カルテオロール濃度は投与後15分に最高値1.33ng/mLを示し、減衰期の消失半減期は13.8時間であった1)。
・カルテオロール塩酸塩2%点眼液を原発開放隅角緑内障又は高眼圧症の患者(7例)の両眼に1滴単回点眼した時の最高血漿中カルテオロール濃度(平均値±標準誤差)は1.180±0.384ng/mL(点眼30分後)であった。
16.1.2 反復点眼
カルテオロール塩酸塩2%点眼液を原発開放隅角緑内障又は高眼圧症の患者(両眼に1滴、1日2回、12例)に8週間反復点眼した時の血漿中カルテオロール濃度(平均値±標準偏差)は、3.198±1.500ng/mL(点眼2時間後)であった2)。
16.4 代謝
カルテオロールは、ヒト肝ミクロゾームチトクロームP450の分子種のうち、主としてCYP2D6により代謝される3)(in vitro)。
16.5 排泄
カルテオロール塩酸塩2%点眼液を健康成人の両眼に1滴ずつ点眼した時、点眼後24時間までに点眼量の約16%がカルテオロールとして尿中に排泄され、この時のカルテオロール尿中排泄速度の半減期は約5時間であった4)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床試験
(1)国内42施設で総計796例について実施された臨床試験の概要は次のとおりである。
二重盲検比較試験を含む臨床試験のうち、緑内障及び高眼圧症患者779例(0.5%注)、1%、2%)において、総効果判定眼数1,425眼中1,150眼(80.7%)が、有効と規定した21mmHg以下の眼圧に調整された。なお、二重盲検比較試験の結果、本剤の有用性が認められている5)6)7)8)。
二重盲検比較試験を含む臨床試験のうち、緑内障及び高眼圧症患者779例(0.5%注)、1%、2%)において、総効果判定眼数1,425眼中1,150眼(80.7%)が、有効と規定した21mmHg以下の眼圧に調整された。なお、二重盲検比較試験の結果、本剤の有用性が認められている5)6)7)8)。
(2)正常眼圧緑内障患者22例を対象にカルテオロール塩酸塩2%点眼液1日2回18カ月間点眼群(10例)と無治療経過観察群(12例)でのハンフリー視野計による視野測定値を比較検討した。その結果、カルテオロール塩酸塩点眼群は無治療経過観察群に比較し視野の指標であるMean deviation(MD)及びCorrected pattern standard deviation(CPSD)の悪化を有意に抑制した9)。
注)本剤の承認された用法及び用量は、1%製剤を1回1滴、1日2回点眼し、十分な効果が得られない場合は、2%製剤を用いて1回1滴、1日2回点眼である。
18. 薬効薬理
18.1 作用機序
18.2 眼圧下降作用
18.2.1 ウサギにカルテオロール塩酸塩0.25〜2%液を点眼した場合、用量依存的で持続的な眼圧下降が認められた13)。
18.2.2 ウサギの水負荷眼圧上昇試験において、カルテオロール塩酸塩0.1〜2%液点眼により眼圧上昇の有意な抑制が認められた13)。
18.2.3 ビーグル犬にカルテオロール塩酸塩1〜4%液を1回0.1mL、1日2回、連続8週間点眼しても眼圧下降作用の減弱は認められなかった13)。
18.3 眼底血流増加作用
19. 有効成分に関する理化学的知見
19.1. カルテオロール塩酸塩
20. 取扱い上の注意
外箱開封後は遮光して保存すること。
22. 包装
<ミケラン点眼液1%>
プラスチック点眼容器
5mL×10本
<ミケラン点眼液2%>
プラスチック点眼容器
5mL×10本
23. 主要文献
- Ishii,Y.et al., J Clin Pharmacol., 42 (9), 1020-1026, (2002) »PubMed
- 川瀬和秀 ほか, 日本眼科学会雑誌, 114 (11), 976-982, (2010) »PubMed
- Kudo,S.et al., Eur J Clin Pharmacol., 52 (6), 479-485, (1997) »PubMed
- 森田誠治 ほか:社内資料(ヒトにおける血中濃度及び尿中排泄), (1982)
- 根岸千秋 ほか, 日本眼科学会雑誌, 85 (1), 57-66, (1981) »PubMed
- 北沢克明 ほか, 日本眼科学会雑誌, 85 (7), 798-804, (1981) »PubMed
- 北沢克明 ほか, 眼科臨床医報, 77 (1), 80-87, (1983)
- 塩瀬芳彦, 眼科臨床医報, 77 (6), 956-961, (1983)
- 前田秀高 ほか, 日本眼科学会雑誌, 101 (3), 227-231, (1997) »PubMed
- Yabuuchi,Y.et al., Jpn J Pharmacol., 24 (6), 853-861, (1974) »DOI
- 新家 真 ほか, 日本眼科学会雑誌, 84 (12), 2085-2091, (1980) »PubMed
- 松生俊和 ほか, 眼科臨床医報, 77 (10), 1654-1657, (1983)
- 渡辺耕三 ほか, 応用薬理, 26 (1), 1-8, (1983)
- 玉置泰裕 ほか, 日本眼科学会雑誌, 100 (1), 55-62, (1996) »PubMed
- Tamaki,Y.et al., Curr Eye Res., 16 (11), 1102-1110, (1997) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
大塚製薬株式会社
医薬情報センター
〒108-8242
東京都港区港南2-16-4 品川グランドセントラルタワー
電話:0120-189-840
FAX:03-6717-1414
千寿製薬株式会社
カスタマーサポート室 受付時間 9:00〜17:30(土、日、祝日を除く)
〒541-0048
大阪市中央区瓦町三丁目1番9号
電話:0120-069-618
FAX:06-6201-0577
製品情報問い合わせ先
大塚製薬株式会社
医薬情報センター
〒108-8242
東京都港区港南2-16-4 品川グランドセントラルタワー
電話:0120-189-840
FAX:03-6717-1414
千寿製薬株式会社
カスタマーサポート室 受付時間 9:00〜17:30(土、日、祝日を除く)
〒541-0048
大阪市中央区瓦町三丁目1番9号
電話:0120-069-618
FAX:06-6201-0577
26. 製造販売業者等
26.1 製造販売元
大塚製薬株式会社
東京都千代田区神田司町2-9
26.2 提携
千寿製薬株式会社
大阪市中央区瓦町三丁目1番9号