医薬品情報
| 総称名 | ドメナン |
|---|---|
| 一般名 | オザグレル塩酸塩水和物 |
| 欧文一般名 | Ozagrel Hydrochloride Hydrate |
| 製剤名 | オザグレル塩酸塩水和物錠 |
| 薬効分類名 | トロンボキサン合成酵素阻害剤 気管支喘息治療剤 |
| 薬効分類番号 | 4490 |
| KEGG DRUG |
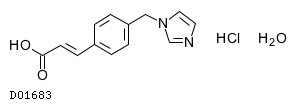
D01683
オザグレル塩酸塩水和物
|
| KEGG DGROUP |
DG01256
オザグレル
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年8月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ドメナン錠100mg | DOMENAN Tablets 100mg | キッセイ薬品工業 | 4490012F1026 | 27.8円/錠 | |
| ドメナン錠200mg | DOMENAN Tablets 200mg | キッセイ薬品工業 | 4490012F2022 | 49.7円/錠 |
2. 禁忌
次の患者には投与しないこと
2.1 小児等[9.7参照]
2.2 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
通常、成人にはオザグレル塩酸塩水和物として1日量400mgを朝食後及び就寝前の2回に分けて経口投与する。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
8. 重要な基本的注意
8.1 本剤は気管支拡張剤、ステロイド剤等と異なり、すでに起こっている発作を緩解する薬剤ではないので、このことは患者に十分説明しておく必要がある。
8.2 本剤を投与中、大発作をみた場合は、気管支拡張剤あるいはステロイド剤を投与する必要がある。
8.3 本剤投与によりステロイド維持量を減量し得た患者で、本剤の投与を中止する場合は、原疾患再発のおそれがあるので、注意すること。
8.4 本剤投与により効果が認められない場合には、漫然と長期にわたり投与しないように注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 出血している患者
出血を助長する可能性がある。
9.1.2 長期ステロイド療法を受けている患者
本剤投与によりステロイドの減量をはかる場合は十分な管理下で徐々に行うこと。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁への移行が認められている。また、ラットの周産期及び授乳期投与において大量投与(1000mg/kg)で新生児に体重増加抑制が報告されている。
9.7 小児等
投与しないこと。小児気管支喘息患者を対象とした臨床試験において、副作用として関節痛が報告されている。[2.1参照]
10. 相互作用
10.2 併用注意
| 抗血小板剤 チクロピジン 血栓溶解剤 ウロキナーゼ 抗凝血剤 ヘパリン ワルファリン | これらの薬剤と併用することにより出血傾向の増強をきたすおそれがある。 観察を十分に行い、用量を調節するなど注意すること。 | 本剤は血小板凝集能を抑制するため、類似の作用を持つ薬剤を併用することにより作用を増強する可能性がある。 |
11. 副作用
11.2 その他の副作用
| 1%未満 | 頻度不明 | |
| 過敏症 | 発疹、そう痒 | |
| 消化器 | 嘔気、胃・腹部不快感、嘔吐、腹痛、食欲不振、便秘 | 下痢、腹部膨満感 |
| 肝臓 | AST・ALTの上昇等 | アルカリフォスファターゼの上昇 |
| 循環器 | 心悸亢進 | |
| 血液 | 出血傾向 | 血小板減少 |
| 精神神経系 | 頭痛、眠気、しびれ感 | めまい、振戦 |
| その他 | 浮腫、発熱、倦怠感 | 下肢痛、筋肉痛、胸部圧迫感、関節痛、月経異常(月経過多・月経延長) |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
健康成人に200mgを単回経口投与すると、血漿中濃度は約1.3時間で最高に達し、その濃度は約1.9μg/mLで、血漿中半減期は約1.45時間である1)。
| 薬物・代謝物 | Tmax(hr) | Cmax(ng/mL) | AUC(ng・hr/mL) | T1/2(hr) |
| オザグレル | 1.3 | 1928.8 | 3913.2 | 1.45 |
| M-1 | 1.5 | 1821.9 | 4151.7 | − |
| M-2 | 1.5 | 587.3 | 1132.5 | − |
16.4 代謝
血漿中及び尿中主要代謝物は、プロペン酸部のβ酸化体(M-1)及び還元体(M-2)である。
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内後期第II相臨床試験
成人気管支喘息患者266例を対象に、本剤1回100mg1日4回注)(400mg/日:L群)と1回200mg1日2回(400mg/日:H群)及びプラセボ(P群)を4週間投与にて二重盲検比較試験を行った。最終全般改善度を、著明改善、中等度改善、軽度改善、不変、軽度悪化、中等度悪化、著明悪化の7段階区分にて評価した結果、中等度改善以上の改善率はP群16.5%(13/79例)、L群42.5%(34/80例)、H群48.1%(39/81例)であり、L群、H群ともP群と比較して有意に高かった。副作用はP群2.3%(2/87例)、L群1.1%(1/90例)、H群2.2%(2/89例)にみられた。副作用の内訳はL群にて高度の皮疹1.1%(1/90例)、H群にて軽度の悪心、嘔吐、顔面のしびれ各1.1%(1/89例)であった3)。
17.1.2 国内第III相二重盲検試験
成人気管支喘息患者234例を対象に、本剤1回200mg1日2回(400mg/日)又はアゼラスチン塩酸塩1回2mg1日2回(4mg/日)を8週間投与にて二重盲検比較試験を行った。最終全般改善度を、著明改善、中等度改善、軽度改善、不変、軽度悪化、中等度悪化、著明悪化の7段階区分にて評価した結果、中等度改善以上の改善率は本剤群35.8%(38/106例)、アゼラスチン塩酸塩群24.3%(25/103例)であり、本剤群が有意に高かった。副作用は本剤群7.0%(8/115例)、アゼラスチン塩酸塩群18.5%(22/119例)にみられた。本剤群における副作用の内訳はGPT上昇2.6%(3/115例)、GOT上昇1.7%(2/115例)、眠気、全身倦怠感、悪心、嘔吐、便秘、腹痛、食欲不振各0.9%(1/115例)であった4)。
17.1.3 国内第III相一般臨床試験
17.1.4 国内第III相長期投与試験
成人気管支喘息患者94例を対象に、本剤1回200mg1日2回(400mg/日)を24週間以上を目標として投与した長期投与試験において、最終全般改善度を、著明改善、中等度改善、軽度改善、不変、軽度悪化、中等度悪化、著明悪化の7段階区分にて評価した。投与期間は12週未満5例、12週以上24週未満8例、24週以上36週未満56例、36週以上25例であった。中等度改善以上の改善率は48.9%(45/92例)であった。副作用は5.3%(5/94例)にみられ、その内訳は血清脂質代謝異常2.1%(2/94例)、PTの延長、肝機能異常、発熱、心悸亢進、顔面浮腫各1.1%(1/94例)であった11)12)13)14)。
注)本剤の承認されている用法及び用量は「通常、成人にはオザグレル塩酸塩水和物として1日量400mgを朝食後及び就寝前の2回に分けて経口投与する。なお、年齢、症状により適宜増減する。」である。
18. 薬効薬理
18.1 作用機序
本剤はトロンボキサン合成酵素を選択的に阻害してトロンボキサンA2の産生を抑制することにより、気管支喘息の基本的病態である気道過敏性を抑制し、また、気道収縮も抑制する。
18.2 アラキドン酸代謝酵素に対する作用
18.3 トロンボキサンA2の産生抑制作用
18.3.1 気管支喘息患者に経口投与すると、血漿中トロンボキサンA2量の低下傾向が認められる18)。
18.4 気道過敏性抑制作用
18.4.1 気管支喘息患者に経口投与すると、アセチルコリン又はロイコトリエンD4吸入誘発試験において、気道過敏性を改善する23)。
18.5 気道収縮抑制作用
19. 有効成分に関する理化学的知見
19.1. オザグレル塩酸塩水和物
20. 取扱い上の注意
アルミピロー包装開封後は遮光して保存すること。
22. 包装
<ドメナン錠100mg>
100錠[10錠(PTP)×10]
<ドメナン錠200mg>
100錠[10錠(PTP)×10]
23. 主要文献
- 福島雅夫ほか, 基礎と臨床, 24 (6), 3215-3237, (1990)
- 清水正郎ほか, 医薬品研究, 17 (2), 298-309, (1986)
- 宮本昭正ほか, 医学のあゆみ, 154 (5・6), 385-406, (1990)
- 牧野荘平ほか, 臨床医薬, 6 (10), 2131-2166, (1990)
- 真野健次ほか, 医学と薬学, 23 (6), 1339-1356, (1990)
- 高納修ほか, 基礎と臨床, 24 (6), 3254-3267, (1990)
- 佐竹辰夫ほか, 診療と新薬, 27 (7), 1147-1163, (1990)
- 川合満ほか, Ther.Res., 11 (7), 2331-2344, (1990)
- 牧野荘平ほか, 医学と薬学, 24 (1), 164-179, (1990)
- 藤村政樹ほか, 新薬と臨床, 39 (7), 1331-1345, (1990)
- 滝島任ほか, 診療と新薬, 27 (6), 1049-1063, (1990)
- 高橋昭三ほか, 臨床医薬, 6 (6), 1241-1263, (1990)
- 中島道郎ほか, 診療と新薬, 27 (5), 767-789, (1990)
- 長野準ほか, 診療と新薬, 27 (6), 1065-1076, (1990)
- Hiraku S,et al., Jpn.J.Pharmacol., 41 (3), 393-401, (1986) »PubMed
- Naito J,et al., Eur.J.Pharmacol., 91 (1), 41-48, (1983) »PubMed
- 竹花泰雄ほか, 基礎と臨床, 24 (5), 2707-2714, (1990)
- 木野稔也ほか, アレルギーの臨床, 11 (3), 217-220, (1991)
- Komatsu H,et al., Eur.J.Pharmacol., 184 (1), 87-95, (1990) »PubMed
- 竹花泰雄ほか, 日薬理誌, 95 (3), 121-130, (1990) »PubMed
- Nanbu F,et al., Prostaglandins., 39 (6), 623-637, (1990)
- 竹花泰雄ほか, 日薬理誌, 95 (1), 21-30, (1990) »PubMed
- 湯川龍雄ほか, 日胸疾会誌, 25 (12), 1309-1314, (1987) »DOI
- Takehana Y,et al., Jpn.J.Pharmacol., 52 (4), 621-630, (1990) »PubMed
- 南部文男ほか, 日薬理誌, 95 (5), 271-277, (1990) »PubMed
- Chung KF,et al., Am.Rev.Respir.Dis., 134 (2), 258-261, (1986) »PubMed
- 南部文男ほか, 応用薬理, 39 (4), 397-404, (1990)
24. 文献請求先及び問い合わせ先
文献請求先
キッセイ薬品工業株式会社
くすり相談センター
〒112-0002
東京都文京区小石川3丁目1番3号
電話:フリーダイヤル:0120-007-622
製品情報問い合わせ先
キッセイ薬品工業株式会社
くすり相談センター
〒112-0002
東京都文京区小石川3丁目1番3号
電話:フリーダイヤル:0120-007-622
26. 製造販売業者等
26.1 製造販売元
キッセイ薬品工業株式会社
松本市芳野19番48号