医薬品情報
| 総称名 | アデカット |
|---|---|
| 一般名 | デラプリル塩酸塩 |
| 欧文一般名 | Delapril Hydrochloride |
| 製剤名 | デラプリル塩酸塩錠 |
| 薬効分類名 | ACE-I注1)降圧剤 注1)ACE-I:アンジオテンシンI変換酵素阻害剤 |
| 薬効分類番号 | 2144 |
| ATCコード | C09AA12 |
| KEGG DRUG |
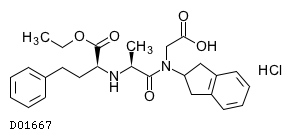
D01667
デラプリル塩酸塩
|
| KEGG DGROUP |
DG01501
アンジオテンシン変換酵素(ACE)阻害薬
DG03231
血圧降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年12月 改訂(第5版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アデカット7.5mg錠 | ADECUT TABLETS | T’s製薬 | 2144004F1023 | 14.4円/錠 | 処方箋医薬品注2) |
| アデカット15mg錠 | ADECUT TABLETS | T’s製薬 | 2144004F2020 | 21.1円/錠 | 処方箋医薬品注2) |
| アデカット30mg錠 | ADECUT TABLETS | T’s製薬 | 2144004F3026 | 30.1円/錠 | 処方箋医薬品注2) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 血管性浮腫の既往歴のある患者(アンジオテンシン変換酵素阻害剤等の薬剤による血管性浮腫、遺伝性血管性浮腫、後天性血管性浮腫、特発性血管性浮腫等)[高度の呼吸困難を伴う血管性浮腫があらわれることがある。][11.1.1参照]
2.3 デキストラン硫酸固定化セルロース、トリプトファン固定化ポリビニルアルコール又はポリエチレンテレフタレートを用いた吸着器によるアフェレーシスを施行中の患者[10.1参照]
2.4 アクリロニトリルメタリルスルホン酸ナトリウム膜(AN69)を用いた血液透析施行中の患者[10.1参照]
2.5 妊婦又は妊娠している可能性のある女性[9.5参照]
2.6 アリスキレンフマル酸塩を投与中の糖尿病患者(ただし、他の降圧治療を行ってもなお血圧のコントロールが著しく不良の患者を除く)[10.1参照]
2.7 サクビトリルバルサルタンナトリウム水和物を投与中の患者、又は投与中止から36時間以内の患者[10.1参照]
4. 効能または効果
6. 用法及び用量
成人には、デラプリル塩酸塩として通常1日30〜60mgを朝夕の2回に分割経口投与する。ただし、1日15mg(分2)から投与を開始し、最大投与量は1日120mg(分2)とする。
なお、安定した降圧効果が得られた場合には、1日量またはその半量の朝1回のみの投与とすることができる。
なお、安定した降圧効果が得られた場合には、1日量またはその半量の朝1回のみの投与とすることができる。
8. 重要な基本的注意
8.1 降圧作用に基づくめまい、ふらつきがあらわれることがあるので、高所作業、自動車の運転等危険を伴う機械を操作する際には注意させること。
8.2 手術前24時間は投与しないことが望ましい。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 両側性腎動脈狭窄のある患者又は片腎で腎動脈狭窄のある患者
治療上やむを得ないと判断される場合を除き、使用は避けること。腎血流量の減少や糸球体ろ過圧の低下により急速に腎機能を悪化させるおそれがある。
9.1.2 高カリウム血症の患者
治療上やむを得ないと判断される場合を除き、使用は避けること。高カリウム血症を増悪させるおそれがある。
また、腎機能障害、コントロール不良の糖尿病等により血清カリウム値が高くなりやすい患者では、血清カリウム値に注意すること。
また、腎機能障害、コントロール不良の糖尿病等により血清カリウム値が高くなりやすい患者では、血清カリウム値に注意すること。
9.1.3 脳血管障害のある患者
過度の降圧が脳血流不全を惹起し、病態を悪化させることがある。
9.1.4 重症の高血圧症患者
少量より開始し、増量する場合は患者の状態を十分に観察しながら徐々に行うこと。まれに急激な血圧低下を起こすおそれがある。
9.1.5 厳重な減塩療法中の患者
少量より開始し、増量する場合は患者の状態を十分に観察しながら徐々に行うこと。まれに急激な血圧低下を起こすおそれがある。
9.1.6 薬剤過敏症の既往歴のある患者
9.1.7 大動脈弁狭窄症又は閉塞性肥大型心筋症のある患者
過度の血圧低下を来し、症状を悪化させるおそれがある。
9.2 腎機能障害患者
9.2.1 重篤な腎機能障害のある患者
血清クレアチニン値が3mg/dL以上の患者に投与する場合には、投与量を減らすか又は投与間隔をのばすなど慎重に投与すること。腎機能の悪化、血中半減期の延長及び尿中排泄率の低下が起こるおそれがある。
9.2.2 血液透析中の患者
少量より開始し、増量する場合は患者の状態を十分に観察しながら徐々に行うこと。まれに急激な血圧低下を起こすおそれがある。
9.4 生殖能を有する者
9.4.1 妊娠する可能性のある女性
妊娠していることが把握されずアンジオテンシン変換酵素阻害剤又はアンジオテンシンII受容体拮抗剤を使用し、胎児・新生児への影響(腎不全、頭蓋・肺・腎の形成不全、死亡等)が認められた例が報告されている1)2)。
本剤の投与に先立ち、代替薬の有無等も考慮して本剤投与の必要性を慎重に検討し、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。また、投与が必要な場合には次の注意事項に留意すること。[9.5参照]
本剤の投与に先立ち、代替薬の有無等も考慮して本剤投与の必要性を慎重に検討し、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。また、投与が必要な場合には次の注意事項に留意すること。[9.5参照]
(1)本剤投与開始前に妊娠していないことを確認すること。本剤投与中も、妊娠していないことを定期的に確認すること。投与中に妊娠が判明した場合には、直ちに投与を中止すること。
(2)次の事項について、本剤投与開始時に患者に説明すること。また、投与中も必要に応じ説明すること。
・妊娠中に本剤を使用した場合、胎児・新生児に影響を及ぼすリスクがあること。
・妊娠が判明した又は疑われる場合は、速やかに担当医に相談すること。
・妊娠を計画する場合は、担当医に相談すること。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。投与中に妊娠が判明した場合には、直ちに投与を中止すること。妊娠中期及び末期にアンジオテンシン変換酵素阻害剤又はアンジオテンシンII受容体拮抗剤を投与された患者で羊水過少症、胎児・新生児の死亡、新生児の低血圧、腎不全、高カリウム血症、頭蓋の形成不全及び羊水過少症によると推測される四肢の拘縮、頭蓋顔面の変形、肺の低形成等があらわれたとの報告がある。また、海外で実施されたレトロスペクティブな疫学調査で、妊娠初期にアンジオテンシン変換酵素阻害剤を投与された患者群において、胎児奇形の相対リスクは降圧剤が投与されていない患者群に比べ高かったとの報告がある。[2.5、9.4.1参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物試験(ラット)で乳汁中への活性代謝物の移行が認められている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
低用量から投与を開始するなど患者の状態を観察しながら慎重に投与すること。一般に過度の降圧は好ましくないとされている。脳梗塞等が起こるおそれがある。
10. 相互作用
10.1 併用禁忌
| デキストラン硫酸固定化セルロース、トリプトファン固定化ポリビニルアルコール又はポリエチレンテレフタレートを用いた吸着器によるアフェレーシスの施行 リポソーバー イムソーバTR セルソーバ [2.3参照] | アンジオテンシン変換酵素阻害剤服用中の患者は、左記のアフェレーシス中にショックを起こすことがある。 | 陰性に荷電したデキストラン硫酸固定化セルロース、トリプトファン固定化ポリビニルアルコール又はポリエチレンテレフタレートにより血中キニン系の代謝が亢進し、本剤によりブラジキニンの代謝が妨げられ蓄積することが考えられている。 |
| アクリロニトリルメタリルスルホン酸ナトリウム膜(AN69)を用いた透析 [2.4参照] | アンジオテンシン変換酵素阻害剤服用中の患者は、左記の透析中にアナフィラキシーを起こすことがある。 | 多価イオン体であるAN69により血中キニン系の代謝が亢進し、本剤によりブラジキニンの代謝が妨げられ蓄積することが考えられている。 |
| アリスキレンフマル酸塩 ラジレス (糖尿病患者に使用する場合。ただし、他の降圧治療を行ってもなお血圧のコントロールが著しく不良の患者を除く) [2.6参照] | 非致死性脳卒中、腎機能障害、高カリウム血症及び低血圧のリスク増加が報告されている。 | レニン−アンジオテンシン系阻害作用が増強される可能性がある。 |
| サクビトリルバルサルタンナトリウム水和物 エンレスト [2.7参照] | 血管性浮腫があらわれるおそれがある。 左記薬剤を投与する場合は、本剤を少なくとも36時間前に中止すること。 また、左記薬剤の投与終了後に本剤を投与する場合は、36時間以上の間隔をあけること。 | 併用により相加的にブラジキニンの分解を抑制し、血管性浮腫のリスクを増加させる可能性がある。 |
10.2 併用注意
| カリウム保持性利尿剤 スピロノラクトン トリアムテレン等 エプレレノン カリウム補給剤 トリメトプリム含有製剤 スルファメトキサゾール・トリメトプリム | 血清カリウム値が上昇することがある。 | 本剤のアルドステロン分泌抑制作用によりカリウム貯留作用が増強することによる。 危険因子:特に腎機能障害のある患者 |
| 利尿降圧剤 フロセミド トリクロルメチアジド等 | 利尿降圧剤で治療を受けている患者に本剤を初めて投与する場合、降圧作用が増強するおそれがあるので、少量から開始するなど慎重に投与すること。 | 利尿降圧剤で治療を受けている患者にはレニン活性が亢進している患者が多く、本剤が奏効しやすい。 危険因子:特に最近利尿降圧剤投与を開始した患者 |
| アリスキレンフマル酸塩 | 腎機能障害、高カリウム血症及び低血圧を起こすおそれがある。eGFRが60mL/min/1.73m2未満の腎機能障害のある患者へのアリスキレンフマル酸塩との併用については、治療上やむを得ないと判断される場合を除き避けること。 | レニン−アンジオテンシン系阻害作用が増強される可能性がある。 |
| アンジオテンシンII受容体拮抗剤 | 腎機能障害、高カリウム血症及び低血圧を起こすおそれがある。 | レニン−アンジオテンシン系阻害作用が増強される可能性がある。 |
| リチウム | 外国において、リチウムと他のアンジオテンシン変換酵素阻害剤(カプトプリル、エナラプリルマレイン酸塩、リシノプリル水和物)との併用により、リチウム中毒が報告されている。 | 腎尿細管におけるリチウムの再吸収が促進される。 |
| 非ステロイド性消炎鎮痛剤(NSAIDs) インドメタシン等 | 降圧作用が減弱することがある。 | 非ステロイド性消炎鎮痛剤がプロスタグランジンの合成を阻害し、本剤のプロスタグランジンを介した降圧作用を減弱させる。 |
| 非ステロイド性消炎鎮痛剤(NSAIDs) インドメタシン等 | 腎障害のある患者では、さらに腎機能が悪化するおそれがある。 | 非ステロイド性消炎鎮痛剤のプロスタグランジン合成阻害作用により、腎血流量が低下するためと考えられている。 |
| カリジノゲナーゼ製剤 | 過度の血圧低下が引き起こされる可能性がある。 | 本剤のキニン分解抑制作用とカリジノゲナーゼ製剤のキニン産生作用により、血管平滑筋の弛緩が増強される可能性がある。 |
| mTOR阻害剤 シロリムス等 | 血管性浮腫を発症するリスクが高まるおそれがある。 | 機序不明 |
| ビルダグリプチン | 血管性浮腫を発症するリスクが高まるおそれがある。 | 機序不明 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 血管性浮腫(頻度不明)
呼吸困難を伴う顔面、舌、声門、喉頭の腫脹を症状とする血管性浮腫があらわれることがあるので、このような場合には、直ちに投与を中止し、アドレナリン注射、気道確保などの適切な処置を行うこと。また、腹痛、嘔気、嘔吐、下痢等を伴う腸管血管性浮腫があらわれることがある。[2.2参照]
11.1.2 急性腎障害(頻度不明)
11.1.3 高カリウム血症(0.1%未満)
11.2 その他の副作用
| 0.1〜5%未満 | 頻度不明 | |
| 過敏症 | 発疹、そう痒 | 乾癬 |
| 精神神経系 | めまい・ふらつき、立ちくらみ、頭痛、頭重、不眠、眠気、肩こり、しびれ感、耳鳴 | |
| 消化器 | 悪心、嘔吐、食欲不振、胃部不快感、胸やけ、下痢、便秘 | 腹痛、口渇、口内炎、味覚異常、腹部膨満感 |
| 循環器 | ほてり、のぼせ感、動悸 | 胸部痛 |
| 血液 | 白血球減少、貧血、好酸球増多 | 血小板減少 |
| 肝臓 | AST、ALT、Al-P、LDH、γ-GTPの上昇 | 黄疸 |
| 腎臓 | BUN、クレアチニンの上昇、蛋白尿 | |
| その他 | 咳、咽頭痛、倦怠感、発汗、血清カリウム、総コレステロール、尿酸の上昇、尿糖、抗核抗体の陽性、息切れ、浮腫、四肢の疼痛、筋痙攣 | 脱力感、嗄声、低血糖注) |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 外国において、インスリン又は経口血糖降下剤の投与中にアンジオテンシン変換酵素阻害剤を投与することにより、低血糖が起こりやすいとの報告がある。
15.1.2 外国において、アンジオテンシン変換酵素阻害剤服用中の患者が膜翅目毒(ハチ毒)による脱感作中にアナフィラキシーを発現したとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
腎機能正常の本態性高血圧症患者(4例)に1回30mgを空腹時に経口投与した場合、血中にはデラプリル塩酸塩の未変化体及び代謝物が検出される。
最高血中濃度は活性代謝物M-Iが最も高く、次いで未変化体及び活性代謝物M-III(M-Iより活性はやや弱い)であり、非活性代謝物M-IIは最も低い。また、one compartment open modelにより算出したpharmacokinetic parameterでは、主要活性代謝物M-Iは1.6時間でピーク(731ng/mL)に達し、半減期は1.1時間である3)。
最高血中濃度は活性代謝物M-Iが最も高く、次いで未変化体及び活性代謝物M-III(M-Iより活性はやや弱い)であり、非活性代謝物M-IIは最も低い。また、one compartment open modelにより算出したpharmacokinetic parameterでは、主要活性代謝物M-Iは1.6時間でピーク(731ng/mL)に達し、半減期は1.1時間である3)。
なお、主要活性代謝物M-Iの血中濃度には、7.5〜60mgの範囲内で用量依存性が認められる4)(健康成人、経口)。
16.1.2 反復投与
腎機能正常の高血圧症患者(9例)及び腎機能障害を伴う高血圧症患者(4例)に、1日60mg(分2)を8日間反復経口投与した時の主要活性代謝物M-Iの血中濃度から、蓄積性は認められない。しかし、腎機能障害者の血中濃度は、正常例に比し半減期の延長と最高血中濃度の増大が認められる。
16.4 代謝
16.5 排泄
腎機能正常の本態性高血圧症患者(4例)に1回30mgを経口投与した場合、尿中にはM-I、M-IIIが大半を占め、未変化体及びM-IIはわずかであり、投与後24時間までの尿中総排泄率は58.7%である3)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II/III相試験
18. 薬効薬理
18.1 作用機序
18.2 降圧作用
19. 有効成分に関する理化学的知見
19.1. デラプリル塩酸塩
22. 包装
<アデカット7.5mg錠>
100錠[10錠(PTP)×10、乾燥剤入り]
<アデカット15mg錠>
100錠[10錠(PTP)×10、乾燥剤入り]
<アデカット30mg錠>
100錠[10錠(PTP)×10、乾燥剤入り]
23. 主要文献
- 阿部真也 他, 周産期医学, 47, 1353-1355, (2017)
- 齊藤大祐 他, 鹿児島産科婦人科学会雑誌, 29, 49-54, (2021)
- 東 純一 他, 基礎と臨床, 23, 895-898, (1989)
- 荻原俊男 他, 薬理と治療, 11, 4663-4681, (1983)
- 吉田清志 他, 薬理と治療, 13, 7151-7165, (1985)
- 立野政雄 他, 薬理と治療, 14, 4225-4231, (1986)
- 熊原雄一 他, 臨床医薬, 3, 325-336, (1987)
- 土井 豊 他, 臨牀と研究, 64, 2264-2278, (1987)
- 宮口和彦 他, 薬理と治療, 15, 1549-1559, (1987)
- 吉永 馨 他, 薬理と治療, 15, 1561-1584, (1987)
- 金子好宏 他, 薬理と治療, 15, 1585-1602, (1987)
- 国府達郎 他, 薬理と治療, 15, 1603-1625, (1987)
- 小野山薫 他, 基礎と臨床, 21, 3559-3581, (1987)
- 戸山靖一 他, 基礎と臨床, 21, 3583-3595, (1987)
- 荒川規矩男 他, 臨床医薬, 3, 307-324, (1987)
- 佐伯清美 他, 臨床医薬, 3, 447-463, (1987)
- 稲田義行 他, Jpn.J.Pharmacol., 42, 99-108, (1986) »PubMed
- 稲田義行 他, Jpn.J.Pharmacol., 42, 1-8, (1986) »PubMed
- 稲田義行 他, 薬理と治療, 16, 4093-4101, (1988)
- 塩之入洋 他, Clin.Pharmacol.Ther., 41, 74-79, (1987) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
T's製薬株式会社
ティーズDIセンター
〒451-0045
名古屋市西区名駅二丁目27番8号
電話:0120-923-093 受付時間 9:00〜17:30(土日祝日・弊社休業日を除く)
製品情報問い合わせ先
T's製薬株式会社
ティーズDIセンター
〒451-0045
名古屋市西区名駅二丁目27番8号
電話:0120-923-093 受付時間 9:00〜17:30(土日祝日・弊社休業日を除く)
26. 製造販売業者等
26.1 製造販売元
T's製薬株式会社
大阪市中央区道修町四丁目1番1号
26.2 販売
武田薬品工業株式会社
大阪市中央区道修町四丁目1番1号