医薬品情報
| 総称名 | サンテゾーン |
|---|---|
| 一般名 | デキサメタゾン |
| 欧文一般名 | Dexamethasone |
| 製剤名 | デキサメタゾン眼軟膏 |
| 薬効分類名 | 副腎皮質ホルモン点眼剤 |
| 薬効分類番号 | 1315 |
| ATCコード | S01BA01 S01CB01 |
| KEGG DRUG |
D00292
デキサメタゾン
|
| KEGG DGROUP |
DG00011
デキサメタゾン
DG01955
副腎皮質ステロイド
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年12月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| サンテゾーン0.05%眼軟膏 (後発品) | Santeson ophthalmic ointment | 参天製薬 | 1315700M1026 | 42.5円/g |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
外眼部および前眼部の炎症性疾患の対症療法
(眼瞼炎、結膜炎、角膜炎、強膜炎、上強膜炎、前眼部ブドウ膜炎、術後炎症)
(眼瞼炎、結膜炎、角膜炎、強膜炎、上強膜炎、前眼部ブドウ膜炎、術後炎症)
6. 用法及び用量
通常、1日1〜3回、適量を塗布する。なお、症状により適宜増減する。
8. 重要な基本的注意
8.1 連用により、数週後から眼内圧亢進、緑内障があらわれることがあるので、定期的に眼内圧検査を実施すること。[11.1.1参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 角膜上皮剥離又は角膜潰瘍のある患者
治療上やむを得ないと判断される場合を除き、投与しないこと。症状が増悪するおそれがある。また、角膜穿孔を生ずるおそれがある。[11.1.3参照]
9.1.2 ウイルス性結膜・角膜疾患、結核性眼疾患、真菌性眼疾患又は化膿性眼疾患のある患者
治療上やむを得ないと判断される場合を除き、投与しないこと。症状が増悪するおそれがある。また、角膜穿孔を生ずるおそれがある。[11.1.3参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。長期・頻回投与を避けること。
9.7 小児等
特に2歳未満の場合には、慎重に投与すること。小児等を対象とした臨床試験は実施していない。
9.8 高齢者
一般に生理機能が低下している。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 緑内障(頻度不明)
連用により、数週後から眼内圧亢進、緑内障があらわれることがある。[8.1参照]
11.1.2 角膜ヘルペス、角膜真菌症、緑膿菌感染症(いずれも頻度不明)
角膜ヘルペス、角膜真菌症、緑膿菌感染症等を誘発することがある。
11.1.3 穿孔(頻度不明)
11.1.4 後嚢下白内障(頻度不明)
長期投与により、後嚢下白内障があらわれることがある。
11.2 その他の副作用
| 頻度不明 | |
| 眼 | 眼刺激 |
| 下垂体・副腎皮質系機能(長期連用した場合) | 下垂体・副腎皮質系機能の抑制 |
| その他 | 創傷治癒の遅延 |
14. 適用上の注意
14.1 薬剤交付時の注意
患者に対し以下の点に注意するよう指導すること。
<投与方法共通>
・薬剤汚染防止のため、塗布するとき、容器の先端が直接目に触れないように注意すること。
・他の点眼剤を併用する場合には、本剤を最後に使用すること。その際、少なくとも5分以上間隔をあけること。
<結膜嚢内に塗布する場合>
・患眼を開瞼して結膜嚢内に塗布し、閉瞼して軟膏が全体に広がった後、開瞼すること。
・軟膏が眼瞼皮膚等についた場合には、すぐにふき取ること。
16. 薬物動態
16.3 分布
白色ウサギに0.1%3H-デキサメタゾン懸濁液25μLを点眼し、各眼組織中濃度を測定した。結膜では点眼5分後に最高値5.2μg/gに到達した後、急速に減少し、点眼45分後からは指数関数的に減少した。角膜では、点眼5分後に最高値4.07μg/gに到達した後、指数関数的に減少した。房水では、45分後に最高値0.21μg/gに到達した後、指数関数的に減少した。また、点眼30分後の各眼組織中濃度は、角膜、強膜等の前眼部・外眼部では比較的高く、硝子体、網脈絡膜等の後眼部では低かった1)。
18. 薬効薬理
18.1 作用機序
18.2 抗炎症作用
・デキサメタゾンの抗炎症作用の強さはヒドロコルチゾンの25倍、プレドニゾロンの6倍で、ベタメタゾンとは同程度とされている4)。
・ウサギ硝子体内に起炎剤(アジュバント)を投与して惹起させたブドウ膜炎に対するデキサメタゾンの作用を検討した。1%デキサメタゾン懸濁液を起炎剤投与1時間前と投与1、3、5、7時間後に各2滴ずつ点眼すると、起炎剤投与24時間後の炎症ピーク時の房水蛋白濃度の増加、房水中への白血球遊走、虹彩毛様体の腫脹をいずれも有意に抑制した5)。
・ウサギ硝子体にフェリチンを投与して惹起させた実験的ブドウ膜炎に対し、0.1%デキサメタゾン液を1回0.5mL、1日1回結膜下注射したところ、虹彩の充血や硝子体の細胞浸潤などの炎症症状や房水内蛋白濃度を明らかに抑制した6)。
18.3 抗アレルギー作用
抗血清0.05mLを結膜内注射して感作させたラットに、抗原として20%卵白アルブミン溶液10μLを点眼することによって惹起した受身アナフィラキシーに対するデキサメタゾンの抑制効果を検討した。0.1%デキサメタゾンを抗原点眼前1,2,3,4,5時間の計5回点眼したときの抑制率は57.1%であった7)。
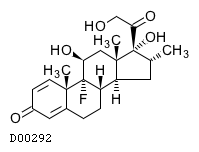
19. 有効成分に関する理化学的知見
19.1. デキサメタゾン
22. 包装
3.5gチューブ入×10本
23. 主要文献
- Yamauchi,H.et al., Jpn.J.Ophthalmol., 19, 339-347, (1975)
- 第十八改正日本薬局方解説書, C3305-3313, (2021), (廣川書店)
- 第十八改正日本薬局方解説書, C4346-4353, (2021), (廣川書店)
- 高折修二他, グッドマン・ギルマン薬理書 第13版, 1393-1410, (2022), (廣川書店)
- 山内秀泰他, 日本薬理学会雑誌, 75, 185-190, (1979) »PubMed
- Gnad,H.D.et.al., Ophthal.Res., 5, 204-214, (1973)
- Iso,T.et al., Ophthal.Res., 12, 9-15, (1980)
24. 文献請求先及び問い合わせ先
文献請求先
参天製薬株式会社
製品情報センター 受付時間 9:00〜17:00(土・日・祝日を除く)
〒530-8552(個別郵便番号)
大阪市北区大深町4-20
電話:0120-921-839
06-7664-8624
06-7664-8624
製品情報問い合わせ先
参天製薬株式会社
製品情報センター 受付時間 9:00〜17:00(土・日・祝日を除く)
〒530-8552(個別郵便番号)
大阪市北区大深町4-20
電話:0120-921-839
06-7664-8624
06-7664-8624
26. 製造販売業者等
26.1 製造販売元
参天製薬株式会社
大阪市北区大深町4-20