医薬品情報
| 総称名 | デルモゾール |
|---|---|
| 一般名 | ベタメタゾン吉草酸エステル ゲンタマイシン硫酸塩 |
| 欧文一般名 | Betamethasone Valerate Gentamicin Sulfate |
| 製剤名 | ベタメタゾン吉草酸エステル・ゲンタマイシン硫酸塩ローション |
| 薬効分類名 | 副腎皮質ホルモン・抗生物質配合外用剤 |
| 薬効分類番号 | 2647 |
| KEGG DRUG |
D04773
ベタメタゾン吉草酸エステル・ゲンタマイシン硫酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年8月 改訂(第1版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
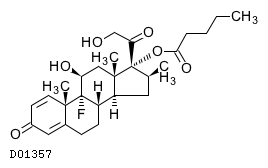
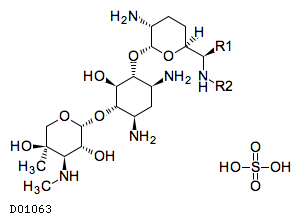
| デルモゾールGローション | Dermosol-G Lotion | 岩城製薬 | 2647709Q1031 | 27.7円/mL |
2. 禁忌
次の患者には投与しないこと
2.1 ゲンタマイシン耐性菌又は非感性菌による皮膚感染のある場合[皮膚感染が増悪するおそれがある。]
2.2 真菌・スピロヘータ・ウイルス皮膚感染症及び動物性皮膚疾患(疥癬、けじらみ等)[これらの疾患が増悪するおそれがある。]
2.3 本剤の成分に対し過敏症の既往歴のある患者
2.4 鼓膜に穿孔のある湿疹性外耳道炎[穿孔部位の治癒の遅延及び感染のおそれがある。]
2.5 潰瘍(ベーチェット病は除く)、第2度深在性以上の熱傷・凍傷[皮膚の再生が抑制され、治癒が遅延するおそれがある。]
2.6 ストレプトマイシン、カナマイシン、ゲンタマイシン、フラジオマイシン等のアミノグリコシド系抗生物質又はバシトラシンに対し過敏症の既往歴のある患者
4. 効能または効果
5. 効能または効果に関連する注意
湿疹・皮膚炎群、乾癬、掌蹠膿疱症に対しては、湿潤、びらん、結痂を伴うか、又は二次感染を併発しているものにのみ使用し、これらの症状が改善した場合には、速やかに使用を中止し、抗生物質を含有しない薬剤に切り替えること。
6. 用法及び用量
通常1日1〜数回適量を塗布する。
なお、症状により適宜増減する。
なお、症状により適宜増減する。
8. 重要な基本的注意
8.1 感作されるおそれがあるので、観察を十分に行い感作されたことを示す兆候(そう痒、発赤、腫脹、丘疹、小水疱等)があらわれた場合には使用を中止すること。
8.3 症状改善後は、できるだけ速やかに使用を中止すること。
8.4 長期連用を避けること。[11.2参照]
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性に対しては大量又は長期にわたる広範囲の使用を避けること。[8.2参照]
9.7 小児等
9.8 高齢者
大量又は長期にわたる広範囲の使用に際しては特に注意すること。一般に副作用があらわれやすい。[8.2参照]
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 眼圧亢進、緑内障、後嚢白内障(いずれも頻度不明)
11.2 その他の副作用
| 0.1〜5%未満注1) | 頻度不明 | |
| 過敏症 | 皮膚の刺激感、接触性皮膚炎、発疹 | |
| 眼 | 中心性漿液性網脈絡膜症 | |
| 皮膚 | 魚鱗癬様皮膚変化 | |
| 皮膚の感染症注2) | ゲンタマイシン耐性菌又は非感性菌による感染症、真菌症(カンジダ症、白癬等)、ウイルス感染症 | |
| その他の皮膚症状注3) | ざ瘡様発疹、酒さ様皮膚炎・口囲皮膚炎(ほほ、口囲等に潮紅、丘疹、膿疱、毛細血管拡張)、ステロイド皮膚(皮膚萎縮、毛細血管拡張、紫斑)、多毛、色素脱失 | |
| 下垂体・副腎皮質系 | 下垂体・副腎皮質系機能の抑制注4) | |
| 長期連用注5) | 腎障害、難聴 |
14. 適用上の注意
14.1 薬剤交付時の注意
患者に対し以下の点に注意するよう指導すること。
14.1.1 使用時
(1)よく振って使用すること。
(2)化粧下、ひげそり後等に使用することのないよう注意すること。
14.1.2 使用部位
眼科用として使用しないこと。
16. 薬物動態
16.2 吸収
正常なヒト腋窩皮膚に0.15%3H-標識ベタメタゾン吉草酸エステル注)クリームを30分、1時間、2時間、4時間、8時間密封法(ODT)により塗布後、薬剤を除去し、オートラジオグラフ法により経表皮吸収及び経皮膚付属器官吸収を検討した結果、共に吸収が良好であった3)。
| 部位\密封(ODT)時間 | 30分 | 1時間 | 2時間 | 4時間 | 8時間 |
| 角質層 | − | + | + | − | + |
| マルピギー層 | − | + | + | ++ | + |
| 毛嚢壁(外側) | + | + | ++ | ++ | ++ |
| 毛嚢壁(内側) | − | + | + | ++ | ++ |
| 皮脂腺 | ? | + | + | ++ | ++ |
| アポクリン腺細胞 | + | + | + | ++ | ++ |
| アポクリン腺腔 | − | − | − | ++ | − |
16.5 排泄
乾癬患者2例及び天疱瘡患者1例に0.1%3H-標識ベタメタゾン吉草酸エステル注)軟膏を密封法(ODT)により塗布した場合、7日間の尿中回収率は塗布量の2.0〜18.5%であった4)(外国人データ)。
| 疾患名 | 塗布面積 | 1日塗布量(ODT)※ | 塗布日数 | 7日間の尿中回収率(合計) |
| 乾癬 | 体表の50% | 20mg | 1日間 | 2.0% |
| 乾癬 | 体表の50% | 25mg | 2日間 | 8.7% |
| 天疱瘡 | 体表の20% | 10mg | 3日間 | 18.5% |
注)本剤はベタメタゾン吉草酸エステルとゲンタマイシン硫酸塩の配合剤である。
18. 薬効薬理
18.1 作用機序
18.1.1 ベタメタゾン吉草酸エステル
ステロイドは細胞質に存在する熱ショック蛋白質、抑制蛋白質と複合体を形成したステロイド受容体に結合後核内に移行し、ステロイド反応性の遺伝子を活性化させ、その薬理作用を発揮すると考えられている。また、血管内皮細胞やリンパ球等の細胞膜の障害を抑制するような膜の安定性に関与する作用や、フォスフォリパーゼA2と呼ばれる細胞膜リン脂質からロイコトリエンやプロスタグランジンなど種々の炎症惹起物質を誘導する重要な酵素の機能を抑える作用も知られている。
その作用機序としては、単量体のステロイドとその受容体が複合体を形成することで、NFκBやAP-1と呼ばれるサイトカイン産生の誘導や細胞接着分子の発現等を調節している細胞内転写因子の機能を抑制することで、2量体の受容体と結合した場合、リポコルチン等の誘導を介して、炎症を制御すると考えられている。免疫抑制作用に関しては、リンパ球に対する直接的な機能抑制、アポトーシスの誘導によると考えられている5)。
その作用機序としては、単量体のステロイドとその受容体が複合体を形成することで、NFκBやAP-1と呼ばれるサイトカイン産生の誘導や細胞接着分子の発現等を調節している細胞内転写因子の機能を抑制することで、2量体の受容体と結合した場合、リポコルチン等の誘導を介して、炎症を制御すると考えられている。免疫抑制作用に関しては、リンパ球に対する直接的な機能抑制、アポトーシスの誘導によると考えられている5)。
18.1.2 ゲンタマイシン硫酸塩
細菌の蛋白合成を阻害することにより抗菌作用を発揮し、その作用は殺菌的である6)。
18.2 薬理作用
18.2.1 皮膚血管収縮試験
ベタメタゾン吉草酸エステルは健康成人20例における皮膚血管収縮試験において、フルオシノロンアセトニドに比べて3.6倍の皮膚血管収縮能を示した7)(外国人データ)。
18.3 生物学的同等性試験
18.3.1 抗炎症作用
Sprague-Dawley系雄性ラット(n=10)に、デルモゾールGローション及びリンデロン-VGローションを塗布し、カラゲニン浮腫抑制試験、綿球法による肉芽増殖抑制試験及び創傷治癒遅延試験を浮腫抑制率、肉芽形成抑制率及び創傷治癒遅延率を指標に検討した結果、両剤の生物学的同等性が確認された8)。
| 製剤\塗布日数 | 1 | 3 | 5 |
| デルモゾールGローション | 42.32 | 68.73 | 81.55 |
| リンデロン-VGローション | 44.88 | 66.16 | 77.26 |
| デルモゾールGローション | 33.83 |
| リンデロン-VGローション | 22.78 |
| デルモゾールGローション | 9.13 |
| リンデロン-VGローション | 12.88 |
18.3.2 実験的熱傷皮膚感染症に対する殺菌作用
BALB/C AN系雌性マウス(n=10)の実験的熱傷皮膚にS.aureus、E.coli又はP.aeruginosaを感染させ、デルモゾールGローション及びリンデロン-VGローションを1日1回100mgずつ塗布し、感染皮膚患部の生菌数を測定した結果、両剤の殺菌効果に差は認められず、両剤の生物学的同等性が確認された8)。
19. 有効成分に関する理化学的知見
19.1. ベタメタゾン吉草酸エステル
19.2. ゲンタマイシン硫酸塩
20. 取扱い上の注意
20.1 高温条件下で粘度が変化することがある。
20.2 瓶開封後は遮光して保存すること。
22. 包装
<デルモゾールGローション>
10本[10mL(瓶)×10]
50本[10mL(瓶)×50]
23. 主要文献
- Vermeer,B.J.et al., Dermatologica., 149, 299-304, (1974) »PubMed
- Zugerman,C.et al., Arch.Dermatol., 112, 1326, (1976) »PubMed
- 久木田淳ほか, 西日本皮膚科, 33, 129-137, (1971) »DOI
- Butler,J.et al., Br.J.Dermatol., 78, 665-668, (1966) »PubMed
- 片山一朗, アレルギー, 55, 1279-1283, (2006) »DOI
- 第十八改正日本薬局方解説書, C-1951-1956, (2021)
- McKenzie,A.W.et al., Arch.Dermatol., 89, 741-746, (1964) »PubMed
- 岩城製薬株式会社 社内資料(生物学的同等性試験)
24. 文献請求先及び問い合わせ先
文献請求先
岩城製薬株式会社
マーケティング部 学術グループ
〒103-8434
東京都中央区日本橋本町4-8-2
電話:03-6626-6251
FAX:03-6626-6261
製品情報問い合わせ先
岩城製薬株式会社
マーケティング部 学術グループ
〒103-8434
東京都中央区日本橋本町4-8-2
電話:03-6626-6251
FAX:03-6626-6261
26. 製造販売業者等
26.1 製造販売元
岩城製薬株式会社
東京都中央区日本橋本町4-8-2