医薬品情報
| 総称名 | メベンダゾール |
|---|---|
| 一般名 | メベンダゾール |
| 欧文一般名 | mebendazole |
| 製剤名 | メベンダゾール錠 |
| 薬効分類名 | 駆虫剤 |
| 薬効分類番号 | 6429 |
| ATCコード | P02CA01 |
| KEGG DRUG |
D00368
メベンダゾール
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年7月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| メベンダゾール錠100 | Mebendazole Tablets | ヤンセンファーマ | 6429005F1026 | 366.4円/錠 | 処方箋医薬品※ |
2. 禁忌
次の患者には投与しないこと
妊婦又は妊娠している可能性のある女性[9.5参照]
4. 効能または効果
6. 用法及び用量
通常、成人及び小児に対してはメベンダゾールとして1回100mgを1日2回(朝・夕)3日間経口投与する。ただし、体重20kg以下の小児には半量にするなど、適宜減量する。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 本剤の成分に対して過敏症の既往歴のある患者
治療上やむを得ないと判断される場合を除き、投与しないこと。[11.1.1参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。動物実験(ラット)で催奇形性が報告されている。[2.参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物(ウシ)で乳汁中へ移行することが報告されている。また、メベンダゾールがヒトで乳汁中へ移行(5ng/mL)することが報告されている。1)
9.7 小児等
小児への投与で痙攣発作等が認められたとの報告がある2)。
9.8 高齢者
減量するなど注意すること。一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック・アナフィラキシー(頻度不明)[9.1.1参照]
11.1.2 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)(頻度不明)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)
11.2 その他の副作用
| 0.1〜5%未満 | 頻度不明 | |
| 血液 | 好中球数減少 | |
| 過敏症 | 皮膚発赤 | 紅斑性発疹、蕁麻疹、血管浮腫、発疹 |
| 精神神経系 | めまい、頭痛、痙攣 | |
| 消化器 | 腹痛 | 嘔吐、腹部不快感、下痢、鼓腸、悪心 |
| 肝臓 | 肝機能異常 | |
| 皮膚 | 脱毛症 |
13. 過量投与
13.1 症状
腹部痙直を起こすことがある。本剤の投与期間は3日間であるが、長期又は大量投与を受けた患者において、肝炎、無顆粒球症及び糸球体腎炎5)がまれに報告されている。
14. 適用上の注意
14.1 薬剤投与時の注意
蛔虫が混合感染している場合、本剤の投与によって迷入する場合があるので、あらかじめ蛔虫を駆除してから投与するように注意すること。
14.2 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
長期大量投与により重篤な肝障害が認められたとの報告がある。
16. 薬物動態
16.1 血中濃度
健常成人に本剤200mgを経口投与※した結果、最高血中濃度は投与後約2時間にみられ、平均40ng/mL、血中濃度の半減期の平均は4.43±0.9時間であった6)。
16.2 吸収
健常成人に経口投与後、投与量の0.1〜0.3%が吸収された6)。
16.4 代謝
健常成人に経口投与後、90%以上がカルバメート加水分解物として排泄された6)。
16.5 排泄
健常成人に本剤200mgを経口投与※した結果、投与3日後までにカルバメート加水分解物が0.258%(メベンダゾール換算)が尿中に排泄された6)。
※本剤の承認された用法及び用量は、「1回100mgを1日2回(朝・夕)3日間経口投与する。」である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床試験
わが国で実施された臨床試験57例の成績についてみると、用法及び用量の異なる2例を除き53例で有効と判定された(有効率96.4%)。また、投与前後で検便が実施された症例は43例あり、38例で虫卵陰性(完全駆虫率88.4%)となった。
副作用発現頻度は3.5%(2/57例)であった。副作用は、皮膚発赤1.8%(1/57例)、腹痛1.8%(1/57例)であった。7)
副作用発現頻度は3.5%(2/57例)であった。副作用は、皮膚発赤1.8%(1/57例)、腹痛1.8%(1/57例)であった。7)
18. 薬効薬理
18.1 作用機序
19. 有効成分に関する理化学的知見
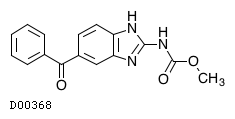
19.1. メベンダゾール
22. 包装
6錠[6錠(PTP)×1]
23. 主要文献
- 社内資料:メベンダゾールの乳汁中への移行
- EL Kalla S,et al., Ann Trop Paediatr., 10, 313-314, (1990) »PubMed
- Bekhti A,et al., Br J Clin Pharmacol., 24, 390-392, (1987) »PubMed
- Chen KT,et al., Am J Public Health., 93, 489-492, (2003) »PubMed
- Kung'u A,et al., E Afr Med J., 59, 404-409, (1982)
- 田中 寛,他, 基礎と臨床, 20, 5477-5482, (1986)
- 田辺 清勝,他, 感染症学雑誌, 61, 161-166, (1987) »PubMed
- Friedman PA,et al., Biochem Biophys.Acta., 630, 271-278, (1980) »PubMed
- Ireland CM,et al., Biochem Pharmacol., 28, 2680-2682, (1979) »PubMed
- H.Van den Bossche, Comparative Biochemistry of Parasites., 139-158, (1972)
- Rahman MS,et al., Internat J Parasitol., 7, 403-409, (1977)
- Rahman MS,et al., New Zealand Vet J., 25, 79-83, (1977)
24. 文献請求先及び問い合わせ先
文献請求先
ヤンセンファーマ株式会社
メディカルインフォメーションセンター
〒101-0065
東京都千代田区西神田3-5-2
電話:フリーダイヤル 0120-183-275
FAX:0120-275-831
製品情報問い合わせ先
ヤンセンファーマ株式会社
メディカルインフォメーションセンター
〒101-0065
東京都千代田区西神田3-5-2
電話:フリーダイヤル 0120-183-275
FAX:0120-275-831
26. 製造販売業者等
26.1 製造販売元
ヤンセンファーマ株式会社
〒101-0065
東京都千代田区西神田3-5-2