医薬品情報
| 総称名 | グラケー |
|---|---|
| 一般名 | メナテトレノン |
| 欧文一般名 | Menatetrenone |
| 製剤名 | メナテトレノン製剤 |
| 薬効分類名 | 骨粗鬆症治療用ビタミンK2剤 |
| 薬効分類番号 | 3160 |
| ATCコード | M05BX08 |
| KEGG DRUG |
D00100
メナテトレノン
|
| KEGG DGROUP |
DG03232
骨粗鬆症治療薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年6月 改訂(第2版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| グラケーカプセル15mg | Glakay capsules | エーザイ | 3160002M2028 | 14.4円/カプセル |
2. 禁忌
次の患者には投与しないこと
2.1 ワルファリンカリウム投与中の患者[10.1参照]
4. 効能または効果
骨粗鬆症における骨量・疼痛の改善
5. 効能または効果に関連する注意
5.1 本剤の適用にあたっては、厚生省「老人性骨粗鬆症の予防及び治療法に関する総合的研究班」の診断基準(骨量減少の有無、骨折の有無、腰背痛の有無などの総合による)等を参考に、骨粗鬆症との診断が確立し、骨量減少・疼痛がみられる患者を対象とすること。
6. 用法及び用量
通常、成人にはメナテトレノンとして1日45mgを3回に分けて食後に経口投与する。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
投与中は患者の状態を十分に観察すること。本剤は高齢者に長期にわたって投与されることが多い薬剤である。
10. 相互作用
10.1 併用禁忌
| ワルファリンカリウム (ワーファリン)[2.1参照] | ワルファリンの期待薬効が減弱する可能性がある。 患者がワルファリン療法を必要とする場合はワルファリン療法を優先し、本剤の投与を中止する。プロトロンビン時間、トロンボテストなど血液凝固能検査を実施し、ワルファリンが維持量に達するまで定期的にモニタリングを行う。 | ワルファリンは肝細胞内のビタミンK代謝サイクルを阻害し、凝固能のない血液凝固因子を産生することにより抗凝固作用、血栓形成の予防作用を示す製剤である。本剤はビタミンK2製剤であるため、ワルファリンと併用するとワルファリンの作用を減弱する。 |
11. 副作用
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 消化器 | 胃部不快感、腹痛、下痢、悪心、口内炎、食欲不振、消化不良、便秘 | 口渇、舌炎、嘔吐 | |
| 過敏症 | 発疹、そう痒 | 発赤 | |
| 精神神経系 | 頭痛 | めまい、ふらつき、しびれ | |
| 循環器 | 血圧上昇、動悸 | ||
| 肝臓 | AST、ALT、γ-GTPの上昇等 | ||
| 泌尿器 | BUNの上昇等 | 頻尿 | |
| その他 | 浮腫 | 眼の異常、関節痛 | 倦怠感 |
14. 適用上の注意
14.1 薬剤投与時の注意
14.1.1 本剤は空腹時投与で吸収が低下するので、必ず食後に服用させること。なお、本剤は脂溶性であるため、食事に含まれる脂肪量が少ない場合には吸収が低下する。[16.2.1参照]
14.2 薬剤交付時の注意
14.2.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜に刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男子9名に本剤1カプセル(15mg)を食後単回経口投与したところ、平均血漿中メナテトレノン濃度は投与後約1時間のラグタイムの後上昇し、投与後約6時間でピークに達した(図1)。なお、若年成人及び高齢者各6名に本剤1回1カプセル(15mg)を1日3回食後に7日間反復経口投与したところ、初回投与時に比し最終投与時のCmax及びAUCは、若年成人ではほぼ同様の値を示した。一方、高齢者では各々約1.3倍、約1.5倍に上昇したが、朝投与前の血漿中濃度は投与3日以降上昇しなかった1)2)。
図1 本剤1カプセルを経口投与した時の平均血漿中濃度推移
| Cmax(ng/mL) | tmax(hr) | AUC(ng・hr/mL) |
| 253.2±82.4 | 4.72±1.52 | 870.7±149.6 |
16.2 吸収
16.2.1 食事の影響
健康成人男子3名に本剤1カプセル(15mg)を一晩絶食後あるいは朝食摂取30分以内に経口投与し、血漿中メナテトレノン濃度推移を検討したところ、一晩絶食後投与では本剤の吸収は低下した(図2)3)。
また、健康成人男子18名を6名ずつ3群に分け、クロスオーバー法により、脂肪含有量の異なる3種類の食事(脂肪含有量:8.8g、20.0g、34.9g)摂取30分以内に本剤1カプセル(15mg)を経口投与し、血漿中メナテトレノン濃度推移を検討したところ、本剤の吸収は食事に含まれる脂肪量に応じて増大した。なお、上記健康成人男子18名のうち12名に、さらに高い脂肪を含有する食事(脂肪含有量:53.8g)摂取30分以内に本剤1カプセル(15mg)を経口投与し、血漿中メナテトレノン濃度推移を検討したところ、本剤の吸収は脂肪含有量34.9gの食事を摂取した時と同程度であった(図3)4)。[14.1.1参照]
また、健康成人男子18名を6名ずつ3群に分け、クロスオーバー法により、脂肪含有量の異なる3種類の食事(脂肪含有量:8.8g、20.0g、34.9g)摂取30分以内に本剤1カプセル(15mg)を経口投与し、血漿中メナテトレノン濃度推移を検討したところ、本剤の吸収は食事に含まれる脂肪量に応じて増大した。なお、上記健康成人男子18名のうち12名に、さらに高い脂肪を含有する食事(脂肪含有量:53.8g)摂取30分以内に本剤1カプセル(15mg)を経口投与し、血漿中メナテトレノン濃度推移を検討したところ、本剤の吸収は脂肪含有量34.9gの食事を摂取した時と同程度であった(図3)4)。[14.1.1参照]
図2 絶食下(空腹時)あるいは摂食下(朝食後)に本剤1カプセルを経口投与した時の平均血漿中濃度推移
| 投与方法 | Cmax(ng/mL) | tmax(hr) | AUC(ng・hr/mL) |
| 絶食下投与 | 32.3±18.2 | 4.3±1.2 | 165.00±73.54 |
| 摂食下投与 | 354.0±165.0 | 3.3±1.5 | 1,114.50±227.86 |
図3 脂肪含有量の異なる4種類の食事摂取後に本剤1カプセルを経口投与した時の平均血漿中濃度推移
| 脂肪含有量 | Cmax(ng/mL) | tmax(hr) | AUC(ng・hr/mL) |
| 8.8g | 133.4±80.5 | 5.3±1.5 | 370.6±194.2 |
| 20.0g | 139.7±43.3 | 4.4±1.3 | 485.2±150.1 |
| 34.9g | 409.4±159.1 | 3.0±1.5 | 1,024.4±341.4 |
| 53.8g | 297.1±157.8 | 4.3±1.7 | 991.2±392.0 |
(参考):脂肪含有量8.8gの献立内容
| 内容 | 量(g) | 脂肪(g) |
| ご飯 | 180 | 0.90 |
| 味噌汁 | 207 | 2.45 |
| 煮物 | 170 | 0.18 |
| 温泉卵 | 84 | 5.10 |
| いちごジャムゼリー | 56 | 0.04 |
| バナナ(1本) | 100 | 0.10 |
| 合計 | 797 | 8.77 |
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床第II、第III相試験(退行期骨粗鬆症)
閉経後及び老人性骨粗鬆症における効果は、中等度改善以上で51.9%(164例/316例)、軽度改善以上で84.5%(267例/316例)であり、骨量維持効果と疼痛改善効果が認められた。また二重盲検試験によって本剤の有用性が確認されている5)6)。
なお、二重盲検試験(第III相比較試験)における疼痛改善効果は本剤単独投与時では57.2%(87例/152例)、鎮痛剤併用時では61.1%(66例/108例)であった。
なお、二重盲検試験(第III相比較試験)における疼痛改善効果は本剤単独投与時では57.2%(87例/152例)、鎮痛剤併用時では61.1%(66例/108例)であった。
第II相試験における副作用発現頻度は、本剤15mg投与群で10.8%(8例/74例)、45mg投与群で2.5%(2例/79例)、90mg投与群で4.2%(3例/72例)、135mg投与群で5.9%(5例/85例)であった。各投与群で2例以上発現した副作用は、15mg投与群で胃痛2.7%(2例/74例)、135mg投与群で心窩部痛2.4%(2例/85例)であった5)。
第III相試験における副作用発現頻度は、本剤45mg投与群で5.9%(16例/272例)であった。主な副作用は、発疹・皮疹・薬疹1.1%(3例/272例)、胃部不快感及び頸部痛・項部・後頭部痛0.7%(2例/272例)であった6)。
注)本剤の承認された用法及び用量はメナテトレノンとして1日45mgである。
17.1.2 国内臨床試験(二次性骨粗鬆症)
腎性骨異栄養症、アルコール性骨減少症及びステロイド性骨減少症を含む二次性骨粗鬆症における効果は中等度改善以上で30.9%(17例/55例)、軽度改善以上では60.0%(33例/55例)であった。
18. 薬効薬理
18.1 作用機序
メナテトレノンは骨芽細胞に直接作用し、骨基質蛋白質であるオステオカルシンのγ-カルボキシグルタミン酸残基を生成(Gla化)すると共に、骨形成を促進することにより骨代謝回転を高める。同時に骨吸収を抑制し、骨粗鬆症の骨代謝の不均衡を改善し、骨量の維持作用を示す。
18.2 実験的骨粗鬆症に対する改善作用
18.2.1 40週齢のラットの両側卵巣を摘除し、低カルシウム飼料で3カ月間飼育することにより骨粗鬆症病態を作製した後、メナテトレノンの30及び100mg/kg/日を6カ月間経口投与すると大腿骨の破断強度、骨中カルシウム量及びハイドロキシプロリン量の低下が抑制された。また卵巣摘除と同時にメナテトレノンの3及び30mg/kg/日の経口投与を開始し、6カ月間継続すると、骨破断強度、骨幹部中カルシウム量及びハイドロキシプロリン量の低下が抑制された7)。
18.2.2 13週齢のラットの両側卵巣を摘除し、メナテトレノンの30mg/kg/日を8週間投与すると、海綿骨骨梁における三次元構造の連結性の減少が抑制された8)。
18.2.3 ラットにおける副腎皮質ホルモン(プレドニゾロン10mg/kg/日、週3回)の4週間筋注後にみられる骨破断強度及び骨中カルシウム量の低下はメナテトレノンの21mg/kg/日の4週間経口投与により抑制された9)。
18.3 骨形成促進作用
18.4 骨吸収抑制作用
18.5 血清オステオカルシン濃度に対する作用
骨粗鬆症患者120名に対し、メナテトレノン45mg/日を2年間投与したところ、血清オステオカルシン濃度は上昇し、非カルボキシル化オステオカルシン濃度は低値を示した14)。
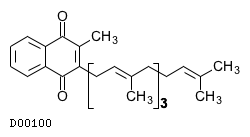
19. 有効成分に関する理化学的知見
19.1. メナテトレノン
20. 取扱い上の注意
20.1 PTP包装はアルミ袋開封後、高温・湿気を避けて保存すること。カプセル皮膜の軟化・変色及びPTPへのはりつきが起こることがある。
22. 包装
100カプセル[10カプセル(PTP)×10]
210カプセル[21カプセル(PTP)×10]
1,000カプセル[10カプセル(PTP)×100]
23. 主要文献
- 石井美佳ら, 臨床医薬, 8 (3), 571-585, (1992)
- 石井美佳ら, 薬理と治療, 23 (10), 2637-2642, (1995)
- 石井美佳ら, 薬理と治療, 23 (10), 2677-2682, (1995)
- Uematsu T.et al., J.Pharma.Sci., 85 (9), 1012-1016, (1996)
- 折茂 肇ら, 新薬と臨牀, 41 (6), 1249-1279, (1992)
- 折茂 肇ら, 臨床評価, 20 (1), 45-100, (1992)
- Akiyama Y.et al., Jpn.J.Pharmacol., 62, 145-153, (1993) »DOI
- Mawatari T.et al., J.Bone Mineral Res., 15 (9), 1810-1817, (2000)
- Hara K.et al., Bone, 14, 813-818, (1993)
- Koshihara Y.et al., Calcif.Tissue Int., 59, 466-473, (1996)
- Koshihara Y.et al., J.Bone Mineral Res., 12 (3), 431-438, (1997)
- Hara K.et al., J.Bone Mineral Res., 8 (5), 535-542, (1993)
- Akiyama Y.et al., Eur.J.Pharmacol., 263, 181-185, (1994)
- Shiraki M.et al., J.Bone Mineral Res., 15 (3), 515-521, (2000)
24. 文献請求先及び問い合わせ先
文献請求先
エーザイ株式会社
hhcホットライン
〒112-8088
東京都文京区小石川4-6-10
電話:フリーダイヤル 0120-419-497
製品情報問い合わせ先
エーザイ株式会社
hhcホットライン
〒112-8088
東京都文京区小石川4-6-10
電話:フリーダイヤル 0120-419-497
26. 製造販売業者等
26.1 製造販売元
エーザイ株式会社
東京都文京区小石川4-6-10