医薬品情報
| 総称名 | ソセゴン |
|---|---|
| 一般名 | 塩酸ペンタゾシン |
| 欧文一般名 | Pentazocine Hydrochloride |
| 製剤名 | 塩酸ペンタゾシン錠 |
| 薬効分類名 | 鎮痛剤 |
| 薬効分類番号 | 1149 |
| ATCコード | N02AD01 |
| KEGG DRUG |
D02227
塩酸ペンタゾシン
|
| KEGG DGROUP |
DG00819
ペンタゾシン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年3月 改訂(第1版)

|
1.警告 2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 25.保険給付上の注意 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ソセゴン錠25mg | Sosegon Tablets 25mg | 丸石製薬 | 1149034F1026 | 25.8円/錠 | 劇薬, 向精神薬(第二種向精神薬), 習慣性医薬品注1), 処方箋医薬品注2) |
1. 警告
本剤を注射しないこと。本剤にはナロキソンが添加されているため、水に溶解して注射投与しても効果なく、麻薬依存患者では禁断症状を誘発し、また肺塞栓、血管閉塞、潰瘍、膿瘍を引き起こすなど、重度で致死的な事態を生じることがある。[14.1参照]
2. 禁忌
次の患者には投与しないこと
2.1 ペンタゾシン又はナロキソンに対し過敏症の既往歴のある患者
2.2 頭部傷害がある患者又は頭蓋内圧が上昇している患者[頭蓋内圧が上昇することがある。]
2.3 重篤な呼吸抑制状態にある患者及び全身状態が著しく悪化している患者[呼吸抑制を増強することがある。]
2.4 ナルメフェン塩酸塩水和物を投与中又は投与中止後1週間以内の患者[オピオイド離脱症状(又はその悪化)があらわれるおそれがある。][10.1参照]
4. 効能または効果
各種癌における鎮痛
6. 用法及び用量
通常、成人には、1回ペンタゾシンとして25〜50mgを経口投与する。
なお、年齢、症状により適宜増減する。必要に応じ追加投与する場合には、3〜5時間の間隔をおく。
なお、年齢、症状により適宜増減する。必要に応じ追加投与する場合には、3〜5時間の間隔をおく。
8. 重要な基本的注意
8.1 眠気、めまい、ふらつき等があらわれることがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作には従事させないよう注意すること。
8.2 連用により薬物依存を生ずることがあるので、観察を十分に行い、慎重に投与すること。特に薬物依存の既往歴のある患者には注意すること。[11.1.3参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 薬物依存の既往歴のある患者[11.1.3参照]
9.1.2 麻薬依存患者
軽度の麻薬拮抗作用が認められているので、ときとして禁断症状を呈することがある。
9.1.3 胆道疾患のある患者
大量投与した場合Oddi氏筋を収縮する。
9.1.4 心筋梗塞患者
肺動脈圧及び血管抵抗を上昇させる。
9.3 肝機能障害患者
本剤の作用が増強するおそれがある。[16.6.1参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
低用量から投与を開始するとともに、投与間隔を延長するなど慎重に投与すること。高い血中濃度が持続する傾向等が認められている。[16.6.2参照]
10. 相互作用
10.1 併用禁忌
| ナルメフェン塩酸塩水和物 セリンクロ [2.4参照] | 本剤の離脱症状を起こすおそれがある。また、本剤の鎮痛作用を減弱させるため、効果を得るために必要な用量が通常用量より多くなるおそれがある。 | μオピオイド受容体拮抗作用により、本剤の作用が競合的に阻害される。 |
10.2 併用注意
| モルヒネ製剤 | 本剤の作用が増強されることがある。 併用が必要な場合には、一方又は両方の投与量を必要に応じて減らすこと。 また、本剤は高用量において、モルヒネの作用に拮抗することがあるので、通常、モルヒネとの併用は避けること。 | ペンタゾシンの作用は、脳内オピオイドレセプターの飽和濃度に左右される。 |
| 中枢性鎮痛剤 ブプレノルフィン塩酸塩 エプタゾシン臭化水素酸塩等 ベンゾジアゼピン誘導体・その他の鎮静剤 ジアゼパム ニトラゼパム メダゼパム等 中枢性薬剤(睡眠剤等) バルビツール酸誘導体(フェノバルビタール等) アルコール | 本剤の作用が増強されることがある。 併用が必要な場合には、一方又は両方の投与量を必要に応じて減らすこと。 | 中枢神経系が抑制されることによると考えられる。 |
| セロトニン神経系賦活作用を有する抗うつ剤 アミトリプチリン塩酸塩等 | 抗うつ剤の作用が増強され不安感、悪心、発汗、潮紅等が起こるおそれがある。 併用が必要な場合には、一方又は両方の投与量を必要に応じて減らすこと。 | 中枢のセロトニン作動活性を増強すると考えられる。 外国において、セロトニン神経系賦活を作用機序とする抗うつ剤(フルオキセチン)投与患者でセロトニン神経系賦活作用の増強に由来すると考えられる症状(不安感、悪心、発汗、潮紅等)が認められたとの報告がある。 |
| メサドン塩酸塩 | メサドン塩酸塩の鎮痛作用を減弱させることがある。また、退薬症候を起こすおそれがある。 | 本剤はメサドン塩酸塩の作用するμ受容体の部分アゴニストである。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
顔面蒼白、呼吸困難、チアノーゼ、血圧下降、頻脈、全身発赤、血管浮腫、蕁麻疹等の症状があらわれた場合には投与を中止し、適切な処置を行うこと。
11.1.2 呼吸抑制(頻度不明)
酸素吸入(必要に応じて人工呼吸)か、又はドキサプラムの投与が有効であるが、麻薬拮抗剤(レバロルファン)は無効である。
11.1.3 依存性(頻度不明)
11.1.4 無顆粒球症(頻度不明)
11.2 その他の副作用
| 5%以上 | 1%〜5%未満 | 1%未満 | 頻度不明 | |
| 精神神経系 | めまい、ふらつき、発汗、傾眠 | 幻覚、興奮、頭痛、頭重、不安、もうろう状態、酩酊感、冷汗、浮遊感、不眠、振戦、意識障害 | ||
| 循環器 | 熱感、顔面潮紅、動悸、血圧上昇、血圧低下、顔面蒼白 | |||
| 消化器 | 悪心 | 嘔吐 | 口渇、食欲不振、腹部膨満感、胃部不快感、腹痛、便秘 | |
| 過敏症 | 発疹 | 多形紅斑 | ||
| 血液 | 貧血、赤血球減少、白血球減少 | |||
| 肝臓 | 肝機能異常 | |||
| 泌尿器 | 排尿障害、尿閉 | |||
| その他 | 倦怠感、不快感、発熱、悪寒、脱力感 | 疲労感 |
13. 過量投与
13.1 症状
外国において薬物嗜癖の病歴を有する患者が、術後疼痛のため処方された本剤を過量服用(ペンタゾシンとして1g)し、死亡(肝不全)したとの報告がある。
14. 適用上の注意
14.1 薬剤投与時の注意
本剤を注射しないこと。本剤にはナロキソンが添加されているため、水に溶解して注射投与しても効果なく、麻薬依存患者では禁断症状を誘発し、また肺塞栓、血管閉塞、潰瘍、膿瘍を引き起こすなど、重度で致死的な事態を生じることがある。[1.参照]
14.2 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
健康成人男性6例に本剤(ペンタゾシンとして50mg含有)を経口投与した時、ペンタゾシンの最高血漿中濃度(Cmax)とその到達時間(Tmax)及び半減期は下記のとおりであった1)。
| Tmax(h) | Cmax(ng/mL) | t1/2(min) |
| 2 | 19〜86 | 98〜192 |
経口投与後のヒトにおける血漿中ペンタゾシン濃度
16.3 分布
16.3.1 血漿蛋白結合率
健康成人(20例)及び脳神経外科手術後の患者(22例)でのペンタゾシンの血漿蛋白結合率を検討した結果、それぞれ61.1%及び65.8%であった2)。
16.5 排泄
健康成人男性6例に本剤(ペンタゾシンとして50mg含有)を経口投与し、経時的に24時間、尿中のペンタゾシン及びその代謝物濃度を検討した。経口投与後の吸収は良く、尿中には主としてペンタゾシンと代謝物の抱合型として排泄され、投与後24時間までの総排泄率は投与量の70.4%であった1)。
16.6 特定の背景を有する患者
16.6.1 肝機能障害患者
16.6.2 高齢者
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内二重盲検比較試験(注射剤との比較)
癌性疼痛患者を対象とした二重盲検比較試験における本剤の有効率(「有効」以上)は25mg群で46.7%(7/15例)、50mg群で71.4%(10/14例)、筋肉内投与15mg群で75.0%(12/16例)であった。副作用は25mg群で悪心、嘔吐が1例に認められた5)。
17.1.2 国内二重盲検比較試験(非オピオイド経口鎮痛剤との比較)
癌性疼痛患者を対象とした二重盲検比較試験における本剤の有効率(「有効」以上)は25mg群で60.0%(9/15例)、50mg群で81.8%(9/11例)、非オピオイド経口鎮痛剤群で58.3%(7/12例)であった。副作用は25mg群で弱い頭痛が1例、50mg群で嘔気、嘔吐が1例、ボンヤリ感が2例に認められた6)。
17.1.3 国内二重盲検比較試験(25mg錠と注射剤との比較)
癌性疼痛患者を対象とした二重盲検比較試験における有効率(「有効」以上)は、本剤25mg群で79.4%(50/63例)、筋肉内投与15mg群で87.3%(55/63例)であった。副作用は58.7%(37/63例)に認められ、主な副作用は睡眠24例、ねむけ6例、発汗6例、めまい3例、悪心3例であった7)。
18. 薬効薬理
18.1 作用機序
中枢神経における刺激伝導系を抑制することにより、鎮痛効果を発現する8)。
18.2 鎮痛効果
化学刺激(マウス酢酸writhing法9)、ラットアセチルコリン動注法10))及び電気刺激(ラット尾部電気刺激9)、ネコ屈曲反射10)、ウサギ歯髄刺激10))による疼痛反応に対する鎮痛効果試験において、ペンタゾシン(20〜200mg/kg p.o.)の効力は、コデインリン酸塩水和物の約1/3〜1倍、アスピリンの約3.5倍であった。経口投与した場合15分以内に鎮痛効果が発現し、その後約60分持続する(ラットアセチルコリン動注法10))。
本剤中に添加されているナロキソン量(1錠あたり0.25mg)では、経口投与により全量が肝初回通過効果による速やかな代謝を受け11)12)、作用を発現せず、ペンタゾシンの薬理作用を阻害することはない。しかし、本剤を注射投与した場合、ナロキソンはペンタゾシンの薬理作用に拮抗する。
本剤中に添加されているナロキソン量(1錠あたり0.25mg)では、経口投与により全量が肝初回通過効果による速やかな代謝を受け11)12)、作用を発現せず、ペンタゾシンの薬理作用を阻害することはない。しかし、本剤を注射投与した場合、ナロキソンはペンタゾシンの薬理作用に拮抗する。
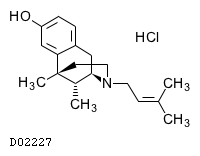
19. 有効成分に関する理化学的知見
19.1. 塩酸ペンタゾシン
22. 包装
100錠[10錠(PTP)×10]
23. 主要文献
- 社内資料:健康成人の薬物動態, (1997)
- Ehrnebo,M.et al., Clin.Pharmacol.Ther., 16 (3), 424-429, (1974) »PubMed
- Neal,E.A.et al., Gastroenterology, 77, 96-102, (1979) »PubMed
- Ritschel,W.A.et al., Methods Find.Exp.Clin.Pharmacol., 8 (8), 497-503, (1986) »PubMed
- 榎本尚美 他, 治療, 58 (9), 1835-1841, (1976)
- 坪井慶孝 他, 治療, 59 (1), 178-182, (1977)
- 古江尚 他, 医学のあゆみ, 93 (7), 292-298, (1975)
- Lim,R.K.S.et al., Bull.Drug Addiction and Narcotics, 3983, (1964)
- 社内資料:薬理作用(マウス及びラット), (1997)
- 社内資料:薬理作用(ラット、ネコ及びウサギ), (1997)
- Berkowitz,B.A., Clin.Pharmacokinet., 1 (3), 219-230, (1976) »PubMed
- Weinstein,S.H.et al., J.Pharm.Sci., 62 (9), 1416-1419, (1973) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
丸石製薬株式会社
学術情報部
〒538-0042
大阪市鶴見区今津中2-4-2
電話:0120-014-561
製品情報問い合わせ先
丸石製薬株式会社
学術情報部
〒538-0042
大阪市鶴見区今津中2-4-2
電話:0120-014-561
25. 保険給付上の注意
本剤は厚生労働省告示第107号(平成18年3月6日付)に基づき、1回14日分を超える投薬は認められていない。
26. 製造販売業者等
26.1 製造販売元
丸石製薬株式会社
大阪市鶴見区今津中2-4-2
26.2 提携
sanofi