医薬品情報
| 総称名 | アンペック |
|---|---|
| 一般名 | モルヒネ塩酸塩水和物 |
| 欧文一般名 | Morphine Hydrochloride Hydrate |
| 製剤名 | モルヒネ塩酸塩坐剤 |
| 薬効分類名 | がん疼痛治療剤 |
| 薬効分類番号 | 8114 |
| ATCコード | N02AA01 |
| KEGG DRUG |
D02271
モルヒネ塩酸塩水和物
|
| KEGG DGROUP |
DG00810
モルヒネ
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年11月 改訂(第3版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 25.保険給付上の注意 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アンペック坐剤10mg | ANPEC Suppositories | 住友ファーマ | 8114700J1023 | 356円/個 | 劇薬, 麻薬, 処方箋医薬品注) |
| アンペック坐剤20mg | ANPEC Suppositories | 住友ファーマ | 8114700J2020 | 612.9円/個 | 劇薬, 麻薬, 処方箋医薬品注) |
| アンペック坐剤30mg | ANPEC Suppositories | 住友ファーマ | 8114700J3026 | 866.3円/個 | 劇薬, 麻薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
激しい疼痛を伴う各種癌における鎮痛
6. 用法及び用量
通常、成人にはモルヒネ塩酸塩水和物として1日20〜120mgを2〜4回に分割し直腸内に投与する。
なお、初めてモルヒネ製剤として本剤を投与する場合は、1回10mgより開始することが望ましい。
症状により投与量、投与回数を適宜増減する。
なお、初めてモルヒネ製剤として本剤を投与する場合は、1回10mgより開始することが望ましい。
症状により投与量、投与回数を適宜増減する。
8. 重要な基本的注意
8.1 連用により薬物依存を生じることがあるので、観察を十分に行い、慎重に投与すること。[11.1.1参照]
8.2 眠気、めまいが起こることがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作に従事させないよう注意すること。
8.3 本剤を増量する場合には、予想される副作用(便秘、嘔気、眠気等)に対する対策をあらかじめ考慮するなど副作用に十分注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 心機能障害のある患者
循環不全を増強するおそれがある。
9.1.2 呼吸機能障害のある患者
呼吸抑制を増強するおそれがある。
9.1.3 脳に器質的障害のある患者
呼吸抑制や頭蓋内圧の上昇を起こすおそれがある。
9.1.4 ショック状態にある患者
循環不全や呼吸抑制を増強するおそれがある。
9.1.5 代謝性アシドーシスのある患者
呼吸抑制を起こすおそれがある。
9.1.6 甲状腺機能低下症(粘液水腫等)の患者
呼吸抑制や昏睡を起こすおそれがある。
9.1.7 副腎皮質機能低下症(アジソン病等)の患者
呼吸抑制作用に対し、感受性が高くなっている。
9.1.8 薬物依存の既往歴のある患者
依存性を生じやすい。
9.1.9 衰弱者
呼吸抑制作用に対し、感受性が高くなっている。
9.1.10 前立腺肥大による排尿障害、尿道狭窄、尿路手術術後の患者
排尿障害を増悪することがある。
9.1.11 器質的幽門狭窄、麻痺性イレウス又は最近消化管手術を行った患者
消化管運動を抑制する。
9.1.12 痙攣の既往歴のある患者
痙攣を誘発するおそれがある。
9.1.13 胆嚢障害及び胆石のある患者
胆道痙攣を起こすことがある。
9.1.14 重篤な炎症性腸疾患のある患者
連用した場合、巨大結腸症を起こすおそれがある。
9.2 腎機能障害患者
排泄が遅延し、副作用があらわれるおそれがある。
9.3 肝機能障害患者
9.3.1 重篤な肝機能障害のある患者
投与しないこと。昏睡に陥ることがある。[2.3参照]
9.3.2 肝機能障害患者(重篤な肝機能障害のある患者を除く)
代謝が遅延し、副作用があらわれるおそれがある。
9.5 妊婦
9.5.1 妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(マウス、ラット)で催奇形作用(マウスでは脳脱、軸骨格癒合)が報告されている。
9.5.2 分娩前に投与した場合、出産後新生児に退薬症候(多動、神経過敏、不眠、振戦等)があらわれることがある。
9.5.3 分娩時の投与により、新生児に呼吸抑制があらわれることがある。
9.6 授乳婦
本剤投与中は授乳を避けさせること。ヒト母乳中へ移行することがある。
9.7 小児等
新生児、乳児では低用量から投与を開始するなど患者の状態を観察しながら、慎重に投与すること。新生児、乳児では呼吸抑制の感受性が高い。
9.8 高齢者
低用量から投与を開始するなど患者の状態を観察しながら、慎重に投与すること。一般に生理機能が低下しており、特に呼吸抑制の感受性が高い。
10. 相互作用
10.1 併用禁忌
| ナルメフェン塩酸塩水和物 セリンクロ [2.8参照] | 本剤の離脱症状があらわれるおそれがある。また、本剤の効果が減弱するおそれがある。緊急の手術等によりやむを得ず本剤を投与する場合、患者毎に用量を漸増し、呼吸抑制等の中枢神経抑制症状を注意深く観察すること。また、手術等において本剤を投与することが事前にわかる場合には、少なくとも1週間前にはナルメフェン塩酸塩水和物の投与を中断すること。 | μオピオイド受容体拮抗作用により、本剤の作用が競合的に阻害される。 |
10.2 併用注意
| 中枢神経抑制剤 フェノチアジン系薬剤 バルビツール酸系薬剤 等 吸入麻酔剤 モノアミン酸化酵素阻害剤 三環系抗うつ剤 β-遮断剤 アルコール | 呼吸抑制、低血圧及び顕著な鎮静又は昏睡が起こることがある。 | 相加的に中枢神経抑制作用が増強される。 |
| クマリン系抗凝血剤 ワルファリン | クマリン系抗凝血剤の作用が増強されることがある。 | 機序は不明である。 |
| 抗コリン作動性薬剤 | 麻痺性イレウスに至る重篤な便秘又は尿貯留が起こるおそれがある。 | 相加的に抗コリン作用が増強される。 |
| ジドブジン(アジドチミジン) | ジドブジンの副作用(骨髄抑制等)を増強させるおそれがある。 | ジドブジンのグルクロン酸抱合が競合的に阻害され、ジドブジンの代謝が阻害される。 |
| ブプレノルフィン | ブプレノルフィンの高用量(8mg連続皮下投与)において、本剤の作用に拮抗するとの報告がある。 | μオピオイド受容体拮抗作用により、本剤の作用が競合的に阻害される。 |
| クロピドグレル チカグレロル プラスグレル | これらの薬剤の血漿中濃度が低下するとの報告がある。 | 本剤の消化管運動抑制により、これらの薬剤の吸収が遅延する可能性が考えられる。 |
| 水溶性基剤を用いた非ステロイド性消炎鎮痛剤の坐剤 インドメタシン等 | インドメタシン坐剤(水溶性基剤)との併用で、基剤の影響により本剤の吸収が低下するとの報告がある。 | 直腸内の水分が水溶性基剤の溶解に消費されるため、モルヒネの溶解が不十分になると考えられている。 |
| 油脂性基剤を用いた非ステロイド性消炎鎮痛剤の坐剤 ジクロフェナク等 | ジクロフェナク坐剤との併用で、主薬の影響により本剤の吸収が上昇するとの報告がある。 | 非ステロイド性消炎鎮痛剤が直腸粘膜の透過性を亢進することによると考えられている。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 依存性(0.2%)
連用により生じることがある。また、連用中における投与量の急激な減少ないし投与の中止により、あくび、くしゃみ、流涙、発汗、悪心、嘔吐、下痢、腹痛、散瞳、頭痛、不眠、不安、せん妄、振戦、全身の筋肉・関節痛、呼吸促迫等の退薬症候があらわれることがあるので、投与を中止する場合には、1日用量を徐々に減量するなど、患者の状態を観察しながら行うこと。[8.1参照]
11.1.2 呼吸抑制(0.8%)
息切れ、呼吸緩慢、不規則な呼吸、呼吸異常等があらわれた場合には、投与を中止するなど適切な処置を行うこと。なお、本剤による呼吸抑制には、麻薬拮抗剤(ナロキソン、レバロルファン等)が拮抗する。
11.1.3 錯乱(0.2%)、せん妄(0.1%未満)
11.1.4 無気肺(0.1%未満)、気管支痙攣(0.1%未満)、喉頭浮腫(0.1%未満)
11.1.5 麻痺性イレウス(0.1%未満)、中毒性巨大結腸(0.1%未満)
炎症性腸疾患の患者に投与した場合、中毒性巨大結腸があらわれるとの報告がある。
注)発現頻度は使用成績調査・特別調査を含む。
11.2 その他の副作用
| 5%以上 | 5%未満 | 頻度不明 | |
| 循環器 | 血圧変動 | 不整脈、顔面潮紅 | |
| 精神神経系 | 眠気 | めまい、不安、不穏、意識障害、幻覚、発汗、不眠 | 興奮、視調節障害、痛覚過敏・異痛症(アロディニア) |
| 消化器 | 悪心・嘔吐(16.8%)、便秘(12.7%) | 食欲不振、腹部膨満、直腸粘膜の刺激(肛門痛、粘膜びらん等)、口渇 | |
| 過敏症 | そう痒感 | 発疹 | |
| 血液 | 白血球減少、血小板増多、血小板減少 | ||
| 肝臓 | AST、ALT、ALPの上昇 | ||
| 腎臓 | 尿蛋白 | ||
| その他 | 排尿障害、全身倦怠感 | 頭蓋内圧の亢進 |
13. 過量投与
13.1 症状
呼吸抑制、意識不明、痙攣、錯乱、血圧低下、重篤な脱力感、重篤なめまい、嗜眠、心拍数の減少、神経過敏、不安、縮瞳、皮膚冷感等を起こすことがある。
13.2 処置
麻薬拮抗剤投与を行い、患者に退薬症候又は麻薬拮抗剤の副作用が発現しないよう慎重に投与する。なお、麻薬拮抗剤の作用持続時間はモルヒネのそれより短いので、患者のモニタリングを行うか又は患者の反応に応じて、初回投与後は注入速度を調節しながら持続静注する。
14. 適用上の注意
14.1 薬剤投与時の注意
14.1.1 直腸内投与による外用にのみ使用すること。
14.1.2 できるだけ排便後に投与すること。
14.2 薬剤交付時の注意
14.2.1 具体的な使用方法、使用時の注意点、保管方法等を十分に説明し、本剤の目的以外への使用あるいは他人への譲渡をしないよう指導するとともに、本剤を子供の手の届かないところに保管するよう指導すること。
14.2.2 本剤が不要となった場合には、病院又は薬局へ返却するなどの処置について適切に指導すること。
16. 薬物動態
16.1 血中濃度
16.4 代謝
16.4.1 主な代謝産物及び代謝経路
モルヒネは肝臓で3位又は6位の水酸基がグルクロン酸抱合を受け、モルヒネ-3-グルクロニド(活性なし)又はモルヒネ-6-グルクロニド(活性あり)になる。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II相試験(用法用量設定試験:坐剤10mg/坐剤20mg開発時)
癌患者を対象に、本剤1日30〜60mg、1日3回を中心として7日間直腸内投与した。改善率はモルヒネ経口剤から本剤へ切り換えた例(切替例)では86.5%(32/37例)、モルヒネ経口剤以外の鎮痛薬(前投与に鎮痛薬の使用なしを含む)から切り換えた例(新規例)では89.2%(58/65例)であった。副作用発現頻度は切替例では29.7%(11/37例)、新規例では52.9%(36/68例)であり、主な副作用は、切替例で便秘7件、新規例では嘔気・嘔吐15件、眠気14件、便秘12件であった3)。
17.1.2 国内第III相試験(長期投与試験:坐剤10mg/坐剤20mg開発時)
国内第II相試験(用法用量設定試験)の対象患者のうち、53例が長期投与試験に移行し、4週間以上投与した36例の疼痛のコントロール状態は、コントロール良好が50%(18例)、コントロールほぼ良好が47.2%(17例)であった。副作用発現頻度は26.4%(14/53例)であり、主な副作用は便秘17%(9例)であった4)。
17.1.3 国内第III相試験(比較試験:坐剤10mg/坐剤20mg開発時)
モルヒネ経口剤投与で疼痛のコントロールができている癌患者を対象に、本剤1日60mg3回分割直腸内投与と、モルヒネ硫酸塩徐放錠1日60mg2回分割経口投与を3日ごとに交差投与し、計6日間投与する単盲検交差比較試験を実施した。改善率は、本剤投与群では87.8%(36/41例)、対照薬投与群では87.2%(34/39例)であり、両群間に有意差は認められなかった。本剤投与群の副作用発現頻度(試験開始前からみられた副作用含む)は68.3%(28/41例)であり、主な副作用は便秘19件、眠気15件、嘔気・嘔吐4件であった5)。
17.1.4 国内第III相試験(一般臨床試験:坐剤30mg開発時)
癌疼痛を有する患者を対象に、本剤1日70mg以上を原則1日3回に分割して7日間直腸内投与した。改善率は84.7%(83/98例)であった。副作用発現頻度は67.2%(78/116例)であり、主な副作用は眠気47件、便秘44件、嘔気39件、嘔吐11件であった2)。
18. 薬効薬理
18.1 作用機序
オピオイド受容体のうち、主としてμ受容体に作用する。脳内の下行性痛覚制御経路を賦活することにより、脊髄後角における痛覚情報の伝達を抑制すると考えられている。
18.2 鎮痛作用
ラットのtail pressure法及び酢酸writhing法を用いて直腸内投与と経口投与で検討した結果、モルヒネ塩酸塩水和物の直腸内投与は経口投与と比べ同等ないしそれ以上の効力を示した6)。
| ED50(mg/kg) | ||
| 試験法\投与経路 | 直腸内投与 | 経口投与 |
| tail pressure法 | 約17 | 34.3 |
| 酢酸writhing法 | 0.69 | 1.23 |
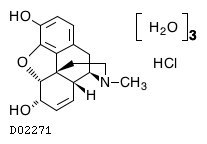
19. 有効成分に関する理化学的知見
19.1. モルヒネ塩酸塩水和物
22. 包装
<アンペック坐剤10mg>
50個[5個×10]
<アンペック坐剤20mg>
50個[5個×10]
<アンペック坐剤30mg>
30個[5個×6]
23. 主要文献
- 水口公信ほか, 臨床医薬, 6, 2639-2655, (1990)
- 水口公信ほか, 基礎と臨床, 30, 2645-2664, (1996)
- 水口公信ほか, 臨床医薬, 6, 2339-2356, (1990)
- 水口公信ほか, 臨床医薬, 6, 2621-2637, (1990)
- 水口公信ほか, 臨床医薬, 6, 2357-2376, (1990)
- 喜多敦子ほか, 薬学雑誌, 110, 349-353, (1990) »DOI
24. 文献請求先及び問い合わせ先
文献請求先
住友ファーマ株式会社
くすり情報センター
〒541-0045
大阪市中央区道修町2-6-8
電話:0120-034-389
製品情報問い合わせ先
住友ファーマ株式会社
くすり情報センター
〒541-0045
大阪市中央区道修町2-6-8
電話:0120-034-389
25. 保険給付上の注意
25.1 投薬期間制限医薬品に関する情報
本剤は厚生労働省告示第75号(平成24年3月5日付)に基づき、投薬は1回30日分を限度とされている。
26. 製造販売業者等
26.1 製造販売元
住友ファーマ株式会社
大阪市中央区道修町2-6-8