医薬品情報
| 総称名 | ミグシス |
|---|---|
| 一般名 | ロメリジン塩酸塩 |
| 欧文一般名 | lomerizine hydrochloride |
| 製剤名 | ロメリジン塩酸塩錠 |
| 薬効分類名 | 片頭痛治療剤 |
| 薬効分類番号 | 2190 |
| KEGG DRUG |
D02633
ロメリジン塩酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年6月 改訂(第1版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ミグシス錠5mg | Migsis Tablets 5mg | ファイザー | 2190023F1037 | 15.4円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 頭蓋内出血又はその疑いのある患者[脳血流増加作用により、症状を悪化させるおそれがある。]
2.3 脳梗塞急性期の患者[急性期には、病巣部は代謝障害状態にあり、非病巣部の血流増加作用に伴い病巣部の血流低下を起こすおそれがある。]
2.4 妊婦又は妊娠している可能性のある女性[9.5参照]
4. 効能または効果
片頭痛
5. 効能または効果に関連する注意
5.1 本剤は片頭痛発作(月に2回以上)により日常生活に支障をきたしている患者に投与すること。
5.2 本剤は発現した頭痛発作を緩解する薬剤ではないので、本剤投与中に頭痛発作が発現した場合には必要に応じて頭痛発作治療薬(エルゴタミン酒石酸・無水カフェイン等)を頓用させること。投与前にこのことを患者に十分に説明しておくこと。
6. 用法及び用量
通常、成人にはロメリジン塩酸塩として1回5mgを1日2回、朝食後及び夕食後あるいは就寝前に経口投与する。なお、症状に応じて適宜増減するが、1日投与量として20mgを超えないこと。
8. 重要な基本的注意
8.1 本剤投与中は症状の経過を十分に観察し、頭痛発作発現の消失・軽減により患者の日常生活への支障がなくなったら一旦本剤の投与を中止し、投与継続の必要性について検討すること。なお、症状の改善が認められない場合には、漫然と投与を継続しないこと。
8.2 眠気等を催すことがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作には従事させないよう注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 QT延長の疑われる患者(心室性不整脈(torsade de pointes)、QT延長症候群、低カリウム血症、低カルシウム血症等)[15.2.1参照]
9.1.2 パーキンソニズムの患者
類似化合物(塩酸フルナリジン等)で錐体外路症状の発現が報告されており、本剤においても症状が悪化するおそれがある。[11.1.2参照]
9.1.3 うつ状態又はその既往のある患者
症状が悪化又は再発することがある。
9.3 肝機能障害患者
9.3.1 重篤な肝機能障害のある患者
本剤は主として肝臓で代謝され、また、胆汁へ排泄されるため、高い血中濃度が持続するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。動物実験(ラット)で催奇形作用(骨格・外形異常)が報告されている。[2.4参照]
9.6 授乳婦
授乳しないことが望ましい。動物実験(ラット)で母乳中へ移行することが報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
9.8.1 用量に留意し、患者の状態を観察しながら慎重に投与すること。本剤の臨床試験成績において、高齢者(65歳以上)と非高齢者の副作用発現率はそれぞれ5.6%(21例/372例)、6.8%(41例/600例)であり、差は認められていない。しかし、本剤は主として肝臓で代謝されること及び高齢者では肝臓の生理機能が低下していることが多いため、高い血中濃度が持続するおそれがある。
9.8.2 観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。類似化合物(塩酸フルナリジン等)では、高齢者で錐体外路症状や抑うつが発現しやすいとの報告がある。[11.1.2参照]
10. 相互作用
10.2 併用注意
| 降圧剤 | 併用により相互の作用を増強するおそれがある。 | 本剤によってもまた、血圧低下があらわれることがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 抑うつ(頻度不明)
11.2 その他の副作用
| 1〜5%未満 | 0.1〜1%未満 | 頻度不明 | |
| 精神神経系 | 眠気、頭痛、頭重、めまい、頭がボーッとする、ふらつき | ||
| 消化器 | 悪心、腹痛、下痢、軟便、便秘、食欲不振、心窩部痛、腹部不快感、胃腸障害、口内炎、口唇粘膜浮腫、口腔粘膜浮腫 | 嘔吐 | |
| 肝臓 | AST、ALT、γ-GTP、LDHの上昇 | Al-Pの上昇 | |
| 過敏症 | 発疹 | ||
| 循環器 | 血圧低下 | 動悸 | |
| 泌尿器 | 排尿障害、頻尿 | ||
| その他 | ほてり感、胸痛、倦怠感、気分不良、背部つっぱり感、発汗、浮腫、悪寒、発熱、乳頭腫大 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.2 非臨床試験に基づく情報
15.2.1 イヌで3カ月間経口投与試験を行った結果、15mg/kg/日以上投与で心電図上QT及びQTc間隔の延長が報告されている。[9.1.1参照]
15.2.2 イヌで3カ月間、12カ月間経口投与試験を行った結果、それぞれ15mg/kg/日以上、30mg/kg/日投与で歯肉腫脹、乳腺腫大が、また45mg/kg/日以上、7mg/kg/日以上投与で歯肉上皮の増殖が報告されている。
16. 薬物動態
16.1 血中濃度
16.2 吸収
16.3 分布
16.4 代謝
健常成人6名にロメリジン塩酸塩40mg注)を単回経口投与したときの血漿中にはロメリジンのほかに、代謝物として主にトリメトキシベンジル基のO-脱メチル体及びそのグルクロン酸抱合体、ピペラジン環の4位N-脱アルキル化によるベンズヒドリルピペラジン体が認められた6)。
注)本剤の承認最大用量は20mgである。
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
本剤の臨床試験では国際頭痛学会による頭痛分類及び診断基準7)に基づく片頭痛を対象とした。二重盲検比較試験を含む324例での有効率は55%(179例/324例)であった。また、プラセボを対照とした二重盲検比較試験において本剤の有効性が認められた8)9)10)11)。承認時までに実施した片頭痛、脳血管障害、群発頭痛を対象とした臨床試験の副作用発現症例(臨床検査値の変動を除く)は4.0%(39/972例)であり、副作用発現件数は延べ52件であった。その主なものは、眠気、めまい、ふらつき、悪心、ほてり感各3件(0.3%)等、また、臨床検査値の変動は、ALT上昇2.2%(18/822件)、AST上昇1.7%(14/821件)、γ-GTP上昇1.4%(11/759件)、LDH上昇1.1%(9/793件)、Al-P上昇0.9%(7/804件)等であった。
18. 薬効薬理
18.1 作用機序
本剤は脳血管に対して選択的な血管収縮抑制作用を示すカルシウム拮抗薬であり、血管平滑筋及び神経細胞内へのCa2+流入を抑制し、血管収縮抑制作用及びspreading depressionに伴う脳血流量の低下及びc-fosの発現を抑制すると考えられる。
・モルモット大脳皮質膜標品のCa2+チャネルへの3H-ニトレンジビン特異的結合を阻害した12)。
18.2 脳血流増加作用
18.3 Spreading depressionに対する作用
18.4 神経原性炎症に対する作用
ラットにおいて三叉神経逆行性刺激による眼瞼及び鼻周囲の血管透過性の亢進を抑制したが、ヒスタミン、ブラジキニン及びサブスタンスPの皮内投与による皮膚の血管透過性の亢進には影響しなかった19)。
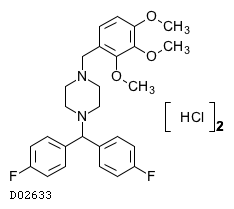
19. 有効成分に関する理化学的知見
19.1. ロメリジン塩酸塩
22. 包装
140錠[14錠(PTP)×10]
23. 主要文献
- 酒井 孝範ほか, 薬理と治療, 22 (11), 4657-4662, (1994)
- 中島 光好ほか, 臨床医薬, 5 (9), 1791-1811, (1989)
- 川島 恒男ほか, 薬物動態, 5 (5), 723-737, (1990) »DOI
- 社内資料:イヌにおける体内動態
- 粟田 則男ほか, 薬物動態, 9 (4), 522-535, (1994) »DOI
- 粟田 則男ほか, 薬理と治療, 22 (11), 4663-4673, (1994)
- Headache Classification Committee of the International Headache Society, Cephalagia., 8 (Suppl.7), 9, (1988)
- 後藤 文男ほか, 薬理と治療, 22 (12), 5031-5047, (1994)
- 後藤 文男ほか, 臨床評価, 23 (1), 13-37, (1995)
- 後藤 文男ほか, 臨床評価, 23 (2), 183-214, (1995)
- 後藤 文男ほか, 薬理と治療, 23 (5), 1445-1460, (1995)
- Iwamoto,T.et al., Jpn J Pharmacol., 48 (2), 241-247, (1988) »PubMed
- Iwamoto,T.et al., J Pharm Pharmacol., 43 (8), 535-539, (1991) »PubMed
- Watano,T.et al., Jpn J Pharmacol., 75 (2), 209-213, (1997) »PubMed
- 原田 研吾ほか, 薬理と治療, 25 (3), 785-796, (1997)
- 山田 親臣ほか, 薬理と治療, 25 (3), 797-802, (1997)
- Shimazawa,M.et al., Br J Pharmcol., 115, 1359-1368, (1995) »PubMed
- 高木 啓ほか, 日本薬理学雑誌, 11, 309-316, (1998)
- Hashimoto,M.et al., Res Commun Mol Pathol Pharmacol., 97 (1), 79-94, (1997) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
ファイザー株式会社
製品情報センター
〒151-8589
東京都渋谷区代々木3-22-7
電話:学術情報ダイヤル 0120-664-467
FAX:03-3379-3053
製品情報問い合わせ先
ファイザー株式会社
製品情報センター
〒151-8589
東京都渋谷区代々木3-22-7
電話:学術情報ダイヤル 0120-664-467
FAX:03-3379-3053
26. 製造販売業者等
26.1 製造販売元
ファイザー株式会社
東京都渋谷区代々木3-22-7