医薬品情報
| 総称名 | リウマトレックス |
|---|---|
| 一般名 | メトトレキサート |
| 欧文一般名 | Methotrexate |
| 薬効分類名 | 抗リウマチ剤 |
| 薬効分類番号 | 3999 |
| ATCコード | L04AX03 |
| KEGG DRUG |
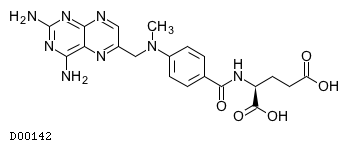
D00142
メトトレキサート
|
| KEGG DGROUP |
DG02018
代謝拮抗薬
DG01985
疾患修飾性抗リウマチ薬 (DMARD)
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年2月 改訂(第3版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| リウマトレックスカプセル2mg | RHEUMATREX CAPSULES 2mg | ファイザー | 3999016M1021 | 106.1円/カプセル | 劇薬, 処方箋医薬品注) |
1. 警告
1.1 本剤の投与において、感染症、肺障害、血液障害等の重篤な副作用により、致命的な経過をたどることがあるので、緊急時に十分に措置できる医療施設及び本剤についての十分な知識と適応疾患の治療経験をもつ医師が使用すること。
1.2 間質性肺炎、肺線維症等の肺障害が発現し、致命的な経過をたどることがあるので、原則として、呼吸器に精通した医師と連携して使用すること。
1.3 本剤の投与に際しては、患者に対して本剤の危険性や本剤の投与が長期間にわたることを十分説明した後、患者が理解したことを確認したうえで投与を開始すること。
1.4 本剤の投与に際しては、副作用の発現の可能性について患者に十分理解させ、下記の症状が認められた場合には直ちに連絡するよう注意を与えること。
発熱、咳嗽・呼吸困難等の呼吸器症状、口内炎、倦怠感[8.4、8.6、8.7参照]
発熱、咳嗽・呼吸困難等の呼吸器症状、口内炎、倦怠感[8.4、8.6、8.7参照]
1.5 使用が長期間にわたると副作用が強くあらわれ、遷延性に推移することがあるので、投与は慎重に行うこと。
1.6 腎機能が低下している場合には副作用が強くあらわれることがあるため、本剤投与開始前及び投与中は腎機能検査を行うなど、患者の状態を十分観察すること。
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
<局所療法で効果不十分な尋常性乾癬、乾癬性関節炎、膿疱性乾癬、乾癬性紅皮症>
以下のいずれかを満たす患者に投与すること。
・ステロイド外用剤等で十分な効果が得られず、皮疹が体表面積の10%以上に及ぶ患者
・難治性の皮疹、関節症状又は膿疱を有する患者
6. 用法及び用量
<関節リウマチ、局所療法で効果不十分な尋常性乾癬、乾癬性関節炎、膿疱性乾癬、乾癬性紅皮症>
通常、1週間単位の投与量をメトトレキサートとして6mgとし、1週間単位の投与量を1回又は2〜3回に分割して経口投与する。分割して投与する場合、初日から2日目にかけて12時間間隔で投与する。1回又は2回分割投与の場合は残りの6日間、3回分割投与の場合は残りの5日間は休薬する。これを1週間ごとに繰り返す。
なお、患者の年齢、症状、忍容性及び本剤に対する反応等に応じて適宜増減するが、1週間単位の投与量として16mgを超えないようにする。
なお、患者の年齢、症状、忍容性及び本剤に対する反応等に応じて適宜増減するが、1週間単位の投与量として16mgを超えないようにする。
<関節症状を伴う若年性特発性関節炎>
通常、1週間単位の投与量をメトトレキサートとして4〜10mg/m2とし、1週間単位の投与量を1回又は2〜3回に分割して経口投与する。分割して投与する場合、初日から2日目にかけて12時間間隔で投与する。1回又は2回分割投与の場合は残りの6日間、3回分割投与の場合は残りの5日間は休薬する。これを1週間ごとに繰り返す。
なお、患者の年齢、症状、忍容性及び本剤に対する反応等に応じて適宜増減する。
なお、患者の年齢、症状、忍容性及び本剤に対する反応等に応じて適宜増減する。
7. 用法及び用量に関連する注意
<関節リウマチ、局所療法で効果不十分な尋常性乾癬、乾癬性関節炎、膿疱性乾癬、乾癬性紅皮症>
4〜8週間投与しても十分な効果が得られない場合にはメトトレキサートとして1回2〜4mgずつ増量する。増量する前には、患者の状態を十分に確認し、増量の可否を慎重に判断すること。
8. 重要な基本的注意
<効能共通>
8.1 本剤は1週間のうちの特定の日に投与するので、患者に対して誤用、過量投与を防止するための十分な服薬指導を行うこと。
8.2 尿量、排尿回数をチェックし、排尿が少ないと判断したときは、点滴又は経口により水分を補給し排尿を促すこと。
8.3 骨髄抑制、肝・腎機能障害等の重篤な副作用が起こることがあるので、本剤投与開始前及び投与中、4週間ごとに臨床検査(血液検査、肝機能・腎機能検査、尿検査等)を行うなど、患者の状態を十分観察すること。[11.1.2、11.1.5、11.1.6参照]
8.5
本剤投与に先立って結核に関する十分な問診及び胸部X線検査に加え、インターフェロン-γ遊離試験又はツベルクリン反応検査を行い、適宜胸部CT検査等を行うことにより、結核感染の有無を確認すること。結核の既往歴を有する場合及び結核感染が疑われる場合には、結核の診療経験がある医師に相談すること。以下のいずれかの患者には、原則として本剤の開始前に適切な抗結核薬を投与すること。
・胸部画像検査で陳旧性結核に合致するか推定される陰影を有する患者
・結核の治療歴(肺外結核を含む)を有する患者
・インターフェロン-γ遊離試験やツベルクリン反応検査等の検査により、既感染が強く疑われる患者
・結核患者との濃厚接触歴を有する患者
また、本剤投与中も、胸部X線検査等の適切な検査を定期的に行うなど結核の発現には十分に注意し、患者に対し、結核を疑う症状が発現した場合(持続する咳、発熱等)には速やかに主治医に連絡するよう説明すること。なお、結核の活動性が確認された場合は本剤を投与しないこと。[9.1.3参照]
8.6 出血性腸炎、消化管潰瘍・出血等の消化管障害があらわれることがあるので、口内炎、激しい腹痛、嘔吐、下痢等の症状があらわれた場合には投与を中止し、適切な処置を行うこと。また、患者に対し、口内炎があらわれた場合には、直ちに連絡するよう注意を与えること。[1.4、11.1.9参照]
8.8 投与が長期間にわたると肝組織の線維化・硬変があらわれるおそれがある。
8.9 悪性リンパ腫、リンパ増殖性疾患、急性白血病、骨髄異形成症候群(MDS)等があらわれることがあるので、患者の状態を十分に観察し、異常が認められた場合には投与を中止し、適切な処置を行うこと。[15.1.1参照]
8.10 免疫機能が抑制された患者への生ワクチン接種により、ワクチン由来の感染を増強又は持続させるおそれがあるので、本剤投与中に生ワクチンを接種しないこと。
8.12 副作用の予防対策については、最新の学会ガイドラインも参考にすること。
<関節リウマチ>
8.13 関節リウマチの患者に対して、インフリキシマブとの併用療法を行う際には、両剤の電子添文を熟読し、リスク・ベネフィットを判断した上で投与すること。
<関節リウマチ、局所療法で効果不十分な尋常性乾癬、乾癬性関節炎、膿疱性乾癬、乾癬性紅皮症>
8.14 投与量を増量すると骨髄抑制、感染症、肝機能障害等の副作用の発現の可能性が増加するので、定期的に臨床検査値を確認する等を含め患者の状態を十分に観察すること。消化器症状、肝機能障害等の副作用の予防には、葉酸の投与が有効であるとの報告がある。
<関節症状を伴う若年性特発性関節炎>
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 間質性肺炎、肺線維症等の肺障害又はその既往歴のある患者
9.1.2 感染症を合併している患者
感染症が増悪するおそれがある。[11.1.3参照]
9.1.3 結核の既感染者(特に結核の既往歴のある患者及び胸部X線検査上結核治癒所見のある患者)
胸部X線検査等を定期的に行うなど、結核症状の発現に十分注意すること。結核を活動化させるおそれがある。[8.5参照]
9.1.4 水痘患者
致命的な全身障害があらわれることがある。
9.1.5 アルコール常飲者
肝障害を増悪させるおそれがある。
9.1.6 B型又はC型肝炎ウイルスキャリアの患者
9.2 腎機能障害患者
投与しないこと。副作用が強くあらわれるおそれがある。[2.5参照]
9.3 肝機能障害患者
9.3.1 慢性肝疾患のある患者
投与しないこと。副作用が強くあらわれるおそれがある。[2.4参照]
9.4 生殖能を有する者
9.4.1 妊娠する可能性のある女性に投与する場合は、投与中及び投与終了後少なくとも1月経周期は妊娠を避けるよう注意を与えること。男性に投与する場合は、投与中及び投与終了後少なくとも3ヵ月間は配偶者が妊娠を避けるよう注意を与えること。
9.4.2 小児及び生殖可能な年齢の患者に投与する必要がある場合には、性腺に対する影響を考慮すること。[9.7参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。催奇形性を疑う症例報告があり、また、動物実験で胎児死亡及び催奇形作用(マウス、ラット及びウサギ)が報告されている。[2.1参照]
9.6 授乳婦
投与しないこと。母乳中への移行が報告されている。[2.6参照]
9.7 小児等
副作用の発現に特に注意し、慎重に投与すること。低出生体重児、新生児、乳児を対象とした臨床試験は実施していない。[9.4.2参照]
9.8 高齢者
腎機能検査値に十分注意し、患者の状態を観察しながら慎重に投与すること。腎機能等生理機能が低下していることが多く、メトトレキサートの排泄遅延により副作用があらわれやすい。また、免疫機能低下の影響を受けやすいため、重篤な感染症があらわれやすい。
10. 相互作用
10.2 併用注意
| サリチル酸等の非ステロイド性抗炎症剤 | メトトレキサートの副作用(骨髄抑制、肝・腎・消化管障害等)が増強されることがある。頻回に臨床検査を行うなど観察を十分に行い、異常が認められた場合には、メトトレキサートの減量、休薬等適切な処置を行うこと。また、メトトレキサートの拮抗剤であるホリナートカルシウム(ロイコボリンカルシウム)を投与すること。 | 主として、非ステロイド性抗炎症剤の腎におけるプロスタグランジン合成阻害作用による腎血流量の低下及びナトリウム、水分貯留傾向のためメトトレキサートの排泄が遅延するためと考えられている。 |
| スルホンアミド系薬剤 テトラサイクリン クロラムフェニコール フェニトイン バルビツール酸誘導体 | メトトレキサートの副作用(骨髄抑制、肝・腎・消化管障害、血液障害等)が増強されることがある。頻回に臨床検査を行うなど観察を十分に行い、異常が認められた場合には、メトトレキサートの減量、休薬等適切な処置を行うこと。また、メトトレキサートの拮抗剤であるホリナートカルシウム(ロイコボリンカルシウム)を投与すること。 | 併用薬剤が血漿蛋白と結合しているメトトレキサートを競合的に置換遊離し、メトトレキサートの濃度を上昇させ、その毒性を増強させる。 |
| スルファメトキサゾール・トリメトプリム | メトトレキサートの副作用(骨髄抑制、肝・腎・消化管障害、血液障害等)が増強されることがある。頻回に臨床検査を行うなど観察を十分に行い、異常が認められた場合には、メトトレキサートの減量、休薬等適切な処置を行うこと。また、メトトレキサートの拮抗剤であるホリナートカルシウム(ロイコボリンカルシウム)を投与すること。 | 両薬剤の葉酸代謝阻害作用が協力的に作用するためと考えられている。 |
| ペニシリン (ピペラシリン等) プロベネシド | メトトレキサートの副作用(骨髄抑制、肝・腎・消化管障害、血液障害等)が増強されることがある。頻回に臨床検査を行うなど観察を十分に行い、異常が認められた場合には、メトトレキサートの減量、休薬等適切な処置を行うこと。また、メトトレキサートの拮抗剤であるホリナートカルシウム(ロイコボリンカルシウム)を投与すること。 | 併用薬剤がメトトレキサートの腎排泄を競合的に阻害するためと考えられている。 |
| シプロフロキサシン | メトトレキサートの副作用(骨髄抑制、肝・腎・消化管障害、血液障害等)が増強されることがある。頻回に臨床検査を行うなど観察を十分に行い、異常が認められた場合には、メトトレキサートの減量、休薬等適切な処置を行うこと。また、メトトレキサートの拮抗剤であるホリナートカルシウム(ロイコボリンカルシウム)を投与すること。 | 発現機序の詳細は不明であるが、メトトレキサートの腎尿細管からの排泄が阻害されるためと考えられている。 |
| レフルノミド | メトトレキサートの副作用(骨髄抑制、肝・腎・消化管障害、血液障害等)が増強されることがある。頻回に臨床検査を行うなど観察を十分に行い、異常が認められた場合には、メトトレキサートの減量、休薬等適切な処置を行うこと。また、メトトレキサートの拮抗剤であるホリナートカルシウム(ロイコボリンカルシウム)を投与すること。 | 併用により骨髄抑制等の副作用を増強するためと考えられている。 |
| プロトンポンプ阻害剤 (オメプラゾール、ラベプラゾール、ランソプラゾール等) | メトトレキサートの副作用(骨髄抑制、肝・腎・消化管障害、血液障害等)が増強されることがある。頻回に臨床検査を行うなど観察を十分に行い、異常が認められた場合には、メトトレキサートの減量、休薬等適切な処置を行うこと。また、メトトレキサートの拮抗剤であるホリナートカルシウム(ロイコボリンカルシウム)を投与すること。 | 機序は不明であるが、メトトレキサートの血中濃度が上昇することがある。 |
| ポルフィマーナトリウム | 光線過敏症を起こすことがある。 | ポルフィマーナトリウムは光感受性を高める作用があるため、光線過敏症を起こしやすい薬剤の作用を増強する。 |
11. 副作用
11.1 重大な副作用
次の副作用注)があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
骨髄抑制、肝機能障害、粘膜・消化管障害等の細胞毒性に起因する副作用が発現した場合には、適切な処置を行いながら、本剤の拮抗剤であるホリナートカルシウム(ロイコボリンカルシウム)を投与すること。
骨髄抑制、肝機能障害、粘膜・消化管障害等の細胞毒性に起因する副作用が発現した場合には、適切な処置を行いながら、本剤の拮抗剤であるホリナートカルシウム(ロイコボリンカルシウム)を投与すること。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
ショック、アナフィラキシー(冷感、呼吸困難、血圧低下等)があらわれることがある。
11.1.2 骨髄抑制(0.1〜5%未満)
汎血球減少、無顆粒球症(前駆症状として発熱、咽頭痛、インフルエンザ様症状等があらわれる場合がある)、白血球減少、血小板減少、貧血等の骨髄抑制、再生不良性貧血があらわれることがある。[8.3参照]
11.1.3 感染症(0.1〜5%未満)
11.1.4 結核(頻度不明)
11.1.5 劇症肝炎、肝不全(いずれも頻度不明)
11.1.6 急性腎障害、尿細管壊死、重症ネフロパチー(いずれも頻度不明)
急性腎障害、尿細管壊死、重症ネフロパチー等の重篤な腎障害があらわれることがある。[8.3参照]
11.1.7 間質性肺炎(0.1〜5%未満)、肺線維症(0.1%未満)、胸水(頻度不明)
間質性肺炎、肺線維症、胸水等があらわれ、呼吸不全にいたることがあるので、投与開始後は観察を十分に行い、発熱、咳嗽、呼吸困難等の呼吸器症状があらわれた場合には、速やかに胸部X線検査、胸部CT検査、血液ガス検査、血中KL-6測定等を行い、本剤の投与を中止するとともに、ニューモシスティス肺炎との鑑別診断(β-Dグルカンの測定等)を考慮に入れ副腎皮質ホルモン剤の投与等の適切な処置を行うこと。[9.1.1参照]
11.1.8 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(いずれも頻度不明)
中毒性表皮壊死融解症、皮膚粘膜眼症候群等の重篤な皮膚障害があらわれることがある。発熱、紅斑、そう痒感、眼充血、口内炎等があらわれた場合には投与を中止し、適切な処置を行うこと。
11.1.9 出血性腸炎、壊死性腸炎(いずれも頻度不明)
出血性腸炎、壊死性腸炎等の重篤な腸炎があらわれることがあるので、激しい腹痛、下痢等の症状があらわれた場合には投与を中止し、適切な処置を行うこと。[8.6参照]
11.1.10 膵炎(0.1%未満)
11.1.11 骨粗鬆症(頻度不明)
骨塩量減少等の異常が認められた場合には、投与を中止するなど適切な処置を行うこと。
11.1.12 脳症(白質脳症を含む)(頻度不明)
11.1.13 進行性多巣性白質脳症(PML)(頻度不明)
本剤投与中及び投与終了後は患者の状態を十分に観察すること。意識障害、認知機能障害、麻痺症状(片麻痺、四肢麻痺)、構音障害、失語等の症状があらわれた場合は、MRIによる画像診断及び脳脊髄液検査を行うとともに、投与を中止し、適切な処置を行うこと。
注)使用成績調査を含む2)
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | 発疹、そう痒、発熱 | 蕁麻疹 | ||
| 血液 | 好酸球増多 | 出血 | 低ガンマグロブリン血症、リンパ節腫脹 | |
| 肝臓 | 肝機能障害(ALT、AST、AL-Pの上昇等) | LDHの上昇 | 黄疸、脂肪肝 | |
| 腎臓 | BUN上昇、血尿、クレアチニンの上昇、蛋白尿 | |||
| 消化器 | 嘔気、腹痛、下痢、口内炎、食欲不振、嘔吐、舌炎 | 口唇腫脹、消化管潰瘍・出血 | メレナ、イレウス | |
| 皮膚 | 脱毛 | 紅斑、皮下斑状出血、皮膚潰瘍 | 光線過敏症、色素沈着、色素脱出、ざ瘡、結節、乾癬病変局面の有痛性びらん | |
| 精神神経系 | 頭痛、めまい | 意識障害、眠気、目のかすみ、しびれ感、味覚異常 | 項部緊張、背部痛、錯感覚 | |
| 呼吸器 | 咳嗽、呼吸困難 | |||
| 生殖器 | 無精子症、卵巣機能不全、月経不全、流産 | |||
| その他 | 倦怠感、動悸、胸部圧迫感、低蛋白血症、血清アルブミン減少、浮腫 | 膀胱炎、結膜炎、関節痛 | 耳下腺炎、悪寒 |
12. 臨床検査結果に及ぼす影響
トリメトプリム(スルファメトキサゾール・トリメトプリム配合剤)を併用した場合、2水素葉酸還元酵素(dihydrofolate reductase:DHFR)を用いたメトトレキサート濃度の測定で見かけ上高値を呈することがあるので注意すること。
13. 過量投与
13.1 症状
外国で週間総用量が20mgを超えると重篤な副作用、特に骨髄抑制の発生率等が有意に上昇するという報告がある。過量投与時に報告された主な症状は血液障害及び消化管障害であった。また、重篤な副作用を発現し、致命的な経過をたどった症例が報告されている。
13.2 処置
過量投与したときは、すみやかに本剤の拮抗剤であるホリナートカルシウム(ロイコボリンカルシウム)を投与するとともに、本剤の排泄を促進するために水分補給と尿のアルカリ化を行うこと。本剤とホリナートカルシウムの投与間隔が長いほど、ホリナートカルシウムの効果が低下することがある。
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.1.2 食道に停留し、崩壊すると食道潰瘍を起こすおそれがあるので、多めの水で服用させ、特に就寝直前の服用は避けさせること。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 本剤の投与中に発現したリンパ増殖性疾患の中には、本剤投与中止により消退したとの報告もある。[8.9参照]
15.1.2 免疫機能が抑制された患者にワクチンを接種した場合、抗体反応の欠如が報告されている。
15.2 非臨床試験に基づく情報
15.2.1 一側腎摘出ラットの亜急性毒性試験
一側腎臓を摘出した(腎摘)ラットで偽手術ラットを比較対照にメトトレキサートの0.06、0.2、0.6mg/kg/日の28日間反復経口投与毒性試験を実施した。死亡・瀕死動物数は腎摘ラットで高く、一般状態の異常は腎摘ラットで先行して発現した。無毒性量は腎摘ラットでは、0.06mg/kg/日を下回る量、偽手術ラットでは0.06mg/kg/日であった。
15.2.2 非ステロイド性抗炎症剤との併用毒性
メトトレキサートとジクロフェナクナトリウムの併用毒性を雌ラットを用い、メトトレキサート0.2、0.4、0.6mg/kg/日及びジクロフェナクナトリウム4mg/kg/日で28日間同時反復経口投与により検討した。死亡・瀕死動物数は併用群がメトトレキサート単独群より高かった。一般状態の異常や病理組織学的検査等の異常所見の出現頻度及び程度は併用群がメトトレキサート単独群より増加あるいは重篤化する傾向が認められた。
15.2.3 肺毒性の検討
メトトレキサートによる肺毒性をラットを用い、気管支肺胞洗浄法及び肺の病理組織学的検索により検討した。メトトレキサート投与により、瀕死動物の半数に肺に感染を示す細菌塊の集簇が認められたが、感染巣が認められない個体においても肺胞壁肥厚・出血等の病変が認められた。感染は常在菌による日和見感染であった。肺胞腔内に滲出物が貯留した個体では軽度の炎症細胞浸潤が認められたが、著しいリンパ球や好酸球の浸潤は認められなかった。また、無菌ラットでも同様に軽度の肺胞壁肥厚、肺水腫・出血、肺胞マクロファージ増加がみられた。
16. 薬物動態
16.1 血中濃度
16.1.1 血清中濃度
関節リウマチ患者17名にメトトレキサートを1週間あたり6mg(1回2mg、12時間間隔で3回投与)経口投与し、これを12週間繰り返し投与した時の第1週目及び最終週の初回2mg投与時の最高血清中濃度(Cmax)は、投与1〜2時間(Tmax)後に得られ、その平均値は0.215μM及び0.252μMであった。また、その時の血清中濃度半減期(T1/2)はそれぞれ2.4時間及び2.3時間であった。
第1週目及び最終週の第3回目投与時のCmaxは、投与1〜2時間(Tmax)後に得られ、その平均値は0.223μM及び0.357μMであった。また、その時のT1/2はそれぞれ3.2時間及び2.2時間であった。
第1週目と最終週の投与後の血清中濃度を比較した結果から、メトトレキサートの蓄積性はほとんどないと考えられた。
第1週目及び最終週の第3回目投与時のCmaxは、投与1〜2時間(Tmax)後に得られ、その平均値は0.223μM及び0.357μMであった。また、その時のT1/2はそれぞれ3.2時間及び2.2時間であった。
第1週目と最終週の投与後の血清中濃度を比較した結果から、メトトレキサートの蓄積性はほとんどないと考えられた。
16.1.2 赤血球中濃度
長期にわたりメトトレキサートを平均12.4mg/1回/週(7.5又は15mg/1回/週)内服している関節リウマチ患者の赤血球中のメトトレキサート濃度は血清中濃度の低下にもかかわらず、経口投与9日後まで0.05〜0.34μMの範囲でほぼ一定値を示した3)。
16.5 排泄
手術不能癌患者2例に3H-メトトレキサートを0.1mg/kg経口投与した時のメトトレキサートの主排泄経路は尿中であり、累積尿中排泄率及び累積糞中排泄率はそれぞれ69.5%、8%であった。
また、分娩1ヵ月後の絨毛性腫瘍患者1例にメトトレキサート22.5mg/日を経口投与した時の乳汁中メトトレキサート濃度は、投与10時間後に最高濃度5.0×10−9Mを示した。最高血清中濃度は投与6時間後に1.8×10−7Mを示し、メトトレキサートの乳汁中濃度は相当する血清中濃度の約1/12以下であった。
メトトレキサート投与後12時間までの乳汁中へのメトトレキサートの分泌量は0.32μgと微量であるが乳汁中への移行が認められた4)5)。
また、分娩1ヵ月後の絨毛性腫瘍患者1例にメトトレキサート22.5mg/日を経口投与した時の乳汁中メトトレキサート濃度は、投与10時間後に最高濃度5.0×10−9Mを示した。最高血清中濃度は投与6時間後に1.8×10−7Mを示し、メトトレキサートの乳汁中濃度は相当する血清中濃度の約1/12以下であった。
メトトレキサート投与後12時間までの乳汁中へのメトトレキサートの分泌量は0.32μgと微量であるが乳汁中への移行が認められた4)5)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床試験
国内延べ46施設で実施された204例の関節リウマチ患者に対する臨床試験成績では、最終全般改善度の評価対象150例のうち6mg/週投与群で、その改善率(著明改善と中等度改善)は、60.4%(32/53例)であった。副作用発現率は、17.6%(12/68例)であり、臨床検査値異常発現率は23.8%(15/63例)であった6)。
18. 薬効薬理
18.1 作用機序
18.2 ラット慢性関節炎モデルに対する薬効
19. 有効成分に関する理化学的知見
19.1. メトトレキサート
22. 包装
30カプセル[3カプセル(PTP)×10]
23. 主要文献
- 厚生労働省:小児薬物療法検討会議報告書:メトトレキサート若年性特発性関節炎, 1-15, (2007)
- 社内資料:副作用発現状況一覧表(再審査終了時)
- Kremer J M,et al., Arthritis Rheum., 29 (7), 832-835, (1986) »PubMed
- Henderson E S,et al., Cancer Res., 25 (7), 1018-1024, (1965) »PubMed
- Johns D G,et al., Am J Obstet Gynecol., 112 (7), 978-980, (1972) »PubMed
- 柏崎 禎夫ほか, 炎症, 16 (6), 437-458, (1996) »DOI
- 四方 義幸ほか, 応用薬理, 52 (6), 425-436, (1996)
- 四方 義幸ほか, 応用薬理, 52 (6), 437-442, (1996)
- Ridge S C,et al., J Rheumatol., 13 (5), 895-898, (1986) »PubMed
- Welles W L,et al., J Rheumatol., 12 (5), 904-906, (1985) »PubMed
- O'Meara A M L,et al., J Immunopharm., 7 (2), 235-245, (1985)
- Rosenthal G J,et al., Int Immunopharmacol., 9 (7), 793-801, (1987)
- Hirata S,et al., Arthritis Rheum., 32 (9), 1065-1073, (1989) »PubMed
- 佐京 かつふみほか, 応用薬理, 52 (6), 451-457, (1996)
- 佐京 かつふみほか, 応用薬理, 52 (6), 443-450, (1996)
- Cronstein B N,et al., Proc Natl Acad Sci USA., 88 (6), 2441-2445, (1991) »PubMed
- Sperling R I,et al., Arthritis Rheum., 35 (4), 376-384, (1992) »PubMed
- Hu S K,et al., J Rheumatol., 15 (2), 206-209, (1988) »PubMed
- Firestein G S,et al., Arthritis Rheum., 37 (2), 193-200, (1994) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
ファイザー株式会社
Pfizer Connect/メディカル・インフォメーション
〒151-8589
東京都渋谷区代々木3-22-7
電話:0120-664-467
製品情報問い合わせ先
ファイザー株式会社
Pfizer Connect/メディカル・インフォメーション
〒151-8589
東京都渋谷区代々木3-22-7
電話:0120-664-467
26. 製造販売業者等
26.1 製造販売元
ファイザー株式会社
東京都渋谷区代々木3-22-7