医薬品情報
| 総称名 | スターシス |
|---|---|
| 一般名 | ナテグリニド |
| 欧文一般名 | Nateglinide |
| 薬効分類名 | 速効型インスリン分泌促進薬 |
| 薬効分類番号 | 3969 |
| ATCコード | A10BX03 |
| KEGG DRUG |
D01111
ナテグリニド
|
| KEGG DGROUP |
DG01735
グリニド薬 (速効型インスリン分泌促進薬)
DG02044
血糖降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年8月 改訂(第2版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| スターシス錠30mg | Starsis Tablets 30mg | アステラス製薬 | 3969006F1020 | 10.4円/錠 | 処方箋医薬品 |
| スターシス錠90mg | Starsis Tablets 90mg | アステラス製薬 | 3969006F2026 | 22円/錠 | 処方箋医薬品 |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
2型糖尿病における食後血糖推移の改善
ただし、下記のいずれかの治療で十分な効果が得られない場合に限る。
ただし、下記のいずれかの治療で十分な効果が得られない場合に限る。
[1]食事療法・運動療法のみ
[2]食事療法・運動療法に加えてα-グルコシダーゼ阻害剤を使用
[3]食事療法・運動療法に加えてビグアナイド系薬剤を使用
[4]食事療法・運動療法に加えてチアゾリジン系薬剤を使用
5. 効能または効果に関連する注意
5.1 糖尿病治療の基本である食事療法・運動療法のみを行っている患者では、投与の際、空腹時血糖が120mg/dL以上、又は食後血糖1又は2時間値が200mg/dL以上の患者に限る。
5.2 食事療法・運動療法に加えてα-グルコシダーゼ阻害剤を使用している患者では、投与の際の空腹時血糖値は140mg/dL以上を目安とする。
6. 用法及び用量
通常、成人にはナテグリニドとして1回90mgを1日3回毎食直前に経口投与する。なお、効果不十分な場合には、経過を十分に観察しながら1回量を120mgまで増量することができる。
7. 用法及び用量に関連する注意
7.1 本剤は、食後投与では速やかな吸収が得られず効果が減弱する。効果的に食後の血糖上昇を抑制するため、本剤の投与は毎食前10分以内(食直前)とすること。また、本剤は投与後、速やかに薬効を発現するため、食前30分投与では食事開始前に低血糖を誘発する可能性がある。
7.2 高齢者には、低用量(例えば1回量60mg)から投与を開始するとともに、血糖値に留意するなど、経過を十分に観察しながら慎重に投与すること。[9.8参照]
8. 重要な基本的注意
8.1 本剤は、速やかなインスリン分泌促進作用を有する。その作用点はスルホニルウレア系薬剤と同じであり、スルホニルウレア系薬剤との相加・相乗の臨床効果及び安全性が確認されていないので、スルホニルウレア系薬剤とは併用しないこと。
8.2 本剤の服用後、低血糖及び低血糖症状を起こすことがあるので、高所作業、自動車の運転等に従事している患者に投与するときには注意すること。[11.1.1参照]
8.4 本剤投与中は、血糖を定期的に検査するとともに、経過を十分に観察し、本剤を2〜3ヵ月投与しても食後血糖に対する効果が不十分な場合(静脈血漿で食後血糖2時間値が200mg/dL以下にコントロールできないなど)には、より適切と考えられる治療への変更を考慮すること。
8.5 本剤とピオグリタゾン塩酸塩1日45mgの併用における安全性は確立していない。(使用経験はほとんどない。)
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 虚血性心疾患のある患者
外国において本剤投与例に心筋虚血の悪化によると思われる心筋梗塞を発症した症例が報告されている。[11.1.3参照]
9.1.2 低血糖を起こすおそれがある以下の患者又は状態
9.2 腎機能障害患者
9.2.1 重篤な腎機能障害のある患者
9.2.2 腎機能障害のある患者(重篤な腎機能障害患者を除く)
低用量から開始するなど投与量に十分に注意し、慎重に観察しながら投与すること。低血糖を起こすおそれがある。[11.1.1参照]
9.3 肝機能障害患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。本剤は動物実験で胎盤通過(ラット)、また、催奇形性作用(ウサギ)が認められている。[2.5参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。本剤は動物実験(ラット)で母乳へ移行することが報告されている。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
一般に高齢者では生理機能が低下している。[7.2参照]
10. 相互作用
相互作用序文
本剤は、主として薬物代謝酵素CYP2C9で代謝される。[16.4参照]
薬物代謝酵素用語
CYP2C9
10.2 併用注意
| 糖尿病用薬 インスリン製剤 ビグアナイド系薬剤 α-グルコシダーゼ阻害剤 チアゾリジン系薬剤 DPP-4阻害剤 GLP-1受容体作動薬 SGLT2阻害剤 [11.1.1参照] | 低血糖症状(空腹感、あくび、悪心、無気力、だるさ等の初期症状から血圧上昇、発汗、ふるえ、顔面蒼白等の症状を経て意識消失、けいれん、昏睡にいたる)、血糖降下作用が増強されることがあるので、血糖値モニターその他患者の状態を十分に観察し、必要であれば減量する。 | 作用機序が異なる薬理作用の相加作用による血糖降下作用の増強による。 |
| アルドース還元酵素阻害剤 エパルレスタット | 低血糖症状(空腹感、あくび、悪心、無気力、だるさ等の初期症状から血圧上昇、発汗、ふるえ、顔面蒼白等の症状を経て意識消失、けいれん、昏睡にいたる)、血糖降下作用が増強されることがあるので、血糖値モニターその他患者の状態を十分に観察し、必要であれば減量する。 | in vitro試験結果から、エパルレスタットとの併用により、本剤の血漿中濃度が最大で1.5倍に上昇する可能性が報告されている。 |
| ピラゾロン系消炎剤 スルピリン水和物 等 | 低血糖症状(空腹感、あくび、悪心、無気力、だるさ等の初期症状から血圧上昇、発汗、ふるえ、顔面蒼白等の症状を経て意識消失、けいれん、昏睡にいたる)、血糖降下作用が増強されることがあるので、血糖値モニターその他患者の状態を十分に観察し、必要であれば減量する。 | 血中蛋白との結合抑制、腎排泄抑制、肝代謝抑制による。 |
| サリチル酸製剤 アスピリン 等 | 低血糖症状(空腹感、あくび、悪心、無気力、だるさ等の初期症状から血圧上昇、発汗、ふるえ、顔面蒼白等の症状を経て意識消失、けいれん、昏睡にいたる)、血糖降下作用が増強されることがあるので、血糖値モニターその他患者の状態を十分に観察し、必要であれば減量する。 | 血中蛋白との結合抑制、サリチル酸製剤の血糖降下作用による。 |
| フィブラート系薬剤 クロフィブラート ベザフィブラート 等 | 低血糖症状(空腹感、あくび、悪心、無気力、だるさ等の初期症状から血圧上昇、発汗、ふるえ、顔面蒼白等の症状を経て意識消失、けいれん、昏睡にいたる)、血糖降下作用が増強されることがあるので、血糖値モニターその他患者の状態を十分に観察し、必要であれば減量する。 | 血中蛋白との結合抑制、肝代謝抑制、腎排泄抑制による。 |
| ミコナゾール フルコナゾール ホスフルコナゾール | 低血糖症状(空腹感、あくび、悪心、無気力、だるさ等の初期症状から血圧上昇、発汗、ふるえ、顔面蒼白等の症状を経て意識消失、けいれん、昏睡にいたる)、血糖降下作用が増強されることがあるので、血糖値モニターその他患者の状態を十分に観察し、必要であれば減量する。 | 血中蛋白との結合抑制、肝代謝抑制による。 |
| プロベネシド | 低血糖症状(空腹感、あくび、悪心、無気力、だるさ等の初期症状から血圧上昇、発汗、ふるえ、顔面蒼白等の症状を経て意識消失、けいれん、昏睡にいたる)、血糖降下作用が増強されることがあるので、血糖値モニターその他患者の状態を十分に観察し、必要であれば減量する。 | 腎排泄抑制による。 |
| クマリン系薬剤 ワルファリンカリウム | 低血糖症状(空腹感、あくび、悪心、無気力、だるさ等の初期症状から血圧上昇、発汗、ふるえ、顔面蒼白等の症状を経て意識消失、けいれん、昏睡にいたる)、血糖降下作用が増強されることがあるので、血糖値モニターその他患者の状態を十分に観察し、必要であれば減量する。 | 肝代謝抑制による。 |
| サルファ剤 スルファメトキサゾール 等 | 低血糖症状(空腹感、あくび、悪心、無気力、だるさ等の初期症状から血圧上昇、発汗、ふるえ、顔面蒼白等の症状を経て意識消失、けいれん、昏睡にいたる)、血糖降下作用が増強されることがあるので、血糖値モニターその他患者の状態を十分に観察し、必要であれば減量する。 | 血中蛋白との結合抑制、肝代謝抑制、腎排泄抑制による。 |
| クロラムフェニコール | 低血糖症状(空腹感、あくび、悪心、無気力、だるさ等の初期症状から血圧上昇、発汗、ふるえ、顔面蒼白等の症状を経て意識消失、けいれん、昏睡にいたる)、血糖降下作用が増強されることがあるので、血糖値モニターその他患者の状態を十分に観察し、必要であれば減量する。 | 肝代謝抑制による。 |
| β-遮断剤 プロプラノロール塩酸塩 等 モノアミン酸化酵素阻害剤 | 低血糖症状(空腹感、あくび、悪心、無気力、だるさ等の初期症状から血圧上昇、発汗、ふるえ、顔面蒼白等の症状を経て意識消失、けいれん、昏睡にいたる)、血糖降下作用が増強されることがあるので、血糖値モニターその他患者の状態を十分に観察し、必要であれば減量する。 | 肝における糖新生の抑制及び末梢におけるインスリン感受性の増強により血糖が低下する。 |
| タンパク同化ホルモン剤 | 低血糖症状(空腹感、あくび、悪心、無気力、だるさ等の初期症状から血圧上昇、発汗、ふるえ、顔面蒼白等の症状を経て意識消失、けいれん、昏睡にいたる)、血糖降下作用が増強されることがあるので、血糖値モニターその他患者の状態を十分に観察し、必要であれば減量する。 | タンパク同化ホルモン剤が糖尿病患者のみに起こる血糖降下作用に加えて代謝抑制・排泄遅延説がある。 |
| テトラサイクリン系抗生物質 テトラサイクリン塩酸塩 ミノサイクリン塩酸塩 等 | 低血糖症状(空腹感、あくび、悪心、無気力、だるさ等の初期症状から血圧上昇、発汗、ふるえ、顔面蒼白等の症状を経て意識消失、けいれん、昏睡にいたる)、血糖降下作用が増強されることがあるので、血糖値モニターその他患者の状態を十分に観察し、必要であれば減量する。 | インスリン感受性促進による。 |
| アドレナリン | 経口血糖降下剤の効果を減弱させ、血糖値が上昇してコントロール不良になることがある。 食後の血糖上昇が加わることによる影響に十分注意すること。 併用時は血糖値コントロールに注意し頻回に血糖値を測定し、必要に応じ投与量を調節する。 | 末梢でのグルコースの取り込み抑制及び肝での糖新生の促進により、血糖値を上昇させる。 |
| 副腎皮質ホルモン メチルプレドニゾロン 等 | 経口血糖降下剤の効果を減弱させ、血糖値が上昇してコントロール不良になることがある。 食後の血糖上昇が加わることによる影響に十分注意すること。 併用時は血糖値コントロールに注意し頻回に血糖値を測定し、必要に応じ投与量を調節する。 | 肝での糖新生促進、末梢組織でのインスリン感受性低下による。 |
| ニコチン酸 | 経口血糖降下剤の効果を減弱させ、血糖値が上昇してコントロール不良になることがある。 食後の血糖上昇が加わることによる影響に十分注意すること。 併用時は血糖値コントロールに注意し頻回に血糖値を測定し、必要に応じ投与量を調節する。 | 肝でのブドウ糖の同化抑制による。 |
| 卵胞ホルモン エチニルエストラジオール 等 | 経口血糖降下剤の効果を減弱させ、血糖値が上昇してコントロール不良になることがある。 食後の血糖上昇が加わることによる影響に十分注意すること。 併用時は血糖値コントロールに注意し頻回に血糖値を測定し、必要に応じ投与量を調節する。 | 機序不明 コルチゾール分泌変化、組織での糖利用変化、成長ホルモンの過剰産生、肝機能の変化等が考えられる。 |
| イソニアジド | 経口血糖降下剤の効果を減弱させ、血糖値が上昇してコントロール不良になることがある。 食後の血糖上昇が加わることによる影響に十分注意すること。 併用時は血糖値コントロールに注意し頻回に血糖値を測定し、必要に応じ投与量を調節する。 | 糖質代謝の障害による血糖値上昇及び耐糖能異常による。 |
| ピラジナミド | 経口血糖降下剤の効果を減弱させ、血糖値が上昇してコントロール不良になることがある。 食後の血糖上昇が加わることによる影響に十分注意すること。 併用時は血糖値コントロールに注意し頻回に血糖値を測定し、必要に応じ投与量を調節する。 | 機序不明 血糖値のコントロールが難しいとの報告がある。 |
| フェノチアジン系薬剤 クロルプロマジン塩酸塩 等 | 経口血糖降下剤の効果を減弱させ、血糖値が上昇してコントロール不良になることがある。 食後の血糖上昇が加わることによる影響に十分注意すること。 併用時は血糖値コントロールに注意し頻回に血糖値を測定し、必要に応じ投与量を調節する。 | インスリン遊離抑制、副腎からのアドレナリン遊離による。 |
| 利尿剤 チアジド系 クロルタリドン 等 | 経口血糖降下剤の効果を減弱させ、血糖値が上昇してコントロール不良になることがある。 食後の血糖上昇が加わることによる影響に十分注意すること。 併用時は血糖値コントロールに注意し頻回に血糖値を測定し、必要に応じ投与量を調節する。 | 血清カリウムの低下、インスリンの分泌障害、組織におけるインスリンの感受性低下による。 |
| フェニトイン | 経口血糖降下剤の効果を減弱させ、血糖値が上昇してコントロール不良になることがある。 食後の血糖上昇が加わることによる影響に十分注意すること。 併用時は血糖値コントロールに注意し頻回に血糖値を測定し、必要に応じ投与量を調節する。 | インスリン分泌を直接抑制する。 |
| 甲状腺ホルモン 乾燥甲状腺 等 | 血糖値その他患者の状態を十分観察しながら投与する。 | 血糖コントロール条件が変わることがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 低血糖(0.1〜5%未満)
11.1.2 肝機能障害、黄疸(各0.1%未満)[9.3参照]
11.1.3 心筋梗塞(頻度不明)
外国において本剤投与例に心筋梗塞の発症が報告されている。[9.1.1参照]
11.1.4 突然死(頻度不明)
外国において本剤投与例に原因不明の突然死が報告されている。
注)発現頻度は使用成績調査を含む。
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 代謝 | 乳酸上昇、ピルビン酸上昇、尿酸上昇、血清カリウム上昇 | ||
| 消化器 | 嘔気、放屁増加、腹部膨満感、胃もたれ感、腹痛、便秘、下痢 | 嘔吐、軟便 | 舌炎、口内炎、口渇 |
| 過敏症 | 発疹、そう痒感 | じん麻疹、多形紅斑 | |
| 肝臓 | 肝機能異常(γ-GTP上昇、LDH上昇、AST上昇、ALT上昇等) | ||
| 腎臓 | 腎機能障害 | ||
| 血液 | 貧血、白血球減少、血小板減少 | ||
| その他 | 頭痛、動悸、めまい、倦怠感、体重増加、浮腫(顔面、下肢等) | 胸部圧迫感、味覚異常、眠気、頻尿、ほてり、熱感 | 勃起障害、筋痙攣、かすみ目 |
14. 適用上の注意
14.1 薬剤調製時の注意
<90mg錠>
吸湿性があるので自動分包機には適さない(吸湿しないようPTPシートの状態で保存すること)。
14.2 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男性(n=6)に空腹時ナテグリニド20、40、60mgを経口投与したとき注)、投与後0.9〜1.8時間で最高値に達し、半減期は1.1〜1.3時間であった1)。
| 投与量 | Tmax(h) | Cmax(μg/mL) | t1/2(h) |
| 20mg | 1.31 | 1.52 | 1.16 |
| 40mg | 1.75 | 3.13 | 1.12 |
| 60mg | 0.92 | 4.68 | 1.27 |
図1 健康成人男性における空腹時投与の用量別血漿中ナテグリニド濃度
16.2 吸収
16.2.1 食事の影響
健康成人男性(n=10)に食前にナテグリニド60mgを経口投与したとき注)、投与後約0.5時間で最高値に達し、半減期は約1時間であった2)。
図2 健康成人男性における食事の影響
16.4 代謝
健康成人男性にナテグリニド60mgを経口投与したとき注)、血漿中のナテグリニドの代謝物としてイソプロピル基の水酸化体が最も多く、次いでイソプロピル基の脱水素体が認められ、他の代謝物は検出されなかった。
ナテグリニドは、ラット及びイヌにおいて肝臓及び腎臓で代謝され、ヒトにおいては主として肝臓の薬物代謝酵素CYP2C9で代謝された(in vitro試験)。[10.参照]
ナテグリニドは、ラット及びイヌにおいて肝臓及び腎臓で代謝され、ヒトにおいては主として肝臓の薬物代謝酵素CYP2C9で代謝された(in vitro試験)。[10.参照]
16.5 排泄
尿中にはイソプロピル基の水酸化体が主として排泄され(投与量の約40%)、未変化体の尿中排泄率は約5%であった。一方、ラット及びイヌに放射能標識したナテグリニドを投与したとき、投与した放射能の30〜40%が尿中に、50〜60%が胆汁中に排泄された。
16.7 薬物相互作用
16.7.1 ビグアナイド系薬剤併用時の血漿中濃度
16.7.2 チアゾリジン系薬剤併用時の血漿中濃度
ピオグリタゾン塩酸塩使用中の2型糖尿病患者に、ナテグリニドを朝食直前に120mg単回経口投与したときの血漿中濃度は、ナテグリニドを単独で同用量単回投与したときの結果と類似していた。また、ピオグリタゾン塩酸塩の未変化体及び活性化合物合計の血清中濃度に対し、本剤併用による影響はなかった6)。
注)本剤の承認された1回用量は90mg(効果不十分な場合は120mgまで)である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 単独療法
(1)国内第III相二重盲検比較試験
2型糖尿病患者(190例)を対象に、本剤1回90mgまたは対照薬を1日3回毎食直前12週間経口投与した。本剤投与により食後血糖2時間値は投与前234.4mg/dLから投与後185.9mg/dLに低下した(低下量平均:48.5mg/dL)。また、HbA1c(JDS)値は投与前7.36%から投与後6.68%に低下した(低下量平均:0.69%)。副作用発現割合は18.9%(17/90例)であり、低血糖症状の発現割合は3.3%(3/90例)であった7)。
(2)国内長期継続投与試験
12週間の用量設定試験終了後、長期継続試験に移行した2型糖尿病患者(93例)を対象に、本剤1回30mg注)、60mg注)、90mg又は120mgを1日3回毎食直前40週間(合計52週間)継続投与した結果、効果の持続が確認され、安定した血糖コントロールが得られた。用量設定試験期間を含めた副作用発現割合は本剤90mgでは7.4%(2/27例)、120mgでは20.8%(5/24例)であり、すべて低血糖症状であった8)。
(3)国内長期投与試験
2型糖尿病患者(23例)を対象に、本剤1回90mg(120mgに増量可能)を1日3回毎食直前52週間経口投与した結果、効果の持続が確認され、安定した血糖コントロールが得られた。副作用の発現は認められなかった9)。
17.1.2 併用療法(α-グルコシダーゼ阻害剤との併用試験)
(1)国内第III相併用試験
α-グルコシダーゼ阻害剤で治療中の2型糖尿病患者(31例)を対象に、本剤1回60mg注)を1日3回毎食直前に2週間経口投与した時点で安全性を確認し、増量可能と判断された症例については1回90mgに増量し、さらに8週間(合計10週間)経口投与した。食後血糖2時間値は併用投与前215.4mg/dLから併用投与10週後158.9mg/dLに低下した(低下量平均:56.5mg/dL)。また、HbA1c(JDS)値は併用投与前7.14%から併用投与10週後6.50%に低下した(低下量平均:0.63%)。副作用発現割合は14.8%(4/27例)であり、低血糖症状の発現割合は7.4%(2/27例)であった10)。
17.1.3 併用療法(ビグアナイド系薬剤との併用試験)
(1)国内第II相二重盲検併用試験
ビグアナイド系薬剤で治療中の2型糖尿病患者(80例)を対象に、本剤1回60mg注)、90mg、120mg又はプラセボを1日3回毎食直前12週間経口投与した。食後血糖2時間値は本剤90mg(19例)で併用投与前252.6mg/dLから併用投与後179.2mg/dLに低下した(低下量平均:73.5mg/dL)。また、HbA1c(JDS)値は本剤90mg(20例)で併用投与前7.52%から併用投与後6.73%に低下した(低下量平均:0.76%)。副作用発現割合は本剤90mgでは25.0%(5/20例)、120mgでは22.7%(5/22例)であり、低血糖症状の発現割合は本剤90mg、120mgでそれぞれ5.0%(1/20例)、13.6%(3/22例)であった3)11)。
(2)国内長期投与試験
ビグアナイド系薬剤にて血糖管理不十分な2型糖尿病患者(74例)を対象に、本剤1回90mg(120mgに増量又は60mg注)に減量可能)を1日3回毎食直前52週間併用投与した結果、効果の持続が確認され、安定した食後血糖推移の改善効果が得られた。副作用の発現割合は全用量で9.5%(7/74例)であり、このうち90mg維持例では6.3%(3/48例)、90mgから120mgへ増量例では15.4%(4/26例)であった。低血糖症状の発現割合は本剤90mg維持例、90mgから120mgへ増量例でそれぞれ4.2%(2/48例)、15.4%(4/26例)であった12)。
17.1.4 併用療法(チアゾリジン系薬剤との併用試験)
(1)国内第II/III相二重盲検併用試験
チアゾリジン系薬剤(ピオグリタゾン塩酸塩)で治療中の2型糖尿病患者(295例)を対象に、本剤1回60mg注)、90mg、120mg又はプラセボを1日3回毎食直前24週間経口投与した。食後血糖2時間値は本剤90mg(63例)で併用投与前254.6mg/dLから併用投与後201.9mg/dLに低下した(低下量平均:48.0mg/dL)。また、HbA1c(JDS)値は本剤90mg(70例)で併用投与前7.41%から併用投与後6.94%に低下した(低下量平均:0.47%)13)14)。本剤90mgまたは120mg併用投与時の副作用発現割合はそれぞれ18.6%(13/70例)及び21.1%(16/76例)であり、低血糖症状の発現割合はそれぞれ12.9%(9/70例)、10.5%(8/76例)であった13)。
(2)国内長期継続投与試験
上記17.1.4(1)の二重盲検併用試験終了後、長期継続投与試験に移行した患者(184例)を対象に、引き続き、本剤の各用量又はプラセボを1日3回毎食直前28週間(合計52週間)継続投与した結果、効果の持続が確認され、安定した血糖コントロールが得られた。本剤90mgまたは120mg併用投与時の副作用発現割合はそれぞれ13.6%(6/44例)及び11.3%(7/62例)であり、低血糖症状の発現割合はそれぞれ2.3%(1/44例)、8.1%(5/62例)であった15)。
注)本剤の承認された1回用量は90mg(効果不十分な場合は120mgまで)である。
18. 薬効薬理
18.1 作用機序
ナテグリニドは膵β細胞を剌激し、インスリンの分泌を促進した16)(in vitro)。
18.2 血糖上昇抑制作用
18.2.1 健康成人男性6例に60mgを1日3回、毎食前に7日間経口投与した場合、毎食後の早期のインスリン分泌を促進し、血糖上昇を抑制した17)。
18.2.2 非肥満型2型糖尿病モデル動物のGKラット及び新生児ストレプトゾトシン誘発(nSTZ)糖尿病モデルラットにナテグリニドを経口投与すると、障害されたインスリン分泌応答と耐糖能を改善した18)19)(in vivo)。
18.2.3 正常ラットにナテグリニドを経口投与すると、各種糖質(グルコース、スクロース、スターチ、ラクトース及び混合糖液)経口負荷後の血糖上昇を抑制し、投与後2時間以内に対照群の値まで回復した20)(in vivo)。
18.2.4 正常ラットにナテグリニドを経口投与すると、スクロース経口負荷後15〜30分の早期インスリン分泌を促進した20)(in vivo)。
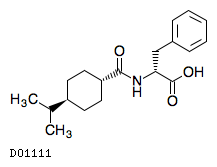
19. 有効成分に関する理化学的知見
19.1. ナテグリニド
22. 包装
<スターシス錠30mg>
100錠(10錠×10)
<スターシス錠90mg>
100錠(10錠×10)
23. 主要文献
- 小坂樹徳 他, 薬理と臨床, 7 (5), 585-599, (1997)
- 小坂樹徳 他, 薬理と臨床, 7 (5), 615-634, (1997)
- 菊池方利 他, 臨床医薬, 24 (8), 717-739, (2008)
- 小坂樹徳 他, 薬理と臨床, 7 (5), 653-668, (1997)
- Hirschberg,Y.et al., Diabetes Care, 23 (3), 349-353, (2000) »PubMed »DOI
- 江藤 隆 他, 臨床医薬, 25 (1), 77-91, (2009)
- 小坂樹徳 他, 薬理と臨床, 7 (5), 699-727, (1997)
- 小坂樹徳 他, 薬理と臨床, 7 (5), 797-818, (1997)
- 葛谷 健 他, 薬理と臨床, 7 (5), 819-832, (1997)
- 垂井清一郎 他, 薬理と臨床, 7 (5), 767-784, (1997)
- EAファーマ(株)社内資料:2型糖尿病患者・第II相二重盲検群間比較試験−補足資料(DIR080168)
- 菊池方利, 臨床医薬, 24 (8), 741-760, (2008)
- 菊池方利 他, 臨床医薬, 25 (1), 35-56, (2009)
- 社内報告書:2型糖尿病患者・第II/III相二重盲検群間比較試験−補足資料(DIR090097)
- 菊池方利, 臨床医薬, 25 (1), 57-75, (2009)
- Ikenoue,T.et al., Br.J.Pharmacol., 120 (1), 137-145, (1997) »PubMed »DOI
- 小坂樹徳 他, 薬理と臨床, 7 (5), 601-614, (1997)
- EAファーマ(株)社内資料:自然発症糖尿病モデルGKラット・薬理作用(DIR070095)
- 秋吉 恵 他, 基礎と臨床, 31 (5), 1725-1735, (1997)
- Ikenoue,T.et al., Biol.Pharm.Bull., 20 (4), 354-359, (1997) »PubMed »DOI
24. 文献請求先及び問い合わせ先
文献請求先
アステラス製薬株式会社
メディカルインフォメーションセンター
〒103-8411
東京都中央区日本橋本町2丁目5番1号
電話:フリーダイヤル 0120-189-371
製品情報問い合わせ先
アステラス製薬株式会社
メディカルインフォメーションセンター
〒103-8411
東京都中央区日本橋本町2丁目5番1号
電話:フリーダイヤル 0120-189-371
26. 製造販売業者等
26.1 製造販売
アステラス製薬株式会社
東京都中央区日本橋本町2丁目5番1号