医薬品情報
| 総称名 | サリグレン |
|---|---|
| 一般名 | セビメリン塩酸塩水和物 |
| 欧文一般名 | Cevimeline Hydrochloride Hydrate |
| 製剤名 | セビメリン塩酸塩水和物カプセル |
| 薬効分類名 | 口腔乾燥症状改善薬 |
| 薬効分類番号 | 2399 |
| ATCコード | N07AX03 |
| KEGG DRUG |
D00661
セビメリン塩酸塩水和物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年6月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| サリグレンカプセル30mg | Saligren Capsules 30mg | 日本化薬 | 2399012M1034 | 64.6円/カプセル |
2. 禁忌
次の患者には投与しないこと
2.1 重篤な虚血性心疾患(心筋梗塞、狭心症等)の患者[冠状動脈硬化に伴う狭窄所見を冠状動脈攣縮により増強し、虚血性心疾患の病態を悪化させるおそれがある。]
2.2 気管支喘息及び慢性閉塞性肺疾患の患者[気管支収縮作用及び気管支粘液分泌亢進のため、症状を悪化させるおそれがある。]
2.3 消化管及び膀胱頸部に閉塞のある患者[消化管又は膀胱筋を収縮又は緊張させ、症状を悪化させるおそれがある。]
2.4 てんかんのある患者[てんかん発作を起こすおそれがある。]
2.5 パーキンソニズム又はパーキンソン病の患者[パーキンソニズム又はパーキンソン病の症状を悪化させるおそれがある。]
2.6 虹彩炎のある患者[縮瞳が症状を悪化させるおそれがある。]
4. 効能または効果
シェーグレン症候群患者の口腔乾燥症状の改善
6. 用法及び用量
通常、成人にはセビメリン塩酸塩として1回30mgを1日3回、食後に経口投与する。
8. 重要な基本的注意
8.1 本剤投与により効果が認められない場合には、漫然と長期にわたり投与しないように注意すること。
8.2 縮瞳を起こすおそれがあるので、投与中の患者には夜間の自動車の運転及び暗所での危険を伴う機械の操作に注意させること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 高度の唾液腺腫脹及び唾液腺の疼痛を有する患者
症状を悪化させるおそれがある。
9.1.2 間質性肺炎の患者
間質性肺炎を増悪する可能性がある。[11.1.1参照]
9.1.3 膵炎の患者
膵液の分泌が亢進し、症状を悪化させるおそれがある。
9.1.4 過敏性腸疾患の患者
腸管運動が亢進し、症状を悪化させるおそれがある。
9.1.5 消化性潰瘍の患者
消化液の分泌が亢進し、症状を悪化させるおそれがある。
9.1.6 胆のう障害又は胆石のある患者
胆管を収縮させ、症状を悪化させるおそれがある。
9.1.7 尿路結石又は腎結石のある患者
尿管及び尿道を収縮させ、症状を悪化させるおそれがある。
9.1.8 前立腺肥大に伴う排尿障害のある患者
膀胱筋を収縮又は緊張させ、排尿障害を悪化させるおそれがある。
9.1.9 甲状腺機能亢進症の患者
心血管系に作用し、不整脈又は心房細動を起こすおそれがある。
9.1.10 全身性進行性硬化症の患者
心血管系、消化器系に作用し、症状を悪化させるおそれがある。
9.2 腎機能障害患者
高い血中濃度が持続し、副作用の発現率が高まるおそれがある。
9.3 肝機能障害患者
高い血中濃度が持続し、副作用の発現率が高まるおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(ラット)で出生児の体重減少が認められている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中への移行が認められている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
慎重に投与すること。肝・腎機能が低下していることが多く、高い血中濃度が持続するおそれがある。
10. 相互作用
10.2 併用注意
| コリン作動薬 アセチルコリン塩化物 ベタネコール塩化物 等 コリンエステラーゼ阻害薬 ネオスチグミン アンベノニウム塩化物 等 アセチルコリン放出促進作用を有する薬剤 モサプリド 等 | 本剤又はこれらの薬剤の作用が増強されることがある。 | 併用によりムスカリン様作用が増強されると考えられている。 |
| 抗コリン作動薬 アトロピン硫酸塩水和物 スコポラミン臭化水素酸塩水和物 等 | 本剤又はこれらの薬剤の作用が減弱されることがある。 | 本剤の作用と拮抗的に作用すると考えられている。 |
| 抗コリン作用を有する薬剤 フェノチアジン系抗精神病薬 クロルプロマジン 等 三環系抗うつ薬 アミトリプチリン塩酸塩 イミプラミン塩酸塩 等 | 本剤の作用が減弱されることがある。 | 本剤の作用と拮抗的に作用すると考えられている。 |
| チトクロームP450CYP2D6の阻害薬 キニジン硫酸塩水和物 等 チトクロームP450CYP3A4の阻害薬 イトラコナゾール エリスロマイシン 等 チトクロームP450の非特異的阻害薬 シメチジン 等 | 本剤の作用が増強される可能性がある。 | 本剤の代謝酵素が阻害されるため、本剤の血中濃度が上昇すると考えられている。 |
| チトクロームP450の誘導薬 フェノバルビタール リファンピシン 等 | 本剤の作用が減弱される可能性がある。 | 本剤の代謝酵素が誘導されるため、本剤の血中濃度が低下すると考えられている。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 間質性肺炎の増悪(0.2%)
異常が認められた場合には投与を中止し、副腎皮質ホルモン剤の投与など適切な処置を行うこと。[9.1.2参照]
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 精神神経系 | 頭痛 | めまい、振戦、不眠、うつ病 | 傾眠 | |
| 感覚器 | 霧視 | |||
| 消化器 | 嘔気、腹痛 | 下痢、嘔吐、食欲不振、唾液腺痛、唾液腺腫大 | 消化不良、鼓腸放屁、便秘 | 胃部不快感 |
| 循環器 | 心悸亢進、心電図異常 | 脈拍不整、高血圧、頻脈 | ||
| 呼吸器 | 呼吸困難、肺浸潤 | |||
| 血液 | 赤血球減少、ヘモグロビン減少、ヘマトクリット値低下、白血球減少 | |||
| 泌尿器 | 頻尿 | |||
| 皮膚 | 多汗 | 発疹、そう痒 | ||
| 肝臓 | ALT上昇、AST上昇、γ-GTP上昇、ALP上昇 | LAP上昇、LDH上昇、総ビリルビン上昇、肝機能異常 | ||
| 腎臓 | 尿中NAG上昇 | 尿蛋白陽性、BUN上昇 | ||
| その他 | 血清アミラーゼ上昇、胸痛、倦怠感、中性脂肪上昇 | 血清カリウム低下、味覚異常、総コレステロール上昇、悪寒、筋肉痛 | 浮腫、熱感 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
<健康成人>
健康成人(男性、平均体重66.2kg)6名に本剤30mgを空腹時に単回経口投与したとき、本剤は速やかに吸収され、投与後1.5時間で70.9ng/mLのCmaxに達した後、約4時間のt1/2で消失した。AUC0〜∞は435.7ng・hr/mLであった1)。
セビメリン塩酸塩単回経口投与時の血漿中濃度推移
<シェーグレン症候群患者>
シェーグレン症候群患者(女性、平均体重43.4kg)6名に本剤30mgを空腹時に単回経口投与したとき、本剤は速やかに吸収され、投与後1.5時間で91.6ng/mLのCmaxに達した後、約5時間のt1/2で消失した。AUC0〜∞は711.1ng・hr/mLであった。シェーグレン症候群患者では健康成人と比較して、tmaxは同じ値を示したが、Cmax及びAUC0〜∞はそれぞれ1.3倍及び1.6倍高い値を示した2)。
| Cmax(ng/mL) | tmax(hr) | t1/2(hr) | AUC0〜∞(ng・hr/mL) | CL/F(L/hr/kg) | Vd/F(L/kg) | |
| 健康成人注1) | 70.9±17.3 | 1.5±0.6 | 3.9±1.2 | 435.7±165.1 | 1.00±0.37 | 5.2±0.8 |
| 患者注2) | 91.6±23.0 | 1.5±0.8 | 5.1±1.6 | 711.1±270.7 | 0.97±0.48 | 6.7±2.4 |
16.2 吸収
健康成人男子6名に本剤30mgを食後又は空腹時に単回経口投与したとき、未変化体のtmaxは食後及び空腹時でそれぞれ2.5及び1.2時間であり、食事により有意に遅延した。Cmax及びAUC0〜∞は食後及び空腹時でほとんど変化しなかった。
16.3 分布
本剤の血漿蛋白に対する結合率は、50〜1,000ng/mLの添加濃度で17.4〜19.5%であり、結合率の濃度依存性は認められなかった(in vitro)。
16.4 代謝
主な代謝物はトランススルホキシド体及びシススルホキシド体であった。これらの代謝物は主として肝代謝酵素チトクロームP450の分子種CYP2D6及びCYP3A4によって生成することが示された(in vitro)。
16.5 排泄
本剤の主排泄経路は尿であった。健康成人男子6名に本剤30mgを単回投与したとき、投与後24時間までの未変化体の尿中排泄率は18.2±8.6%であった。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内前期第II相試験
本剤を低用量(10mg×3回/日)、中用量(20mg×3回/日)、高用量(30mg×3回/日)と漸増投与したとき、唾液分泌改善度、自覚症状改善度及び他覚症状改善度を総合評価した結果、改善率(中等度改善以上)は55.3%(21/38例)であった。
主な副作用は、嘔気14.3%(7/49例)、腹痛8.2%(4/49例)、倦怠感6.1%(3/49例)であった3)。
主な副作用は、嘔気14.3%(7/49例)、腹痛8.2%(4/49例)、倦怠感6.1%(3/49例)であった3)。
注)本剤の承認用量は1回30mgを1日3回である。
17.1.2 国内後期第II相試験
本剤30mgを1日3回食後に4週間投与したとき、唾液分泌改善度、自覚症状改善度及び他覚症状改善度を総合評価した結果、改善率(中等度改善以上)は47.2%(25/53例)であった。
主な副作用は、嘔気12.9%(8/62例)、腹痛6.5%(4/62例)であった4)。
主な副作用は、嘔気12.9%(8/62例)、腹痛6.5%(4/62例)であった4)。
17.1.3 国内第III相比較試験
プラセボを対象とした無作為化二重盲検比較試験において、本剤30mgを1日3回食後に4週間投与したとき、唾液分泌改善度、自覚症状改善度及び他覚症状改善度を総合評価した結果、改善率(中等度改善以上)は、本剤群56.0%(47/84例)、プラセボ群23.3%(21/90例)であり、両群間に有意差が認められた(U検定:p<0.001)。
主な副作用は、嘔気10.9%(11/101例)、アミラーゼ上昇10.1%(8/79例)、腹痛6.9%(7/101例)であった5)。
主な副作用は、嘔気10.9%(11/101例)、アミラーゼ上昇10.1%(8/79例)、腹痛6.9%(7/101例)であった5)。
17.1.4 国内一般臨床試験(長期投与試験)
本剤30mgを1日3回食後に28週間〜52週投与したとき、唾液分泌改善度、自覚症状改善度及び他覚症状改善度を総合評価した結果、改善率(中等度改善以上)は、4週後24.8%(80/323例)、12週後40.6%(121/298例)、28週後54.6%(131/240例)、52週後61.2%(101/165例)であり、最終評価時において55.6%(200/360例)であった。
主な副作用は、嘔気11.3%(52/462例)、腹痛7.6%(35/462例)、下痢5.2%(24/462例)であり、28週以上の投与において副作用の頻度の増加又は新たな重度の副作用の発現等は認められなかった6)。
なお、投与中止例は安全性採用例462例中147例(31.8%)あり、そのうち副作用による中止例は93例(20.1%)であった。また、副作用により中止した93例中47例(50.5%)は投与開始後4週間以内に中止し、さらに、93例中64例(68.8%)は消化器障害による中止であった。
主な副作用は、嘔気11.3%(52/462例)、腹痛7.6%(35/462例)、下痢5.2%(24/462例)であり、28週以上の投与において副作用の頻度の増加又は新たな重度の副作用の発現等は認められなかった6)。
なお、投与中止例は安全性採用例462例中147例(31.8%)あり、そのうち副作用による中止例は93例(20.1%)であった。また、副作用により中止した93例中47例(50.5%)は投与開始後4週間以内に中止し、さらに、93例中64例(68.8%)は消化器障害による中止であった。
18. 薬効薬理
19. 有効成分に関する理化学的知見
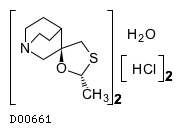
19.1. セビメリン塩酸塩水和物
20. 取扱い上の注意
アルミピロー包装開封後は、湿気を避けて保存すること。
22. 包装
42カプセル[21カプセル(PTP)×2]
100カプセル[10カプセル(PTP)×10]
23. 主要文献
- 大谷義夫ほか, 臨床医薬, 6, 1551-1576, (1990)
- 柏崎禎夫ほか, 診療と新薬, 38, 393-405, (2001)
- 柏崎禎夫ほか, 診療と新薬, 38, 313-332, (2001)
- 柏崎禎夫ほか, 診療と新薬, 38, 333-347, (2001)
- 市川陽一ほか, 診療と新薬, 38, 349-368, (2001)
- 市川陽一ほか, 診療と新薬, 38, 369-391, (2001)
- 作用機序(2001年6月20日承認、申請資料概要ホ.1.(2))
- Iga Y,et al., Jpn.J.Pharmacol., 78, 373-380, (1998) »PubMed
- Masunaga H,et al., Eur.J.Pharmacol., 339, 1-9, (1997) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
日本化薬株式会社
医薬品情報センター
〒100-0005
東京都千代田区丸の内二丁目1番1号
電話:0120-505-282
製品情報問い合わせ先
日本化薬株式会社
医薬品情報センター
〒100-0005
東京都千代田区丸の内二丁目1番1号
電話:0120-505-282
26. 製造販売業者等
26.1 製造販売元
日本化薬株式会社
東京都千代田区丸の内二丁目1番1号