医薬品情報
| 総称名 | スオード |
|---|---|
| 一般名 | プルリフロキサシン |
| 欧文一般名 | Prulifloxacin |
| 製剤名 | プルリフロキサシン錠 |
| 薬効分類名 | ニューキノロン系経口抗菌製剤 |
| 薬効分類番号 | 6241 |
| ATCコード | J01MA17 |
| KEGG DRUG |
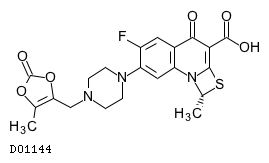
D01144
プルリフロキサシン
|
| KEGG DGROUP |
DG01549
ニューキノロン系抗生物質
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年6月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| スオード錠100 | SWORD TABLETS | Meiji Seikaファルマ | 6241015F1023 | 66.3円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
<適応菌種>
<適応症>
5. 効能または効果に関連する注意
<咽頭・喉頭炎、扁桃炎、急性気管支炎、感染性腸炎、副鼻腔炎>
「抗微生物薬適正使用の手引き」1)を参照し、抗菌薬投与の必要性を判断した上で、本剤の投与が適切と判断される場合に投与すること。
6. 用法及び用量
通常、成人に対して、プルリフロキサシンとして1回264.2mg(活性本体として200mg)を1日2回経口投与する。なお、症状により適宜増減するが、1回用量は396.3mg(活性本体として300mg)を上限とする。
肺炎、慢性呼吸器病変の二次感染には、プルリフロキサシンとして1回396.3mg(活性本体として300mg)を1日2回経口投与する。
8. 重要な基本的注意
8.1 本剤の使用にあたっては、耐性菌の発現等を防ぐため、原則として感受性を確認し、疾病の治療上必要な最小限の期間の投与にとどめること。
8.2 本剤の使用にあたっては、定められた用法・用量を守り、疾病の治療上必要な最小限の期間の投与にとどめること。[15.2参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 てんかん等の痙攣性疾患又はこれらの既往歴のある患者
9.1.2 重症筋無力症の患者
9.1.3 大動脈瘤又は大動脈解離を合併している患者、大動脈瘤又は大動脈解離の既往、家族歴若しくはリスク因子(マルファン症候群/ロイス・ディーツ症候群等)を有する患者
9.2 腎機能障害患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。[2.2参照]
9.6 授乳婦
授乳しないことが望ましい。動物実験(ラット)で乳汁中へ移行することが報告されている。
9.7 小児等
投与しないこと。動物実験(若齢ラット、若齢イヌ)で関節異常が認められている。小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。[2.3参照]
9.8 高齢者
10. 相互作用
10.1 併用禁忌
| フェンブフェン フルルビプロフェン アキセチル (ロピオン) フルルビプロフェン (フロベン等) [2.4参照] | 痙攣を起こすおそれがある。 | 本剤のGABAA受容体結合阻害作用が増強され、痙攣が誘発されると考えられる。 |
10.2 併用注意
| テオフィリン アミノフィリン水和物等 [9.2.1、9.8.2参照] | テオフィリンの血中濃度を上昇させ、その作用を増強させることがある。併用する場合にはテオフィリンを減量するなど適切な処置を行う。 | 軽度なCYP1A阻害作用によりテオフィリンの肝での代謝を抑制し、血中濃度を上昇させると考えられる。高齢者、腎障害のある患者では特に注意する。 |
| フェニル酢酸系非ステロイド性消炎鎮痛剤(ただしフェンブフェンは併用禁忌) ジクロフェナク等 プロピオン酸系非ステロイド性消炎鎮痛剤(ただしフルルビプロフェン アキセチル及びフルルビプロフェンは併用禁忌) ケトプロフェン等 [9.1.1、9.2.1、9.8.2、11.1.14参照] | 痙攣を起こすおそれがある。症状が認められた場合、両剤の投与を中止するなど適切な処置を行う。 | 本剤のGABAA受容体結合阻害作用が増強され、痙攣が誘発されると考えられる。 てんかん等の痙攣性疾患又はこれらの既往歴のある患者、高齢者、腎障害のある患者では特に注意する。 |
| アルミニウム又はマグネシウム含有の制酸剤 酸化マグネシウム等 鉄剤 クエン酸第一鉄ナトリウム等 カルシウム含有製剤 沈降炭酸カルシウム、L-アスパラギン酸カルシウム水和物等 | 本剤の効果が減弱されるおそれがある。これらの薬剤を投与する場合は、本剤投与後2時間以上あけるなど注意すること。 | これらの薬剤の金属イオンとキレートを形成し、吸収を阻害すると考えられる。 |
| H2-受容体拮抗剤 シメチジン等 プロトンポンプ阻害剤 オメプラゾール等 | 本剤の効果が減弱されるおそれがある。 | これらの薬剤により胃内pHが上昇し、本剤の溶解性が低下した結果、吸収が低下すると考えられる。 |
| 副腎皮質ホルモン剤(経口剤及び注射剤) プレドニゾロン ヒドロコルチゾン等 [9.8.1、11.1.7参照] | 腱障害のリスクが増大するとの報告がある。これらの薬剤との併用は、治療上の有益性が危険性を上回る場合のみとすること。 | 機序不明 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
呼吸困難、血圧低下、全身発赤、蕁麻疹、顔面の浮腫等があらわれた場合には、投与を中止し、適切な処置を行うこと。
11.1.2 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)、多形紅斑(いずれも頻度不明)
11.1.3 横紋筋融解症(0.1%未満)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇を特徴とし、急激な腎機能悪化を伴う横紋筋融解症があらわれることがある。
11.1.4 間質性肺炎(頻度不明)
発熱、咳嗽、呼吸困難、肺音の異常(捻髪音)等が認められた場合には、速やかに胸部X線、胸部CT、血清マーカー等の検査を実施し、異常が認められた場合には、投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.5 低血糖(頻度不明)
意識レベル低下、痙攣、全身倦怠感等があらわれた場合には、投与を中止し、適切な処置を行うこと。高齢者、腎障害患者、糖尿病患者であらわれやすい。
11.1.7 アキレス腱炎、腱断裂等の腱障害(頻度不明)
11.1.8 せん妄、記憶障害等の精神症状(頻度不明)
11.1.9 汎血球減少、無顆粒球症、溶血性貧血、血小板減少(いずれも頻度不明)
11.1.10 急性腎障害等の重篤な腎障害(頻度不明)
11.1.11 肝機能障害、黄疸(いずれも頻度不明)
11.1.12 心室頻拍(Torsade de pointesを含む)、QT延長(いずれも頻度不明)
11.1.13 偽膜性大腸炎等の血便を伴う重篤な大腸炎(頻度不明)
腹痛、頻回の下痢等があらわれることがある。
11.1.15 血管炎(頻度不明)
11.1.16 重症筋無力症の悪化(頻度不明)[9.1.2参照]
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | 発疹 | 湿疹、そう痒感、蕁麻疹 | 浮腫、光線過敏症 |
| 腎臓 | BUN、クレアチニンの上昇、血尿 | ||
| 肝臓 | AST、ALT、Al-P、LDH、γ-GTP、LAP、ビリルビンの上昇 | ||
| 消化器 | 腹痛、下痢、嘔気、嘔吐、食欲不振、消化不良、口内炎 | 便秘、口角炎 | |
| 血液 | 白血球減少、血小板減少、好酸球増多 | ||
| 精神神経系 | 頭痛、めまい | 不眠、眠気 | |
| その他 | 胸痛、脱力感、CK上昇 | 発熱、耳鳴、呼吸困難、動悸、筋肉痛、倦怠感、ほてり、結膜充血 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
無酸症等著しい低胃酸状態が持続する患者では、胃内pHの上昇により、本剤の溶解性が低下し、吸収が低下することが考えられる。
15.2 非臨床試験に基づく情報
動物実験(サル)で、長期(52週間)投与により、眼(脈絡膜・色素上皮)にulifloxacinの蓄積が認められている。[8.2参照]
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
本剤は内服後小腸上部より吸収され、腸管組織中、門脈血中及び肝臓通過時に加水分解されて、活性本体であるulifloxacinとして全身に分布するプロドラッグ型の薬剤である。健康成人に132.1、264.2及び528.4mg※を空腹時単回経口投与した後の血漿中ulifloxacin濃度は図1のとおりで、薬物動態パラメータは表1のとおりであった3)。
※本剤の承認された1回用量は264.2〜396.3mgである。
図1 健康成人におけるプルリフロキサシン単回経口投与後の血漿中ulifloxacin濃度
| 投与量(mg) | 例数 | Tmax(hr) | Cmax(μg/mL) | T1/2(hr) | AUC0-∞(μg・hr/mL) |
| 132.1 | 6 | 1.3±0.9 | 0.68±0.33 | 7.7±2.0 | 3.99±1.51 |
| 264.2 | 6 | 0.7±0.3 | 1.09±0.41 | 8.9±1.6 | 6.41±1.75 |
| 528.4 | 6 | 0.7±0.3 | 1.88±0.60 | 7.9±1.6 | 9.72±3.55 |
16.3 分布
16.3.1 蛋白結合率
限外濾過法により測定したヒト血清蛋白との結合率は、ulifloxacin濃度0.1〜10μg/mLの範囲で50.9〜52.1%であった4)(in vitro)。
16.3.2 組織移行性
16.4 代謝
16.5 排泄
健康成人に132.1及び264.2mg投与した後24時間までの累積尿中ulifloxacin排泄率はそれぞれ43.1及び36.2%であった。反復投与による蓄積性は認められなかった3)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者の薬物動態
腎機能障害患者に264.2mgを食後単回経口投与した後の薬物動態パラメータは、表2のとおりであった。腎機能障害患者では健康成人と比較し、血清中ulifloxacin濃度半減期の延長、AUCの増大及び24時間累積尿中ulifloxacin排泄率の低下が認められた14)。[9.2.1参照]
| 患者条件[Ccr(mL/min)] | 例数 | T1/2(hr) | AUC0-∞(μg・hr/mL) | 24時間累積尿中排泄率(%) |
| 40≦Ccr<70 | 3 | 9.5±3.9 | 15.0±6.2 | 30.8±4.9 |
| 20≦Ccr<40 | 3 | 13.9±2.3 | 18.8±10.5 | 13.2±8.5 |
| Ccr<20 | 1 | 33.7 | 42.8 | 2.6 |
16.6.2 高齢者の薬物動態
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床試験
比較試験及び一般臨床試験を含む臨床試験の概要は以下のとおりである。なお、呼吸器感染症(慢性呼吸器病変の二次感染、肺炎)及び複雑性尿路感染症(腎盂腎炎、膀胱炎)については二重盲検比較試験で有用性が確認されている。
| 疾患名 | 臨床効果 ( )内は有効率% | ||
| 皮膚科領域感染症 | 表在性皮膚感染症 | ||
| 急性表在性毛包炎 | 30/33(90.9) | ||
| 伝染性膿痂疹 | 8/8(100) | ||
| 深在性皮膚感染症 | |||
| 蜂巣炎 | 13/14(92.9) | ||
| 丹毒 | 2/2 | ||
| せつ、せつ腫症、よう | 35/38(92.1) | ||
| 化膿性爪囲炎 | 16/16(100) | ||
| ひょう疽 | 12/12(100) | ||
| 慢性膿皮症 | |||
| 感染性粉瘤 | 90/94(95.7) | ||
| 化膿性汗腺炎 | 1/1 | ||
| 皮下膿瘍 | 11/11(100) | ||
| その他の慢性膿皮症 | 2/2 | ||
| 小計 | 220/231(95.2) | ||
| 外科領域感染症 | 肛門周囲膿瘍 | 22/22(100) | |
| 外傷・熱傷及び手術創等の二次感染 | 48/59(81.4) | ||
| 小計 | 70/81(86.4) | ||
| 呼吸器感染症 | 急性上気道感染症群 | ||
| 扁桃炎 | 74/85(87.1) | ||
| 咽頭・喉頭炎 | 43/46(93.5) | ||
| 急性気管支炎 | 91/100(91.0) | ||
| 慢性呼吸器病変の二次感染 | |||
| 慢性気管支炎 | 157/182(86.3) | ||
| 気管支拡張症 | 86/101(85.1) | ||
| その他の慢性呼吸器疾患の二次感染 | 130/147(88.4) | ||
| 肺炎 | 226/245(92.2) | ||
| 小計 | 807/906(89.1) | ||
| 尿路感染症 | 腎盂腎炎 | 76/107(71.0) | |
| 膀胱炎 | 510/616(82.8) | ||
| 前立腺炎(急性症、慢性症) | 20/24(83.3) | ||
| 小計 | 606/747(81.1) | ||
| 胆道感染症 | 胆嚢炎 | 12/13(92.3) | |
| 胆管炎 | 15/17(88.2) | ||
| 小計 | 27/30(90.0) | ||
| 感染性腸炎 | 感染性腸炎 | 23/23(100) | |
| 細菌性赤痢 | 18/18(100) | ||
| サルモネラ症 | 8/9(88.9) | ||
| コレラ | 4/4 | ||
| 小計 | 53/54(98.1) | ||
| 産婦人科領域感染症 | 内性器感染症 | ||
| 子宮内感染 | 54/57(94.7) | ||
| 子宮付属器炎 | 26/26(100) | ||
| 小計 | 80/83(96.4) | ||
| 眼科領域感染症 | 麦粒腫 | 28/30(93.3) | |
| 耳鼻科領域感染症 | 中耳炎 | 42/60(70.0) | |
| 副鼻腔炎 | 70/81(86.4) | ||
| 小計 | 112/141(79.4) | ||
| 合計 | 2003/2303(87.0) | ||
18. 薬効薬理
18.1 作用機序
18.2 in vitro抗菌作用
18.3 実験的感染症に対する治療効果
19. 有効成分に関する理化学的知見
19.1. プルリフロキサシン
20. 取扱い上の注意
アルミピロー包装開封後は、湿気を避けて保存すること。
22. 包装
PTP包装(乾燥剤入)
100錠(10錠×10) 500錠(10錠×50)
23. 主要文献
- 厚生労働省健康局結核感染症課編:抗微生物薬適正使用の手引き
- Sieb,J.P., Neurology., 50, 804-807, (1998) »PubMed
- 中島光好ほか, 日本化学療法学会雑誌, 44 (S-1), 180-206, (1996)
- Okuyama,Y.,et al., Arzneim.-Forsch./Drug Res., 47 ((I)3), 276-284, (1997) »PubMed
- 鈴木恵三ほか, 日本化学療法学会雑誌, 44 (S-1), 405-413, (1996)
- 村上浩一ほか, 日本化学療法学会雑誌, 44 (S-1), 462-469, (1996)
- 山元貴雄ほか, 産婦人科の世界, 48 (7), 671-689, (1996)
- 荒田次郎ほか, 日本化学療法学会雑誌, 44 (S-1), 509-517, (1996)
- 馬場駿吉ほか, 耳鼻と臨床, 43 (3), 340-352, (1997) »DOI
- 馬場駿吉ほか, 耳鼻と臨床, 43 (3), 353-365, (1997) »DOI
- 馬場駿吉ほか, 耳鼻と臨床, 43 (3), 366-378, (1997) »DOI
- 鈴木明子, 日本化学療法学会雑誌, 44 (S-1), 543-547, (1996)
- 我謝道弘ほか, 日本化学療法学会雑誌, 44 (S-1), 356-361, (1996)
- 青木信樹ほか, 日本化学療法学会雑誌, 44 (S-1), 295-304, (1996)
- 西野武志ほか, 日本化学療法学会雑誌, 44 (S-1), 56-69, (1996)
- 吉田卓史ほか, 日本化学療法学会雑誌, 44 (S-1), 8-18, (1996)
- 冨井由文ほか, 日本化学療法学会雑誌, 44 (S-1), 74-89, (1996)
- 吉田卓史ほか, 日本化学療法学会雑誌, 44 (S-1), 90-96, (1996)
- 菅野利恵ほか, 日本化学療法学会雑誌, 44 (S-1), 26-41, (1996)
- Tomii,Y.,et al., Arzneim.-Forsch./Drug Res., 46 ((II)12), 1169-1173, (1996)
24. 文献請求先及び問い合わせ先
文献請求先
Meiji Seikaファルマ株式会社
くすり相談室
〒104-8002
東京都中央区京橋2-4-16
電話:フリーダイヤル0120-093-396
03-3273-3539
03-3273-3539
FAX:03-3272-2438
製品情報問い合わせ先
Meiji Seikaファルマ株式会社
くすり相談室
〒104-8002
東京都中央区京橋2-4-16
電話:フリーダイヤル0120-093-396
03-3273-3539
03-3273-3539
FAX:03-3272-2438
26. 製造販売業者等
26.1 製造販売元
Meiji Seikaファルマ株式会社
東京都中央区京橋2-4-16