医薬品情報
| 総称名 | トラマール |
|---|---|
| 一般名 | トラマドール塩酸塩 |
| 欧文一般名 | Tramadol Hydrochloride |
| 製剤名 | トラマドール塩酸塩注射液 |
| 薬効分類名 | 鎮痛剤 |
| 薬効分類番号 | 1149 |
| ATCコード | N02AX02 |
| KEGG DRUG |
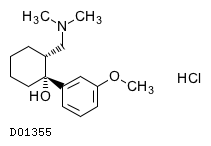
D01355
トラマドール塩酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年6月 改訂(第2版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| トラマール注100 | Tramal Injection | 日本新薬 | 1149400A1049 | 201円/管 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 重篤な呼吸抑制状態にある患者[呼吸抑制の副作用が知られており、症状を悪化させるおそれがある。][9.1.4参照]
2.2 12歳未満の小児[9.7.1参照]
2.3 扁桃摘除術後又はアデノイド切除術後の鎮痛目的で使用する18歳未満の患者[重篤な呼吸抑制のリスクが増加するおそれがある。]
2.4 頭部傷害、脳に病変がある場合などで意識混濁が危惧される患者
2.5 本剤の成分に対し過敏症の既往歴のある患者[9.1.5参照]
2.6 アルコール、睡眠剤、鎮痛剤、オピオイド鎮痛剤又は向精神薬による急性中毒患者[中枢神経抑制及び呼吸抑制を悪化させるおそれがある。]
2.7 モノアミン酸化酵素阻害剤(セレギリン塩酸塩、ラサギリンメシル酸塩、サフィナミドメシル酸塩)を投与中の患者又は投与中止後14日以内の患者[10.1参照]
2.8 ナルメフェン塩酸塩水和物を投与中の患者又は投与中止後1週間以内の患者[10.1参照]
2.9 治療により十分な管理がされていないてんかん患者[症状が悪化するおそれがある。][9.1.2参照]
4. 効能または効果
下記疾患ならびに状態における鎮痛
各種癌、術後
6. 用法及び用量
通常成人にはトラマドール塩酸塩として1回100〜150mgを筋肉内に注射し、その後必要に応じて4〜5時間毎に反復注射する。なお、症状により適宜増減する。
8. 重要な基本的注意
8.1 連用により薬物依存を生じることがあるので、観察を十分に行い、慎重に投与すること。[11.1.4参照]
8.2 本剤を投与した際に、悪心、嘔吐、便秘等の症状があらわれることがある。悪心・嘔吐に対する対策として制吐剤の併用を、便秘に対する対策として下剤の併用を考慮し、本剤投与時の副作用の発現に十分注意すること。
8.3 眠気、めまい、意識消失が起こることがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作に従事させないよう注意すること。なお、意識消失により自動車事故に至った例も報告されている。
8.4 外来患者に投与した場合には十分に安静にした後、安全を確認し帰宅させること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 18歳未満の肥満、閉塞性睡眠時無呼吸症候群又は重篤な肺疾患を有する患者
投与しないこと。重篤な呼吸抑制のリスクが増加するおそれがある。
9.1.2 てんかんのある患者、痙攣発作を起こしやすい患者又は痙攣発作の既往歴のある患者(治療により十分な管理がされていないてんかん患者を除く)
本剤投与中は観察を十分に行うこと。痙攣発作を誘発することがある。[2.9参照]
9.1.3 薬物乱用又は薬物依存傾向のある患者
厳重な医師の管理下に、短期間に限って投与すること。依存性を生じやすい。
9.1.4 呼吸抑制状態にある患者(重篤な呼吸抑制状態にある患者を除く)
呼吸抑制を増強するおそれがある。[2.1参照]
9.1.5 オピオイド鎮痛剤に対し過敏症の既往歴のある患者(本剤の成分に対し過敏症の既往歴のある患者を除く)[2.5参照]
9.1.6 ショック状態にある患者
循環不全や呼吸抑制を増強するおそれがある。
9.2 腎機能障害患者
患者の状態を考慮し、投与間隔を延長するなど慎重に投与すること。高い血中濃度が持続し、作用及び副作用が増強するおそれがある。[16.6.1参照]
9.3 肝機能障害患者
患者の状態を考慮し、投与間隔を延長するなど慎重に投与すること。高い血中濃度が持続し、作用及び副作用が増強するおそれがある。[16.6.2参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。胎盤関門を通過し、退薬症候が新生児に起こる可能性がある。なお、動物実験で、器官形成、骨化及び出生児の生存に影響を及ぼすことが報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。静脈内投与(国内未承認)の場合、0.1%が乳汁中に移行することが知られている。
9.7 小児等
9.7.1 12歳未満の小児
投与しないこと。海外において、12歳未満の小児で死亡を含む重篤な呼吸抑制のリスクが高いとの報告がある。[2.2参照]
9.7.2 12歳以上の小児
投与しないことが望ましい。12歳以上の小児を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.7.3 肥満、閉塞性睡眠時無呼吸症候群又は重篤な肺疾患を有する小児
投与しないこと。重篤な呼吸抑制のリスクが増加するおそれがある。
9.8 高齢者
少量から投与を開始するなど患者の状態を観察しながら慎重に投与すること。生理機能が低下していることが多く、代謝・排泄が遅延し副作用があらわれやすい。
10. 相互作用
相互作用序文
本剤は主として肝代謝酵素CYP2D6及びCYP3A4により代謝される。
薬物代謝酵素用語
CYP2D6
薬物代謝酵素用語
CYP3A4
10.1 併用禁忌
| モノアミン酸化酵素阻害剤 セレギリン塩酸塩 エフピー ラサギリンメシル酸塩 アジレクト サフィナミドメシル酸塩 エクフィナ [2.7参照] | 外国において、セロトニン症候群(錯乱、激越、発熱、発汗、運動失調、反射異常亢進、ミオクローヌス、下痢等)を含む中枢神経系(攻撃的行動、固縮、痙攣、昏睡、頭痛)、呼吸器系(呼吸抑制)及び心血管系(低血圧、高血圧)の重篤な副作用が報告されている。モノアミン酸化酵素阻害剤を投与中の患者又は投与中止後14日以内の患者には投与しないこと。また、本剤投与中止後にモノアミン酸化酵素阻害剤の投与を開始する場合には、2〜3日間の間隔をあけることが望ましい。 | 相加的に作用が増強され、また、中枢神経のセロトニンが蓄積すると考えられる。 |
| ナルメフェン塩酸塩水和物 セリンクロ [2.8参照] | 離脱症状を起こすおそれがある。本剤の鎮痛作用を減弱させるため、効果を得るために必要な用量が通常用量より多くなり、呼吸抑制等の中枢神経抑制症状が発現するおそれがある。ナルメフェンを投与中の患者又は投与中止後1週間以内の患者には投与しないこと。 | ナルメフェンのμオピオイド受容体拮抗作用により、本剤に対して競合的に阻害する。 |
10.2 併用注意
| オピオイド鎮痛剤 中枢神経抑制剤 フェノチアジン系薬剤、催眠鎮静剤等 | 痙攣閾値の低下や呼吸抑制の増強を来すおそれがある。 | 本剤と相加的に作用が増強されると考えられる。 |
| 三環系抗うつ剤 セロトニン作用薬 選択的セロトニン再取り込み阻害剤(SSRI)等 | セロトニン症候群(錯乱、激越、発熱、発汗、運動失調、反射異常亢進、ミオクローヌス、下痢等)があらわれるおそれがある。 また、痙攣発作の危険性を増大させるおそれがある。 | 相加的に作用が増強され、また、中枢神経のセロトニンが蓄積すると考えられる。 |
| リネゾリド | セロトニン症候群(錯乱、激越、発熱、発汗、運動失調、反射異常亢進、ミオクローヌス、下痢等)があらわれるおそれがある。 また、痙攣発作の危険性を増大させるおそれがある。 | リネゾリドの非選択的、可逆的モノアミン酸化酵素阻害作用により、相加的に作用が増強され、また、中枢神経のセロトニンが蓄積すると考えられる。 |
| メチルチオニニウム塩化物水和物(メチレンブルー) | セロトニン症候群(錯乱、激越、発熱、発汗、運動失調、反射異常亢進、ミオクローヌス、下痢等)があらわれるおそれがある。 | メチルチオニニウム塩化物水和物のモノアミン酸化酵素阻害作用によりセロトニン作用が増強される。 |
| アルコール | 呼吸抑制が生じるおそれがある。 | 本剤と相加的に作用が増強されると考えられる。 |
| カルバマゼピン | 同時あるいは前投与で本剤の鎮痛効果を下げ作用時間を短縮させる可能性がある。 | 本剤の代謝酵素が誘導されるため。 |
| キニジン | 相互に作用が増強するおそれがある。 | 機序不明 |
| ジゴキシン | 外国において、ジゴキシン中毒が発現したとの報告がある。 | 機序不明 |
| クマリン系抗凝血剤 ワルファリン | 出血を伴うプロトロンビン時間の延長、斑状出血等の抗凝血作用への影響がみられたとの報告がある。 | 機序不明 |
| オンダンセトロン塩酸塩水和物 | 本剤の鎮痛作用を減弱させるおそれがある。 | 本剤の中枢におけるセロトニン作用が抑制されると考えられる。 |
| ブプレノルフィン、ペンタゾシン等 | 本剤の鎮痛作用を減弱させるおそれがある。また、退薬症候を起こすおそれがある。 | 本剤が作用するμオピオイド受容体の部分アゴニストであるため。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック(0.2%)、アナフィラキシー(頻度不明)
呼吸困難、気管支痙攣、喘鳴、血管神経性浮腫等があらわれることがある。
11.1.2 呼吸抑制(頻度不明)
11.1.3 痙攣(頻度不明)
11.1.4 依存性(頻度不明)
長期使用時に、耐性、精神的依存及び身体的依存が生じることがある。本剤の中止又は減量時において、激越、不安、神経過敏、不眠症、運動過多、振戦、胃腸症状、パニック発作、幻覚、錯感覚、耳鳴等の退薬症候が生じることがある。[8.1参照]
11.1.5 意識消失(頻度不明)
注)発現頻度は使用成績調査を含む。
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 呼吸器 | 呼吸困難、口腔咽頭痛、咽喉乾燥、口腔咽頭不快感、発声障害 | |||
| 循環器 | 心悸亢進、冷汗、血圧低下、顔面蒼白、胸内苦悶 | 不整脈 | 血圧上昇、ほてり、起立性低血圧、頻脈、徐脈、高血圧 | |
| 血液凝固系 | 好中球増加、好酸球増加・減少、リンパ球減少、ヘマトクリット減少、ヘモグロビン減少、赤血球減少、白血球増加、血小板減少 | |||
| 精神神経系 | 傾眠、睡眠障害、頭痛、頭重感、興奮、虚脱感、鎮静、疲労感、浮動性めまい、ふらつき感、不快感 | 耳鳴、不安感、両手のしびれ感 | 譫妄、幻覚、振戦、体位性めまい、いらいら感、錯感覚、不随意性筋収縮、協調運動異常、失神、錯乱、悪夢、気分変動、活動低下・亢進、行動障害、知覚障害、言語障害、不眠症、感覚鈍麻、味覚異常、記憶障害、健忘、ジスキネジー、眼振、回転性めまい、うつ病、落ち着きのなさ、無感情、不快気分 | |
| 消化器 | 悪心 | 嘔吐 | 腹部膨満感、腹鳴 | 食欲不振、便秘、下痢、胃不快感、上腹部痛、口内乾燥、食欲減退、口内炎、消化不良、腹痛、胃炎、口唇炎、胃食道逆流性疾患、口の錯感覚、おくび、イレウス |
| 肝臓 | AST増加、ALT増加、Al-P増加、LDH増加、肝機能異常、ビリルビン増加 | |||
| 皮膚 | 多汗症 | 蕁麻疹 | そう痒症、発疹、湿疹、全身性そう痒症、薬疹、寝汗 | |
| 腎臓及び尿路系 | 排尿困難 | 尿糖陽性、尿蛋白陽性、尿潜血陽性、クレアチニン増加、BUN増加、尿閉、頻尿、夜間頻尿、尿量減少、膀胱炎 | ||
| 代謝異常 | 尿酸増加、トリグリセリド増加 | |||
| その他 | 口渇、注射部位の刺激、熱感、悪寒 | 発熱、冷感 | 浮遊感、倦怠感、無力症、CK増加、霧視、散瞳、脱水、視力障害、背部痛、関節痛、四肢痛、筋骨格硬直、浮腫、末梢性浮腫、疼痛、胸部不快感、転倒、視調節障害、心電図QT延長、体重減少 |
13. 過量投与
13.1 症状
中毒による典型的な症状として、縮瞳、嘔吐、心血管虚脱、昏睡に至る意識障害、痙攣、呼吸停止に至る呼吸抑制等が報告されている。
13.2 処置
緊急処置として、気道を確保し、症状に応じた呼吸管理と循環の管理を行うこと。呼吸抑制に対してはナロキソンの投与、痙攣に対してはジアゼパムの静脈内投与を行うこと(ナロキソンは動物実験で痙攣を増悪させるとの報告がある)。本剤は透析によってはほとんど除去されず、急性中毒に対して、解毒のための血液透析、あるいは血液濾過のみの治療は不適切である。
14. 適用上の注意
14.1 アンプルカット時の注意
本剤には「一点カットアンプル」を採用しているが、異物の混入を避けるため、カット部をエタノール綿等で清拭してからカットすることが望ましい。
14.2 薬剤調製時の注意
バルビタール系薬剤(注射液)と同じ注射筒を使用すると沈殿を生じるので、同じ注射筒で混ぜないこと。
14.3 薬剤投与時の注意
14.3.1 神経走行部位を避けるよう注意して注射すること。
14.3.2 繰り返し注射する場合には、例えば左右交互に注射するなど、注射部位を変えて行うこと。
14.3.3 注射針を刺入したとき、激痛を訴えたり血液の逆流をみた場合は直ちに針を抜き、部位を変えて注射すること。
15. その他の注意
15.1 臨床使用に基づく情報
遺伝的にCYP2D6の活性が過剰であることが判明している患者(Ultra-rapid Metabolizer)では、トラマドールの活性代謝物の血中濃度が上昇し、呼吸抑制等の副作用が発現しやすくなるおそれがある。
15.2 非臨床試験に基づく情報
動物実験で耐性が形成されるので連用や増量の場合は注意して投与すること。
16. 薬物動態
16.3 分布
モルモットに筋肉内投与したときの各組織内濃度は投与1時間後最高を示し、以後3時間まで急激に減少した。組織内濃度は肺が最も高く、肝、腎、脾、血液、腸、胃、心、筋と続いた1)。
16.5 排泄
モルモットに筋肉内投与したとき、投与後6時間までに約29%、24時間までに31%が尿中排泄された。尿中代謝物は、トラマドール及びO-脱メチル体、N-脱メチル体が主なものであった1)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床試験
18. 薬効薬理
18.1 作用機序
18.1.1 トラマドール塩酸塩及び活性代謝物M1は、μオピオイド受容体の作動作用に加え、ノルアドレナリン及びセロトニンの再取り込み阻害作用を併せ持つことで、侵害受容性疼痛及び神経障害性疼痛を抑制すると考えられる。
18.2 鎮痛作用
19. 有効成分に関する理化学的知見
19.1. トラマドール塩酸塩
22. 包装
10管
23. 主要文献
24. 文献請求先及び問い合わせ先
文献請求先
日本新薬株式会社
製品情報担当
〒601-8550
京都市南区吉祥院西ノ庄門口町14
電話:フリーダイヤル 0120-321-372
075-321-9064
075-321-9064
FAX:075-321-9061
製品情報問い合わせ先
日本新薬株式会社
製品情報担当
〒601-8550
京都市南区吉祥院西ノ庄門口町14
電話:フリーダイヤル 0120-321-372
075-321-9064
075-321-9064
FAX:075-321-9061
26. 製造販売業者等
26.1 製造販売元
日本新薬株式会社
京都市南区吉祥院西ノ庄門口町14
26.2 提携
GRUNENTHAL GMBH
GERMANY