医薬品情報
| 総称名 | スペリア |
|---|---|
| 一般名 | フドステイン |
| 欧文一般名 | Fudosteine |
| 製剤名 | フドステイン内用液 |
| 薬効分類名 | 気道分泌細胞正常化剤 |
| 薬効分類番号 | 2233 |
| KEGG DRUG |
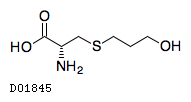
D01845
フドステイン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年12月 改訂(第1版)

|
4.効能または効果 6.用法及び用量 9.特定の背景を有する患者に関する注意 11.副作用 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| スペリア内用液8% | SPELEAR Solution 8% | 久光製薬 | 2233004S1031 | 8.2円/mL |
4. 効能または効果
6. 用法及び用量
通常、成人には1回5mL(フドステインとして400mg)を1日3回食後経口投与する。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 心障害のある患者
類薬で心不全のある患者に悪影響を及ぼしたとの報告がある。
9.3 肝機能障害患者
肝機能が悪化するおそれがある。[11.1.1参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。ウサギを用いた胎児の器官形成期経口投与試験の600mg/kg(臨床用量の約30倍)で流産、ラットを用いた周産期及び授乳期経口投与試験の2000mg/kg(臨床用量の約100倍)で出生児の発育抑制がみられている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中への移行が認められている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
減量するなど注意すること。一般に生理機能が低下している。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 肝機能障害、黄疸(いずれも頻度不明)
AST、ALT、Al-P、LDHの上昇等を伴う肝機能障害や黄疸があらわれることがある。[9.3参照]
11.1.2 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(いずれも頻度不明)
注)発現頻度は使用成績調査を含む。
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 消化器 | 食欲不振、悪心・嘔吐、胃部不快感、胸やけ、下痢 | 腹痛、胃痛、腹部膨満感、口渇、便秘、舌炎 | 口内炎、口唇炎 |
| 肝臓 | AST、ALT、Al-Pの上昇 | ||
| 腎臓 | BUN上昇、蛋白尿 | ||
| 過敏症 | 発疹、かゆみ | 紅斑、じん麻疹 | |
| 呼吸器 | 咳嗽、呼吸困難感 | ||
| 精神神経系 | 頭痛 | ふらつき、しびれ感、めまい、眠気 | |
| 感覚器 | 耳鳴、味覚異常 | ||
| その他 | 熱感、顔面潮紅、脱力感、胸部圧迫感、頻尿、浮腫 | 動悸 |
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男子に本剤5mL(フドステインとして400mg)を絶食時(投与12時間前より絶食)に単回経口投与した時の血漿中未変化体濃度は、投与後0.57時間で最高値12.60μg/mLに達し、2.9時間の半減期で消失した。
| Cmax(μg/mL) | Tmax(h) | t1/2z(h) | AUC0-∞(μg・h/mL) | |
| 絶食時投与(n=22) | 12.60±4.14 | 0.57±0.31 | 2.9±0.7 | 27.63±4.72 |
16.2 吸収
16.2.1 食事の影響
健康成人男子にフドステインの錠剤(フドステインとして400mg)を食後及び絶食時(投与12時間前より絶食)単回経口投与した時の血漿中未変化体濃度は、食後投与では投与後1.17時間で最高値5.69μg/mLに達し、2.7時間の半減期で消失した。絶食時投与では投与後0.42時間で最高値10.19μg/mLに達し、2.6時間の半減期で消失し、食後投与及び絶食時投与との間で薬物動態パラメータに食事の影響が認められた。
| Cmax(μg/mL) | Tmax(h) | t1/2z(h) | AUC0-∞(μg・h/mL) | |
| 食後投与(n=9) | 5.69±2.14 | 1.17±0.43 | 2.7±0.3 | 20.49±4.24 |
| 絶食時投与(n=9) | 10.19±3.34** | 0.42±0.13** | 2.6±0.6 | 23.41±6.03* |
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床試験
17.1.2 国内第III相臨床試験(プラセボとの二重盲検比較試験)
病態が比較的安定しており、喀痰喀出困難を表明する慢性呼吸器疾患患者(慢性気管支炎、気管支拡張症、肺気腫、非活動性肺結核、塵肺症)153例に対してフドステイン200mgを含有する白色のフィルムコーティング錠、あるいはプラセボ錠を1回2錠、1日3回、2週間反復投与し、有効性、安全性及び有用性を検討した。
最終全般改善度:「中等度改善」以上の改善率はフドステイン群64.6%、プラセボ群23.7%で、Wilcoxonの順位和検定よりフドステイン群はプラセボ群に比して有意な改善を示した。
| 著明改善 | 中等度改善 | 軽度改善 | 不変 | 悪化 | 計 | 中等度改善以上 | Wilcoxonの順位和検定 | |
| フドステイン群 | 13(20.0) | 29(44.6) | 6(9.2) | 17(26.2) | 0 | 65 | 42(64.6) | ** |
| プラセボ群 | 2(3.4) | 12(20.3) | 7(11.9) | 33(55.9) | 5(8.5) | 59 | 14(23.7) |
副作用発現頻度は、フドステイン群6.3%(5/79例)、プラセボ群2.7%(2/74例)であった。フドステイン群で認められた副作用は、食欲不振2.5%(2/79例)、かゆみ、手足のしびれ、偏頭痛、下痢各1.3%(1/79例)であった2)。
18. 薬効薬理
18.1 作用機序
気道上皮杯細胞過形成抑制作用、漿液性気道分泌促進作用、抗炎症作用などを有し、粘液過分泌を抑制すると考えられている7)。
18.2 痰(気道粘液)の主成分であるムチンを分泌する杯細胞の過形成抑制作用
18.2.1 イソプロテレノール誘発試験
気道上皮におけるラットの予防効果モデルとして、杯細胞過形成誘発物質であるイソプロテレノールの投与前にフドステインを反復経口投与した場合、10、30及び100mg/kgで杯細胞の過形成抑制作用がみられた。更に、ラットの治療効果モデルとして、イソプロテレノール投与により気道上皮の杯細胞を過形成させた後、フドステインを反復経口投与した場合、10、30及び100mg/kgで過形成抑制作用がみられた8)。
18.2.2 リポポリサッカライド誘発試験
18.3 粘液修復作用
気管支炎ウサギの痰中フコース/シアル酸比に対して、フドステインの20、100及び500mg/kgの反復経口投与は用量依存的な抑制作用を示し、500mg/kgでは有意な抑制を示した。
18.4 漿液性気道分泌亢進作用
フドステインは500mg/kg経口投与で、ウサギ漿液性気道分泌を有意に増大した。更に、フドステインは500mg/kg経口投与で、気管支肺胞洗浄液中のCl-濃度を有意に増大した。
18.5 気道炎症抑制作用
フドステインの10、30及び100mg/kgを、リポポリサッカライド誘発ラットに反復経口投与した時、30及び100mg/kgで気管支肺胞洗浄液中の好中球数の増加を有意に抑制し、10〜100mg/kgでcytokine-induced neutrophil chemoattractant-1(CINC-1)量を有意に抑制した。
19. 有効成分に関する理化学的知見
19.1. フドステイン
20. 取扱い上の注意
開封後は必ず密栓して保管し、なるべく速やかに使用すること。
22. 包装
500mL(瓶)
23. 主要文献
- 長岡滋 ほか, 臨床医薬, 18 (1), 81-107, (2002)
- 長岡滋 ほか, 臨床医薬, 18 (1), 109-40, (2002)
- 長岡滋 ほか, 臨床医薬, 18 (1), 141-80, (2002)
- 長岡滋 ほか, 臨床医薬, 18 (1), 181-208, (2002)
- 長岡滋 ほか, 臨床医薬, 18 (1), 209-32, (2002)
- 長岡滋 ほか, 臨床医薬, 18 (1), 233-43, (2002)
- 第十八改正日本薬局方解説書, C-4724-7, (2021), (廣川書店)
- Takahashi K, et al., Jpn J Pharmacol, 77 (1), 71-7, (1998) »PubMed
- Takahashi K, et al., Environ Toxicol Pharmacol, 5 (3), 173-8, (1998) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
久光製薬株式会社
お客様相談室 受付時間/9:00-17:50(土日・祝日・会社休日を除く)
〒135-6008
東京都江東区豊洲三丁目3番3号
電話:0120-381332
FAX:03-5293-1723
製品情報問い合わせ先
久光製薬株式会社
お客様相談室 受付時間/9:00-17:50(土日・祝日・会社休日を除く)
〒135-6008
東京都江東区豊洲三丁目3番3号
電話:0120-381332
FAX:03-5293-1723
26. 製造販売業者等
26.1 製造販売元
久光製薬株式会社
〒841-0017
鳥栖市田代大官町408番地