医薬品情報
| 総称名 | ミケラン |
|---|---|
| 一般名 | カルテオロール塩酸塩 |
| 欧文一般名 | Carteolol Hydrochloride |
| 製剤名 | カルテオロール塩酸塩徐放性カプセル |
| 薬効分類名 | 徐放性 高血圧治療剤 |
| 薬効分類番号 | 2149 |
| ATCコード | C07AA15 |
| KEGG DRUG |
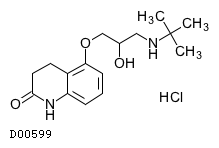
D00599
カルテオロール塩酸塩
|
| KEGG DGROUP |
DG03231
血圧降下薬
DG01653
抗不整脈薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年5月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ミケランLAカプセル15mg | Mikelan LA capsules 15mg | 大塚製薬 | 2149025N1034 | 43.2円/カプセル | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 気管支喘息、気管支痙攣のおそれのある患者[気管支筋収縮作用により、喘息症状の誘発、悪化を起こすおそれがある。]
2.3 糖尿病性ケトアシドーシス、代謝性アシドーシスのある患者[アシドーシスによる心筋収縮力の抑制を増強するおそれがある。]
2.4 高度の徐脈(著しい洞性徐脈)、房室ブロック(II、III度)、洞不全症候群、洞房ブロックのある患者[刺激伝導系に対し抑制的に作用し、症状を悪化させるおそれがある。]
2.5 心原性ショックの患者[心拍出量抑制作用により、症状が悪化するおそれがある。]
2.6 肺高血圧による右心不全のある患者[心拍出量抑制作用により、症状が悪化するおそれがある。]
2.7 うっ血性心不全のある患者[心収縮力抑制作用により、症状が悪化するおそれがある。]
2.8 低血圧症の患者[降圧作用により症状を悪化させるおそれがある。]
2.9 未治療の褐色細胞腫又はパラガングリオーマの患者[7.、9.1.7参照]
2.10 妊婦又は妊娠している可能性のある女性[9.5参照]
4. 効能または効果
本態性高血圧症(軽症〜中等症)
6. 用法及び用量
通常、成人には1日1回1カプセル(カルテオロール塩酸塩として15mg)を朝食後に経口投与する。なお、効果が不十分な場合には1日1回2カプセル(カルテオロール塩酸塩として30mg)まで増量することができる。
7. 用法及び用量に関連する注意
8. 重要な基本的注意
8.1 投与が長期にわたる場合は、心機能検査(脈拍、血圧、心電図、X線等)を定期的に行うこと。特に徐脈になったとき及び低血圧を起こした場合には減量又は中止すること。また、必要に応じアトロピン硫酸塩水和物を使用すること。なお、肝機能、腎機能、血液像等に注意すること。
8.2 β遮断剤を急に中止したとき、症状が悪化した症例が報告されているので、休薬を要する場合は徐々に減量し、観察を十分に行うこと。また、患者に医師の指示なしに服薬を中止しないよう注意すること。特に高齢者においては注意すること。[9.8参照]
8.3 手術前24時間は投与しないことが望ましい。
8.4 めまい・ふらつきがあらわれることがあるので、本剤投与中の患者(特に投与初期)には、自動車の運転等危険を伴う機械の操作に従事させないように注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 うっ血性心不全のおそれのある患者
観察を十分に行い、ジギタリス剤を併用するなど慎重に投与すること。心収縮力抑制作用により、症状を悪化させるおそれがある。
9.1.2 特発性低血糖症、コントロール不十分な糖尿病、長期間絶食状態の患者
血糖値に注意すること。低血糖症状を起こしやすく、かつ症状をマスクしやすい。
9.1.3 徐脈、房室ブロック(I度)のある患者
心刺激伝導系を抑制し、症状を悪化させるおそれがある。
9.1.4 末梢循環障害のある患者(レイノー症候群、間欠性跛行症等)
末梢血管収縮作用により、症状が悪化するおそれがある。
9.1.5 甲状腺中毒症の患者
休薬を要する場合には徐々に減量し、観察を十分に行うこと。急に投与を中止すると、症状を悪化させることがある。また、頻脈等の中毒症状をマスクすることがある。
9.1.6 異型狭心症の患者
類薬で症状を悪化させたとの報告がある。
9.1.7 褐色細胞腫又はパラガングリオーマの患者
本剤の単独投与により急激に血圧が上昇することがある。[2.9、7.参照]
9.2 腎機能障害患者
9.2.1 重篤な腎機能障害のある患者
薬物動態の影響等で副作用が出現するおそれがある。
9.3 肝機能障害患者
9.3.1 重篤な肝機能障害のある患者
薬物代謝の遅延等で副作用が出現するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。[2.10参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中への移行が報告されている。
9.7 小児等
9.7.1 小児等を対象とした臨床試験は実施していない。
9.7.2 低血糖症状があらわれた場合には、経口摂取可能な状態では角砂糖、あめ等の糖分の摂取、意識障害、痙攣を伴う場合には、ブドウ糖の静注等を行い、十分に経過観察すること。小児用カルテオロール塩酸塩製剤で、低血糖による意識障害、痙攣が報告されている。
9.8 高齢者
以下の点に注意し、少量から投与を開始するなど患者の状態を観察しながら慎重に投与すること。
・一般に過度の降圧は好ましくないとされている(脳梗塞等が起こるおそれがある)。
・休薬を要する場合は、徐々に減量すること。[8.2参照]
10. 相互作用
10.2 併用注意
| 交感神経系に対し抑制的に作用する他の薬剤 レセルピン等 | 過剰の交感神経抑制を来すことがあるので、減量するなど慎重に投与すること。 | 相加的に交感神経抑制作用を増強させる。 |
| 血糖降下剤 インスリン トルブタミド アセトヘキサミド等 | 血糖降下作用が増強することがある。また、低血糖症状(頻脈、発汗等)をマスクすることがあるので、血糖値に注意すること。 | 低血糖に伴う交感神経系の症状をマスクしたり、β遮断作用により低血糖の回復を遅れさせる。 |
| カルシウム拮抗剤 ベラパミル塩酸塩 ジルチアゼム塩酸塩 | 徐脈、房室ブロック等の伝導障害、うっ血性心不全があらわれることがある。併用する場合には用量に注意すること。 | 相互に作用が増強される。 |
| クロニジン塩酸塩 グアナベンズ酢酸塩 | クロニジン塩酸塩、グアナベンズ酢酸塩投与中止後のリバウンド現象を増強するおそれがある。β遮断剤を先に中止し、クロニジン塩酸塩、グアナベンズ酢酸塩を徐々に減量すること。 | クロニジン塩酸塩はα2受容体に選択的に作用し、ノルアドレナリンの遊離を抑制しているため、急激な中止によって血中カテコラミンの上昇が起こる。この時、β受容体遮断薬を併用すると上昇したカテコラミンの作用のうち、β受容体刺激作用が遮断され、α受容体刺激作用だけが残り、急激な血圧上昇が起こるおそれがある。グアナベンズ酢酸塩も作用機序から同様な反応が予想される。 |
| クラスI抗不整脈剤 リン酸ジソピラミド プロカインアミド塩酸塩等 | 過度の心機能抑制があらわれるおそれがあるので、減量するなど注意すること。 | 相加的に心機能抑制作用を増強させる。 |
| ジギタリス製剤 | 徐脈、房室ブロック等の伝導障害があらわれるおそれがあるので、心機能に注意すること。 | 相加的に心刺激伝導抑制作用を増強させる。 |
| 非ステロイド性抗炎症剤 インドメタシン等 | 本剤の降圧作用が減弱するおそれがある。 | 非ステロイド性抗炎症剤は、血管拡張作用を有するプロスタグランジンの合成・遊離を阻害する。 |
| 降圧作用を有する他の薬剤 降圧剤 硝酸剤等 | 降圧作用が増強するおそれがある。 併用する場合には、用量に注意すること。 | 降圧作用を増強させる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 房室ブロック、洞不全症候群、洞房ブロック、洞停止等の徐脈性不整脈、うっ血性心不全(又はその悪化)、冠攣縮性狭心症(いずれも頻度不明)
定期的に心機能検査を行い、必要に応じ、減量又は中止するなど適切な処置を行うこと。
11.1.2 失神(頻度不明)
高度な徐脈に伴う失神があらわれることがある。
11.2 その他の副作用
| 0.1〜5%未満 | 頻度不明 | |
| 循環器 | めまい・ふらつき・立ちくらみ、動悸、息切れ、胸痛 | 低血圧、徐脈 |
| 精神神経系 | 頭痛・頭重感、眠気、不眠、耳鳴、抑うつ感 | 振戦、不安感、悪夢、耳の蟻走感 |
| 消化器 | 嘔気、腹部膨満感、胸やけ、心窩部痛 | 鼓腸、腹部不快感、下痢、食欲不振、腹痛、便秘、口内炎 |
| 呼吸器 | 上気道閉塞感、呼吸困難、咳・痰、喘息様症状 | |
| 眼 | 目がしょぼつく、霧視、涙液分泌減少 | |
| 過敏症 | 皮疹 | 皮膚そう痒感 |
| 肝臓 | AST、ALT、LDHの上昇 | |
| その他 | 倦怠感、浮腫、手足のしびれ、下肢冷感、発汗、冷汗、鼻出血、腓腸筋痙攣(こむらがえり) | 血糖値の低下、頻尿、筋肉痛、血清CK値の上昇、脱力感、ほてり、疲労感、総コレステロール値の上昇、中性脂肪値の上昇、血糖値の上昇 |
13. 過量投与
13.1 症状
過量投与により、徐脈、完全房室ブロック、心不全、低血圧、気管支痙攣等があらわれることがある。
13.2 処置
以下の処置の間は常に観察下におくこと。
・徐脈、完全房室ブロック:アトロピン硫酸塩水和物、イソプレナリン等の投与や心臓ペーシングを適用すること。
・心不全、低血圧:強心剤、昇圧剤、輸液等の投与や補助循環を適用すること。
・気管支痙攣:β2刺激剤又はアミノフィリン水和物を静注等の投与や補助呼吸を適用すること。
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.1.2 本剤は徐放性の製剤であるため、かまずに服用するように指導すること。
15. その他の注意
15.1 臨床使用に基づく情報
β遮断剤服用中の患者では、他の薬剤によるアナフィラキシー反応がより重篤になることがあり、また、通常用量のアドレナリンによる治療に抵抗するとの報告がある。
16. 薬物動態
16.1 血中濃度
健康成人男性に本剤を1回1カプセル(カルテオロール塩酸塩として15mg)1日1回(朝食後)、ミケラン錠5mgを1回1錠1日3回(毎食後)9日間クロス・オーバー法にて反復経口投与し、血漿中カルテオロール濃度を測定した。本剤は投与開始3日目には定常状態に達し、最低〜最高血漿中濃度範囲は10〜50ng/mLで血漿中半減期は7〜10時間であった。定常状態の本剤とミケラン錠5mgの血漿中濃度の推移を図にした1)。
図 健康成人男性6名にミケランLAカプセル15mgを1回1カプセル、1日1回(朝食後)又はミケラン錠5mgを1回1錠、1日3回(毎食後)をそれぞれ9日間経口投与した際の最終投与日の血漿中カルテオロール濃度推移
16.2 吸収
正常胃液酸度又は低胃液酸度の健康成人男性に本剤を空腹時及び食後1回経口投与し、薬物速度論的パラメータを検討したところ、本剤は胃液酸度及び食事の影響を受けにくいことが確認された2)。
16.3 分布
ヒト血漿蛋白結合率は約15%であった3)(in vitro、平衡透析法)。
16.4 代謝
16.5 排泄
健康成人男性に本剤を1カプセル経口投与した時、その50〜70%が未変化体として尿中に排泄された。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
本態性高血圧症患者252例を対象とした二重盲検比較試験において、本剤を1回1〜2カプセル、1日1回投与における有効率は、「下降」以上65.3%(81/124例)であり、対照薬のミケラン錠5mgを1回1〜2錠、1日3回投与の有効率より高く、本剤の1日1回投与の有用性が認められている7)。
副作用発現頻度は、本剤で124例中10例(8.1%)、ミケラン錠で123例中12例(9.8%)であった。主な副作用は、本剤では頭痛2例(1.6%)及び倦怠感2例(1.6%)、ミケラン錠でめまい2例(1.6%)及び倦怠感2例(1.6%)であった。
副作用発現頻度は、本剤で124例中10例(8.1%)、ミケラン錠で123例中12例(9.8%)であった。主な副作用は、本剤では頭痛2例(1.6%)及び倦怠感2例(1.6%)、ミケラン錠でめまい2例(1.6%)及び倦怠感2例(1.6%)であった。
17.1.2 国内一般臨床試験
17.1.3 国内長期投与試験
18. 薬効薬理
18.1 作用機序
18.2 アドレナリン性β受容体遮断作用
健康成人男性に本剤を1カプセル経口投与した時、運動負荷時のダブルプロダクト(収縮期血圧×脈拍数)は投与直後より減少が認められ、その抑制作用は投与後24時間まで持続した15)。
18.3 内因性交感神経刺激様作用(ISA)
18.4 降圧作用
18.4.1 本態性高血圧症患者において、カルテオロール塩酸塩の降圧効果は早期に発現し、緩徐で持続的な降圧パターンを示した19)。
18.4.2 カルテオロール塩酸塩は自然発症高血圧ラット(SHR)の心肥大・血管肥厚を抑制した20)。
18.5 血圧日内変動に及ぼす影響
本態性高血圧症患者において、本剤を1日1回1〜2カプセル経口投与した時、降圧効果は投与後24時間まで持続して認められ、血圧の変動幅及び最大日内較差に影響しないことが認められた21)。
19. 有効成分に関する理化学的知見
19.1. カルテオロール塩酸塩
22. 包装
PTP:100カプセル(10カプセル×10)
23. 主要文献
- 小富正昭 ほか, 臨床薬理, 20 (2), 435-440, (1989) »DOI
- 小富正昭 ほか, 社内資料(胃液酸度、食事の影響), (1989)
- 社内資料:ヒト血漿蛋白結合試験
- Kudo,S.et al., Eur J Clin Pharmacol., 52 (6), 479-485, (1997) »PubMed
- 内多 稔 ほか, 薬学雑誌, 96 (5), 571-577, (1976) »DOI
- 石原高文 ほか, 社内資料(代謝産物の一般薬理作用), (1976)
- 尾前照雄 ほか, 医学のあゆみ, 149 (3), 169-191, (1989)
- 尾前照雄 ほか, 新薬と臨床, 38 (2), 176-193, (1989)
- 半田俊之介 ほか, 新薬と臨床, 38 (2), 216-235, (1989)
- 稲垣義明 ほか, 診療と新薬, 26 (2), 195-210, (1989)
- 尾前照雄 ほか, 新薬と臨床, 38 (2), 195-214, (1989)
- Hashimoto,K.et al., Jpn J Pharmacol., 26 (4), 504-506, (1976) »PubMed
- Yabuuchi,Y.et al., Jpn J Pharmacol., 24 (6), 853-861, (1974) »DOI
- 岳中典男 ほか, 日薬理誌, 71 (2), 221-230, (1975) »PubMed
- 小富正昭 ほか, 臨床薬理, 20 (2), 427-434, (1989) »DOI
- Taira,N.et al., Jpn J Pharmacol., 28 (3), 473-483, (1978) »PubMed
- 近藤照夫 ほか, 臨床と研究, 58 (4), 1313-1318, (1981)
- 佐藤 光 ほか, 臨床成人病, 6 (5), 815-824, (1976)
- 池田正男 ほか, 臨床成人病, 8 (11), 1793-1806, (1978)
- Igawa,T.et al., Eur J Pharmacol., 104 (1-2), 93-99, (1984) »PubMed
- 尾前照雄 ほか, 基礎と臨床, 23 (3), 1013-1021, (1989)
24. 文献請求先及び問い合わせ先
文献請求先
大塚製薬株式会社
医薬情報センター
〒108-8242
東京都港区港南2-16-4 品川グランドセントラルタワー
電話:0120-189-840
FAX:03-6717-1414
製品情報問い合わせ先
大塚製薬株式会社
医薬情報センター
〒108-8242
東京都港区港南2-16-4 品川グランドセントラルタワー
電話:0120-189-840
FAX:03-6717-1414
26. 製造販売業者等
26.1 製造販売元
大塚製薬株式会社
東京都千代田区神田司町2-9