医薬品情報
| 総称名 | パピロック |
|---|---|
| 一般名 | シクロスポリン |
| 欧文一般名 | Ciclosporin |
| 製剤名 | シクロスポリン点眼液 |
| 薬効分類名 | 春季カタル治療剤 |
| 薬効分類番号 | 1319 |
| ATCコード | S01XA18 |
| KEGG DRUG |
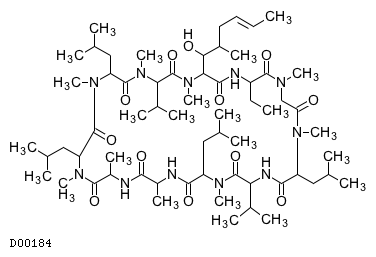
D00184
シクロスポリン
|
| KEGG DGROUP |
DG03129
カルシニュリン阻害薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年10月 改訂(第1版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| パピロックミニ点眼液0.1% | PAPILOCK Mini ophthalmic solution | 参天製薬 | 1319750Q1025 | 145.1円/個 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 眼感染症のある患者[8.2参照]
4. 効能または効果
春季カタル(抗アレルギー剤が効果不十分な場合)
5. 効能または効果に関連する注意
眼瞼結膜巨大乳頭の増殖が認められ抗アレルギー剤により十分な効果が得られないと判断した場合に使用すること。
6. 用法及び用量
通常、1回1滴、1日3回点眼する。
8. 重要な基本的注意
8.1 本剤の使用は、春季カタルの治療法に精通している医師のもとで行うこと。
8.2 本剤投与により感染症が発現又は増悪するおそれがあり、他の免疫抑制作用を有する薬剤との併用時には、その可能性がさらに高まるおそれがあるので十分注意すること。[2.2参照]
9. 特定の背景を有する患者に関する注意
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ヒト(経口投与)で母乳中へ移行するとの報告がある5)。
9.7 小児等
9.7.1 低出生体重児、新生児、乳児、幼児を対象とした臨床試験は実施していない。
9.7.2 経口投与において一般に小児での多毛の発現率(10〜18%)は成人(2〜6%)に比べ高い傾向がある。
9.8 高齢者
一般に生理機能が低下している。
11. 副作用
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | |
| 眼 | 眼刺激、角膜びらん・角膜潰瘍(角膜上皮欠損、角膜病変、角膜障害、角膜炎、点状角膜炎、潰瘍性角膜炎等) | 眼のそう痒感、眼乾燥感、角膜浮腫、前房のフレア、前房内細胞、流涙、眼瞼炎、眼痛、結膜充血 |
| 感染症 | ヘルペス性角膜炎、麦粒腫、細菌性結膜炎、細菌性角膜潰瘍 | |
| その他 | ALT上昇、LDH上昇、BUN上昇、CK上昇、尿ケトン体陽性、Mg上昇 |
14. 適用上の注意
14.1 薬剤交付時の注意
患者に対し以下の点に注意するよう指導すること。
・液が白濁した場合は使用しないこと。[20.参照]
・開封時の容器破片除去のため、使用の際は、最初の1〜2滴は点眼せずに捨てること。
・点眼のとき、容器の先端が直接目に触れないように注意すること。
・患眼を開瞼して結膜嚢内に点眼し、1〜5分間閉瞼して涙嚢部を圧迫させた後、開瞼すること。
・点眼したときに液が眼瞼皮膚等についた場合には、すぐにふき取ること。
・他の点眼剤を併用する場合には、少なくとも5分以上間隔をあけてから点眼すること。
・保存剤を含有しないため、開封後は1回きりの使用とし、残液は廃棄すること。
・遮光して保存すること。
16. 薬物動態
16.1 血中濃度
健康成人の片眼(各6例)に、本剤あるいは0.5%シクロスポリン点眼液注)を1回1滴、1日3回点眼したとき、最終点眼1、18時間後の血中シクロスポリン濃度はいずれも定量下限(25ng/mL)未満であった。
また、別の健康成人(6例)に0.5%シクロスポリン点眼液注)を1回1滴、1日3回、7日間片眼に連続点眼したとき、3、5日目の最終点眼1時間後、及び7日目の最終点眼1、18時間後の血中濃度も同様に定量下限(25ng/mL)未満であった6)。
また、別の健康成人(6例)に0.5%シクロスポリン点眼液注)を1回1滴、1日3回、7日間片眼に連続点眼したとき、3、5日目の最終点眼1時間後、及び7日目の最終点眼1、18時間後の血中濃度も同様に定量下限(25ng/mL)未満であった6)。
注)本剤の承認されている濃度は0.1%である。
16.3 分布
白色ウサギに0.05%3H-シクロスポリン点眼液を単回点眼すると角膜、結膜等の外眼部組織に高度に分布し、房水、虹彩・毛様体、水晶体、硝子体等の内眼部組織への移行はわずかであった。
白色ウサギに0.05%3H-シクロスポリン点眼液を1日3回、7日間反復点眼すると10回までの点眼で眼組織中濃度はほぼ定常状態に達した6)。
16.4 代謝
本剤は主として代謝酵素チトクロームP450 3A(CYP3A)系で代謝される7)。従って、本酵素で代謝される他の薬物との併用により本剤の血中濃度が上昇する可能性がある。
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II/III相試験
抗アレルギー点眼液が効果不十分な春季カタル患者(7〜39歳)54例(有効性解析対象38例)を対象とした無作為化二重盲検比較試験において、抗アレルギー点眼液併用条件下で本剤又はプラセボ点眼液を1日3回、8週間点眼した結果、本剤群は対照薬と比較して眼瞼結膜乳頭所見スコアの有意な改善が認められた。
副作用は、本剤群27例中6例(22.2%)に認められ、副作用は眼刺激14.8%(4/27例)及び眼そう痒症7.4%(2/27例)であった9)。
副作用は、本剤群27例中6例(22.2%)に認められ、副作用は眼刺激14.8%(4/27例)及び眼そう痒症7.4%(2/27例)であった9)。
図 眼瞼結膜乳頭所見スコアの平均変化量の推移
18. 薬効薬理
18.1 作用機序
シクロスポリンは、T細胞内でシクロフィリンと結合し、カルシニューリン複合体によるNFAT(転写因子)の脱リン酸化を阻害することにより、IL-2等のサイトカインの産生を抑制する。
18.2 サイトカイン産生抑制作用
シクロスポリンはヒト末梢血由来単核球からのサイトカイン(IL-2、IL-4、IL-5、IFN-γ)産生を抑制した(IC50値:0.021〜0.173μM)(in vitro)6)。
18.3 実験的アレルギー性結膜炎モデルに対する作用
19. 有効成分に関する理化学的知見
19.1. シクロスポリン
20. 取扱い上の注意
・アルミピロー包装開封後は、添付の遮光用投薬袋に入れて室温で保存し、6ヵ月以内に使用すること。2〜8℃に保存した場合には、1年以内に使用すること。
・液が白濁した場合は使用しないこと。[14.1参照]
22. 包装
プラスチック点眼容器
0.4mL×90本(アルミピロー1袋30本入り×3袋、脱酸素剤入り)
23. 主要文献
- Baxi,LV.et al., Am.J.Obstet.Gynecol., 169, 33-34, (1993) »PubMed
- Burrows,DA.et al., Obstet.Gynecol., 72, 459-461, (1988) »PubMed
- Lowenstein,BR.et al., Am.J.Obstet.Gynecol., 158, 589-590, (1988) »PubMed
- Flechner,SM.et al., Am.J.Kidney Dis., 5, 60-63, (1985) »PubMed
- 井田孔明他, 周産期医学, 22, 865-868, (1992)
- 椎 大介他, 眼薬理, 20, 12-17, (2006)
- Christians,U.and Sewing,KF., Pharmacol.Ther., 57, 291-345, (1993) »PubMed
- 社内資料:ラットにおける単回点眼時の尿糞中排泄(2005年10月11日承認、CTD2.6.4.6)
- 大橋裕一他, あたらしい眼科, 24, 1537-1546, (2007)
- 椎 大介他, あたらしい眼科, 23, 925-928, (2006)
24. 文献請求先及び問い合わせ先
文献請求先
参天製薬株式会社
製品情報センター 受付時間 9:00〜17:00(土・日・祝日を除く)
〒530-8552(個別郵便番号)
大阪市北区大深町4-20
電話:0120-921-839
06-7664-8624
06-7664-8624
製品情報問い合わせ先
参天製薬株式会社
製品情報センター 受付時間 9:00〜17:00(土・日・祝日を除く)
〒530-8552(個別郵便番号)
大阪市北区大深町4-20
電話:0120-921-839
06-7664-8624
06-7664-8624
26. 製造販売業者等
26.1 製造販売元
参天製薬株式会社
大阪市北区大深町4-20
その他の説明
パピロックミニ点眼液0.1%の使用方法
1)1回分(1本分)の容器を切り離してください。
2)図の様に薬液が入っていない部分を持ち、容器の先端をねじって、取り外してください。
3)点眼する前に、1〜2滴捨ててください。
4)下まぶたを軽く下にひき、まぶたやまつ毛、目に触れないように点眼してください。両眼に点眼する必要がある場合は、そのままもう片眼に点眼してください。