医薬品情報
| 総称名 | リメタゾン |
|---|---|
| 一般名 | デキサメタゾンパルミチン酸エステル |
| 欧文一般名 | Dexamethasone Palmitate |
| 製剤名 | デキサメタゾンパルミチン酸エステル注射液 |
| 薬効分類名 | 合成副腎皮質ホルモン剤 |
| 薬効分類番号 | 2454 |
| ATCコード | D07AB19 D07XB05 H02AB02 |
| KEGG DRUG |
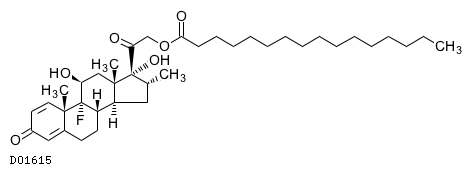
D01615
デキサメタゾンパルミチン酸エステル
|
| KEGG DGROUP |
DG00011
デキサメタゾン
DG01955
副腎皮質ステロイド
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年12月 改訂(第4版 D16)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| リメタゾン静注2.5mg | Limethason INTRAVENOUS INJECTION | 田辺ファーマ | 2454407A1033 | 1818円/管 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 デスモプレシン酢酸塩水和物(男性における夜間多尿による夜間頻尿)を投与中の患者[10.1参照]
4. 効能または効果
関節リウマチ
6. 用法及び用量
通常成人1回1アンプル(デキサメタゾンとして2.5mg)を2週に1回静脈内注射する。
なお、年齢、体重、症状により適宜増減する。
なお、年齢、体重、症状により適宜増減する。
8. 重要な基本的注意
8.1 本剤の投与により、続発性副腎皮質機能不全、消化性潰瘍、糖尿病、精神障害等の重篤な副作用があらわれることがあるので、本剤の投与にあたっては、次の注意が必要である。
・投与に際しては特に適応、症状を考慮し、消炎鎮痛剤、金剤等で抑制できない難治例に使用すること。
・投与中は副作用の出現に対し、常に十分な配慮と観察を行い、また、患者をストレスから避けるようにすること。
・連用後、投与を急に中止すると、ときに発熱、頭痛、食欲不振、脱力感、筋肉痛、関節痛、ショック等の離脱症状があらわれることがあるので、投与を中止する場合には、徐々に減量するなど慎重に行うこと。離脱症状があらわれた場合には、直ちに再投与又は増量すること。
8.2 特に、本剤投与中に水痘又は麻疹に感染すると、致命的な経過をたどることがあるので、次の注意が必要である。
・本剤投与前に水痘又は麻疹の既往や予防接種の有無を確認すること。
・水痘又は麻疹の既往のない患者においては、水痘又は麻疹への感染を極力防ぐよう常に十分な配慮と観察を行うこと。感染が疑われる場合や感染した場合には、直ちに受診するよう指導し、適切な処置を講ずること。
・水痘又は麻疹の既往や予防接種を受けたことがある患者であっても、本剤投与中は、水痘又は麻疹を発症する可能性があるので留意すること。
[11.1.2参照]
8.3 本剤の長期あるいは大量投与中の患者、又は投与中止後6ヵ月以内の患者では、免疫機能が低下していることがあり、生ワクチンの接種により、ワクチン由来の感染を増強又は持続させることがあるので、これらの患者には生ワクチンを接種しないこと。[11.1.2参照]
8.5 褐色細胞腫の合併を認識していなかった状態でデキサメタゾン製剤(経口剤及び注射剤)を投与した際に褐色細胞腫クリーゼを発現したとの報告がある。本剤投与後に著明な血圧上昇、頭痛、動悸等が認められた場合は、褐色細胞腫クリーゼの発現を考慮した上で適切な処置を行うこと。[9.1.10参照]
8.6 リンパ系腫瘍を有する患者にデキサメタゾン製剤(経口剤及び注射剤)を投与した際に腫瘍崩壊症候群があらわれたとの報告がある。本剤投与後に急激な電解質異常や急性腎障害等が認められた場合は、腫瘍崩壊症候群の可能性を考慮し、適切な処置を行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 以下の患者には治療上やむを得ないと判断される場合を除き、投与しないこと。
(1)有効な抗菌剤の存在しない感染症、全身の真菌症の患者
免疫機能抑制作用により、症状が増悪することがある。[11.1.2参照]
(2)消化性潰瘍の患者
肉芽組織増殖抑制作用により、潰瘍治癒(組織修復)が障害されることがある。
(3)精神病の患者
大脳辺縁系の神経伝達物質に影響を与え、症状が増悪することがある。
(4)結核性疾患の患者
免疫機能抑制作用により、症状が増悪することがある。[11.1.2参照]
(5)単純疱疹性角膜炎の患者
免疫機能抑制作用により、症状が増悪することがある。[11.1.2参照]
(6)後嚢白内障の患者
(7)緑内障の患者
(8)高血圧症の患者
電解質代謝作用により、高血圧症が増悪することがある。
(9)電解質異常のある患者
電解質代謝作用により、電解質異常が増悪することがある。
(10)血栓症の患者
血液凝固促進作用により、症状が増悪することがある。
(11)最近行った内臓の手術創のある患者
創傷治癒(組織修復)が障害されることがある。
(12)急性心筋梗塞を起こした患者
心破裂を起こしたとの報告がある。
(13)コントロール不良の糖尿病の患者
糖新生促進作用(血糖値上昇)等により、糖尿病が増悪するおそれがある。
9.1.2 感染症の患者(有効な抗菌剤の存在しない感染症、全身の真菌症の患者を除く)
免疫機能抑制作用により、感染症を増悪させるおそれがある。[11.1.2参照]
9.1.3 糖尿病の患者(コントロール不良の糖尿病の患者を除く)
症状を増悪させるおそれがある。
9.1.4 骨粗鬆症の患者
症状を増悪させるおそれがある。
9.1.5 甲状腺機能低下のある患者
症状を増悪させるおそれがある。
9.1.6 脂肪塞栓症の患者
症状を増悪させるおそれがある。
9.1.7 脂肪肝の患者
症状を増悪させるおそれがある。
9.1.8 重症筋無力症の患者
使用当初、一時症状が増悪することがある。
9.1.9 B型肝炎ウイルスキャリアの患者又は既往感染者
B型肝炎ウイルスの増殖による肝炎があらわれることがある。本剤の投与期間中及び投与終了後は継続して肝機能検査値や肝炎ウイルスマーカーのモニタリングを行うなど、B型肝炎ウイルス増殖の徴候や症状の発現に注意すること。異常が認められた場合には、本剤の減量を考慮し、抗ウイルス剤を投与するなど適切な処置を行うこと。なお、投与開始前にHBs抗原陰性の患者において、B型肝炎ウイルスによる肝炎を発症した症例が報告されている。[11.1.2参照]
9.1.10 褐色細胞腫又はパラガングリオーマのある患者及びその疑いのある患者
褐色細胞腫クリーゼがあらわれることがある。[8.5参照]
9.2 腎機能障害患者
9.2.1 腎不全の患者
症状を増悪させるおそれがある。
9.3 肝機能障害患者
9.3.1 肝硬変の患者
症状を増悪させるおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。新生児に副腎不全を起こすことがある。また、血圧上昇、心筋壁の肥厚を起こすとの報告がある。動物実験(ラット、ウサギ)で催奇形作用(臍ヘルニア、口蓋裂)等が報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。母乳中に移行したとの報告がある。[16.3.2参照]
9.7 小児等
9.7.1 小児の発育抑制があらわれることがある。
9.7.2 長期投与した場合、頭蓋内圧亢進症状があらわれることがある。
9.7.3 低出生体重児で、一過性の肥大型心筋症が起こることが報告されている。
9.8 高齢者
長期投与した場合、感染症の誘発、糖尿病、骨粗鬆症、高血圧症、後嚢白内障、緑内障等の副作用があらわれやすい。
10. 相互作用
相互作用序文
本剤は、肝代謝酵素CYP3A4で代謝される。また、CYP3A4の誘導作用を持つ。
薬物代謝酵素用語
CYP3A4
10.1 併用禁忌
| デスモプレシン酢酸塩水和物(ミニリンメルト)(男性における夜間多尿による夜間頻尿)[2.2参照] | 低ナトリウム血症が発現するおそれがある。 | 機序は不明である。 |
10.2 併用注意
| バルビツール酸誘導体 (フェノバルビタール) フェニトイン リファンピシン | 本剤の作用が減弱することが報告されているので、併用する場合には用量に注意すること。 | バルビツール酸誘導体、フェニトイン、リファンピシンはチトクロームP450を誘導し、本剤の代謝が促進される。 |
| サリチル酸誘導体 (アスピリン、アスピリンダイアルミネート、サザピリン) | 併用時に本剤を減量すると、サリチル酸中毒を起こすことが報告されているので、併用する場合には用量に注意すること。 | 本剤はサリチル酸誘導体の腎排泄と肝代謝を促進し、血清中のサリチル酸誘導体の濃度が低下する。 |
| 抗凝血剤 (ワルファリンカリウム) | 抗凝血剤の作用を減弱させることが報告されているので、併用する場合には用量に注意すること。 | 本剤は血液凝固促進作用がある。 |
| 糖尿病用薬 ビグアナイド系薬剤 スルホニルウレア剤 速効型インスリン分泌促進剤 α-グルコシダーゼ阻害剤 チアゾリジン系薬剤 DPP-4阻害剤 GLP-1受容体作動薬 SGLT2阻害剤 インスリン製剤等 | 糖尿病用薬の作用を減弱させることが報告されているので、併用する場合には用量に注意すること。 | 本剤は肝臓で糖新生を促進し、末梢組織での糖利用を阻害する。 |
| 利尿剤(カリウム保持性を除く) (トリクロルメチアジド、アセタゾラミド、フロセミド) | 低カリウム血症があらわれることがあるので、併用する場合には用量に注意すること。 | 本剤は尿細管でのカリウム排泄促進作用がある。 |
| シクロスポリン | シクロスポリンの血中濃度が上昇するとの報告があるので、併用する場合には用量に注意すること。 | 本剤はシクロスポリンの代謝を阻害する。 |
| HIVプロテアーゼ阻害剤 (サキナビル、リトナビル等) | 本剤のAUCの上昇あるいはこれらの薬剤のAUCが低下するおそれがある。 | チトクロームP450に対して競合する可能性がある。 また、本剤がチトクロームP450を誘導することにより、これらの薬剤の代謝が促進される可能性がある。 |
| マクロライド系抗生物質 (エリスロマイシン) | 本剤の作用が増強するおそれがあるので、併用する場合には用量に注意すること。 | 本剤の代謝酵素(CYP3A)が阻害されるおそれがある。 |
| 非脱分極性筋弛緩剤 (ベクロニウム臭化物、パンクロニウム臭化物) | 他のステロイド剤との併用により非脱分極性筋弛緩剤の作用が減弱又は増強するとの報告があるので、併用する場合には用量に注意すること。 | 機序は不明である。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
呼吸困難、蕁麻疹、喉頭浮腫等があらわれることがある。
11.1.2 誘発感染症、感染症の増悪(いずれも頻度不明)
11.2 その他の副作用
| 0.1〜5%未満 | 頻度不明 | |
| 内分泌系 | 続発性副腎皮質機能不全、糖尿病、月経異常 | |
| 消化器 | 下痢、悪心・嘔吐 | 消化性潰瘍、膵炎、腹部膨満感、食欲亢進、胃痛、胸やけ、口渇 |
| 精神神経系 | 頭痛 | 精神変調、うつ状態、多幸症、痙攣、不眠、眩暈 |
| 筋・骨格系 | 骨粗鬆症、大腿骨及び上腕骨等の骨頭無菌性壊死、ミオパチー、筋肉痛、関節痛 | |
| 脂質・たん白質代謝 | 満月様顔貌 | 野牛肩、窒素負平衡、脂肪肝 |
| 体液・電解質 | 浮腫 | 低カリウム性アルカローシス、血圧上昇 |
| 眼 | 中心性漿液性網脈絡膜症等による網膜障害、眼球突出 | |
| 血液 | 白血球増多 | 血栓症 |
| 皮膚 | 発疹、そう痒、顔面発赤、発汗(異常含む) | ざ瘡、多毛、色素沈着、皮下溢血、紫斑、線条、顔面紅斑、創傷治癒障害、皮膚菲薄化・脆弱化、脂肪織炎、脱毛 |
| その他 | 動悸、発熱、疲労感 | ステロイド腎症、精子数及びその運動性の増減、しびれ感、しゃっくり、体重増加 |
14. 適用上の注意
14.1 薬剤投与時の注意
14.1.1 本剤の投与は静脈注射で行い、原則として点滴注射は避けること。
14.1.2 静脈内投与により、血管痛、静脈炎を起こすことがあるので、これを予防するため、注射部位、注射方法等について十分注意し、注射速度はできるだけ遅くすること。
15. その他の注意
15.1 臨床使用に基づく情報
副腎皮質ホルモン剤を投与中の患者にワクチンを接種して神経障害、抗体反応の欠如が起きたとの報告がある。
16. 薬物動態
16.1 血中濃度
リメタゾンを関節リウマチ患者(50〜80歳、5例)に1mL、及び健康成人(男子26〜29歳、3例)に2mL静脈内投与した際の血漿中濃度推移を図1、2に示す1)。
デキサメタゾンパルミチン酸エステル及び活性代謝物デキサメタゾンの血中半減期、デキサメタゾンの血中最高濃度、デキサメタゾンの血中最高濃度到達時間は、下記のとおりであった。
また、リメタゾンを投与した患者と健康成人との間では、年齢差によると推察されるデキサメタゾンパルミチン酸エステルの血中半減期の差を除き、他のパラメーターに差は認められなかった。
デキサメタゾンパルミチン酸エステル及び活性代謝物デキサメタゾンの血中半減期、デキサメタゾンの血中最高濃度、デキサメタゾンの血中最高濃度到達時間は、下記のとおりであった。
また、リメタゾンを投与した患者と健康成人との間では、年齢差によると推察されるデキサメタゾンパルミチン酸エステルの血中半減期の差を除き、他のパラメーターに差は認められなかった。
図1.関節リウマチ患者にリメタゾンを投与した場合
図2.健康成人にリメタゾンを投与した場合
| 関節リウマチ患者(1mL) | 健康成人(2mL) | |
| デキサメタゾンパルミチン酸エステルの血中半減期(時間) | 2.17±0.51 | 1.13±0.16 |
| デキサメタゾンの血中半減期(時間) | 5.48±1.77 | 5.20±0.69 |
| デキサメタゾンの血中最高濃度(μg/dL血漿) | 4.09±0.92 | 6.62±0.66 |
| デキサメタゾンの血中最高濃度到達時間(時間) | 1.54±0.41 | 1.68±0.26 |
16.3 分布
16.3.1 組織移行性
16.3.2 乳汁移行
16.4 代謝
16.5 排泄
16.5.1 健康男子成人3例にリメタゾン2mLを投与した際、24時間尿中に主代謝物として、6β-ヒドロキシデキサメタゾンが検出された。
16.5.2 3H-デキサメタゾンパルミチン酸エステルより調製したリメタゾンをラットにデキサメタゾンとして0.05mg/kgの用量で静脈内投与し、尿及び糞中の放射能濃度を測定した結果、投与後48時間までに尿に投与量の約60%、糞に投与量の40%の割合で排泄された2)。
注)本剤の承認用量は1回1アンプル(1mL)である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II相試験
活動性関節リウマチ患者78例を対象に、本剤を1回0.1〜3.0mL(デキサメタゾンとして0.25mg〜7.5mg)、延べ106回単回投与した有効率は、67.9%(72/106)であった6)。
副作用発現頻度は3.8%(3例/78例)であった。副作用の内訳は血管痛1.3%(1例/78例)、かゆみ1.3%(1例/78例)、頭痛1.3%(1例/78例)であった。
副作用発現頻度は3.8%(3例/78例)であった。副作用の内訳は血管痛1.3%(1例/78例)、かゆみ1.3%(1例/78例)、頭痛1.3%(1例/78例)であった。
17.1.2 国内第III相試験
関節リウマチ患者72例を対象とした二重盲検比較試験(クロスオーバー法)においても、本剤2週に1回、1回1mL(デキサメタゾンとして2.5mg)を8週にわたり(計4回)投与した試験を行い、対照薬に比べて本剤の有用性が認められている7)。
副作用発現頻度は8.3%(6例/72例)であった。主な副作用は熱感2件、下痢1件、全身倦怠感1件であった。
副作用発現頻度は8.3%(6例/72例)であった。主な副作用は熱感2件、下痢1件、全身倦怠感1件であった。
注)本剤の承認用量は1回1アンプル(1mL)である。
18. 薬効薬理
18.1 作用機序
18.2 抗炎症作用
ラットカラゲニン足浮腫を用いた急性炎症に対しては、デキサメタゾンリン酸エステルナトリウムと同程度の効力を示したにすぎなかったが、ラットのホルマリンろ紙肉芽腫、ラットのカラゲニン肉芽腫及びラットのアジュバント関節炎に対しては、デキサメタゾンリン酸エステルナトリウムに対し、2〜5倍の抗炎症作用を示した8)。
18.3 炎症部への分布
18.4 マクロファージに対する作用
ラットのカラゲニン胸膜炎を用いた胸水のゲルろ過分析により炎症巣へは、遊離のデキサメタゾンとともに乳剤状で、本剤が移行し得ることが示された。このことは、ラットのカラゲニン肉芽腫の炎症巣の電子顕微鏡像によっても示されている10)。
すなわち、乳剤状リメタゾンは、炎症巣マクロファージに積極的に貪食され、遊走能、貪食能、活性酸素生成能にみるマクロファージ機能を水溶性のデキサメタゾンリン酸エステルナトリウムに比べより効率よく抑制することが示された。
すなわち、乳剤状リメタゾンは、炎症巣マクロファージに積極的に貪食され、遊走能、貪食能、活性酸素生成能にみるマクロファージ機能を水溶性のデキサメタゾンリン酸エステルナトリウムに比べより効率よく抑制することが示された。
19. 有効成分に関する理化学的知見
19.1. デキサメタゾンパルミチン酸エステル
20. 取扱い上の注意
外箱開封後は遮光保存すること。
22. 包装
[1mL×10管]
23. 主要文献
- 井伊重雄,他, 薬理と治療, 16 (2), 865-871, (1988)
- 岩井正和,他, 基礎と臨床, 19 (8), 4085-4109, (1985)
- 田辺ファーマ(株):リポステロイドの胎仔,胎盤および乳汁への移行(社内資料)
- 岩井正和,他, 基礎と臨床, 19 (8), 4110-4124, (1985)
- 岡本浩之,他, 炎症, 5 (3), 219-223, (1985) »DOI
- 金子久美子, 炎症, 5 (3), 241-249, (1985) »DOI
- 塩川優一,他, 臨床評価, 13 (1), 195-227, (1985)
- 浜野哲夫,他, 基礎と臨床, 19 (7), 3167-3177, (1985)
- 北川 勉,他, 薬理と治療, 18 (2), 409-417, (1990)
- 名倉一晶,他, 基礎と臨床, 19 (7), 3195-3206, (1985)
24. 文献請求先及び問い合わせ先
文献請求先
田辺ファーマ株式会社
くすり相談センター
〒541-8505
大阪市中央区道修町3-2-10
電話:0120-753-280
製品情報問い合わせ先
田辺ファーマ株式会社
くすり相談センター
〒541-8505
大阪市中央区道修町3-2-10
電話:0120-753-280
26. 製造販売業者等
26.1 製造販売元
田辺ファーマ株式会社
大阪市中央区道修町3-2-10