医薬品情報
| 総称名 | プロマック |
|---|---|
| 一般名 | ポラプレジンク |
| 欧文一般名 | polaprezinc |
| 製剤名 | ポラプレジンク口腔内崩壊錠 |
| 薬効分類名 | 亜鉛含有胃潰瘍治療剤 |
| 薬効分類番号 | 2329 |
| KEGG DRUG |
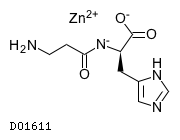
D01611
ポラプレジンク
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年7月 改訂(第1版)

|
4.効能または効果 6.用法及び用量 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| プロマックD錠75 | Promac D tablets 75 | ゼリア新薬工業 | 2329027F1029 | 15.6円/錠 |
4. 効能または効果
6. 用法及び用量
通常、成人にはポラプレジンクとして1回75mgを1日2回朝食後及び就寝前に経口投与する。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中への移行がみられたとの報告がある。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
減量するなど患者の状態を観察しながら投与することが望ましい。一般に消化器機能が低下していることがある。
10. 相互作用
10.2 併用注意
| ペニシラミン製剤 | 同時に服用することにより、併用薬剤の効果を減弱するおそれがあるので、やむを得ず投与する場合には、同時に服用させないなど注意して投与すること。 | 同時投与した場合、本剤が併用薬剤とキレートを形成し、吸収を低下させる可能性がある。 |
| レボチロキシンナトリウム | 同時に服用することにより、併用薬剤の効果を減弱するおそれがあるので、やむを得ず投与する場合には、同時に服用させないなど注意して投与すること。 | 同時投与した場合、本剤が併用薬剤とキレートを形成し、吸収を低下させる可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 肝機能障害、黄疸(いずれも頻度不明)
AST、ALT、γ-GTP、Al-Pの上昇等の肝機能障害、黄疸があらわれることがある。
11.1.2 銅欠乏症(頻度不明)
本剤は亜鉛を含有するため、亜鉛により銅の吸収が阻害され銅欠乏症を起こすことがある。栄養状態不良の患者で銅欠乏に伴う汎血球減少や貧血が報告されている。
注1)発現頻度の算出には使用成績調査を含む
11.2 その他の副作用
| 0.1%〜1%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | 発疹、そう痒感 | 蕁麻疹 | |
| 血液 | 好酸球増多、白血球減少、血小板減少 | ||
| 肝臓 | AST上昇、ALT上昇、Al-P上昇、LDH上昇、γ-GTP上昇 | ||
| 消化器 | 便秘、嘔気、腹部膨満感 | 嘔吐、胸やけ、下痢 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシート誤飲により硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.2 薬剤服用時の注意
14.2.1 本剤は舌の上にのせ唾液を湿潤させ舌で軽くつぶし、崩壊後唾液のみで服用可能である。また、水で服用することもできる。なお、本剤は寝たままの状態では、水なしで服用させないこと。
14.2.2 本剤は口腔内で崩壊するが、口腔粘膜から吸収されることはないため、唾液、又は水で飲み込むこと。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与(絶食下)
健康成人男性にプロマック顆粒15%0.5g又は本剤1錠(ポラプレジンクとして75mg)を単回経口投与した結果、血漿中亜鉛濃度は図の通りであり、顆粒とD錠は生物学的に同等であることが確認されている1)。
単回投与における血漿中亜鉛濃度の推移(顆粒15%:水で服用,D錠75:水で服用)
| \ | 顆粒15% | D錠75 |
| AUC0-12(μg・hr/mL) | 16.85±2.96 | 16.31±2.63 |
| Cmax(μg/mL) | 2.42±0.41 | 2.33±0.38 |
| Tmax(hr) | 1.84±0.50 | 1.47±0.61 |
単回投与における血漿中亜鉛濃度の推移(顆粒15%:水で服用,D錠75:水なしで服用)
| \ | 顆粒15% | D錠75 |
| AUC0-12(μg・hr/mL) | 17.20±2.33 | 16.56±2.29 |
| Cmax(μg/mL) | 2.33±0.28 | 2.19±0.29 |
| Tmax(hr) | 1.95±1.00 | 2.30±1.03 |
16.1.2 連続投与注2)
健康成人男性6名にプロマック顆粒15%を反復経口投与(1日目:ポラプレジンクとして150mgを朝食後に投与、2〜6日目:ポラプレジンクとして150mgを1日3回毎食後投与、7日目:ポラプレジンクとして150mgを朝食絶食下投与)した際の血漿中亜鉛濃度は、下図のように推移した2)。
注2)本データは通常1回用量(75mg)又は、1日用量(150mg)を超えたものである。
連続投与における血漿中亜鉛濃度の推移(顆粒15%)(平均±S.E.,n=6)
16.2 吸収
16.2.1 食事の影響
健康成人男性6名に朝食後にプロマック顆粒15%をポラプレジンクとして150mg投与すると、絶食下にプロマック顆粒15%をポラプレジンクとして150mg投与した際に比べ、Tmaxは延長し、Cmax及びAUCが低下したことから、食事の影響が認められた2)。
16.3 分布
16.3.1 胃粘膜への分布
ラット酢酸潰瘍においてポラプレジンク3mg/kgを単回経口投与した結果、潰瘍部位の亜鉛濃度は投与後12時間まで投与前値(内因性亜鉛濃度)に比べ高値を示した3)。
16.4 代謝
16.5 排泄
16.5.1 尿中排泄
健康成人男性6名にプロマック顆粒15%を反復経口投与(1日目:ポラプレジンクとして150mgを朝食後に投与、2〜6日目:ポラプレジンクとして150mgを1日3回毎食後投与、7日目:ポラプレジンクとして150mgを朝食絶食下投与)した際の亜鉛の尿中排泄率注3)は、150mg単回投与において、絶食時0.47%であった。また、1回150mg1日3回7日間連続投与において、1日の尿中亜鉛排泄率は、0.21%〜0.46%であった2)。
注3)ポラプレジンク非投与時の内因性尿中亜鉛量を差し引いて算出。
16.5.2 糞中排泄
健康成人男性6名にプロマック顆粒15%をポラプレジンクとして1回300mg絶食下経口投与による糞中亜鉛の累積排泄率は、投与後24時間までで41.4%、投与後48時間までで58.8%であった2)。ポラプレジンク投与後24時間までの累積において、糞中に排泄された亜鉛量は、投与前の約2倍であったが、亜鉛の吸収率は低いことから、未吸収の亜鉛によるものと考えられる。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 第III相試験
16歳以上75歳以下で、内視鏡検査により胃潰瘍(潰瘍のステージA1、A2)と診断された患者299例を対象に、プロマック顆粒15%をポラプレジンクとして1日150mg(75mg1日2回)または塩酸セトラキサート800mg(200mg1日4回)を8週間、または内視鏡検査で潰瘍の治癒が確認されるまで投与した。内視鏡的治癒率は、最終判定においてプロマック顆粒群51.1%(67/131例)、塩酸セトラキサート群38.6%(49/127例)であった。自他覚症状改善度及び内視鏡判定を総合した最終改善度判定で、著明改善の率はプロマック顆粒群で50.4%(66/131例)、塩酸セトラキサート群で37.0%(47/127例)であった。副作用は両群で1例も認められなかった7)。
17.1.2 一般臨床試験
16歳以上75歳以下で、内視鏡検査により胃潰瘍(潰瘍のステージA1、A2、H1)の合併が確認された慢性肝炎・肝硬変症の患者10例(慢性肝炎6例、肝硬変4例)を対象に、プロマック顆粒15%をポラプレジンクとして1日150mg(75mg1日2回)12週間、または内視鏡検査で潰瘍の治癒が確認されるまで投与した。8週後の累積治癒率は40.0%(2/5例)であった。自他覚症状改善度及び内視鏡判定を総合した最終改善度判定では、著明改善の率は8週後に40.0%(2/5例)、12週後に33.3%(1/3例)、最終評価時50.0%(3/5例)であった。副作用は1例も認められなかった8)。
18. 薬効薬理
18.1 作用機序
18.2 実験潰瘍に対する作用
18.3 胃粘膜への付着性
潰瘍底及び潰瘍辺縁部粘膜に対する親和性が高く、長時間付着し、潰瘍部位を被覆し、直接保護して治癒促進効果を示す9)(ラット)。
18.4 胃粘膜防御能に対する作用
18.5 細胞保護作用
ラットの胃粘膜プロスタグランジンE2量には影響を及ぼさず、内因性プロスタグランジンを介さない細胞保護作用を示す12)(ラット)。
18.6 膜安定化作用
胃粘膜障害によるライソゾーム酵素の遊離及び肥満細胞の脱顆粒を抑制する作用を有する21)(in vitro)。
18.7 フリーラジカルに対する作用
18.8 創傷治癒促進作用
19. 有効成分に関する理化学的知見
19.1. ポラプレジンク
20. 取扱い上の注意
開封後は湿気を避けて保存すること。
22. 包装
100錠(10錠×10)、140錠(14錠×10)
500錠(10錠×50)、700錠(14錠×50)
23. 主要文献
- 金子淳二, Jpn.Pharmacol.Ther., 34 (6), 675-682, (2006)
- 柴田久雄, 薬理と治療, 20 (1), 149-163, (1992)
- 会田浩幸 他, Ther.Res., 13 (6), 2413-2422, (1992)
- 佐野 廣 他, Arzneim.Forsch/Drug Res., 41 (II), 965-975, (1991)
- 外山誠司 他, Arzneim.Forsch/Drug Res., 41 (II), 976-983, (1991)
- 古田 盛 他, 薬物動態, 8 (5), 1057-1063, (1993) »DOI
- 三好秋馬 他, 薬理と治療, 20 (1), 199-223, (1992)
- 岡部和彦 他, 薬理と治療, 20 (1), 265-273, (1992)
- 清木雅雄 他, 日薬理誌, 99 (4), 255-263, (1992) »PubMed
- 清木雅雄 他, 日薬理誌, 100 (2), 165-172, (1992) »PubMed
- 会田浩幸 他, 日薬理誌, 99 (5), 345-352, (1992) »PubMed
- 荒川哲男 他, Dig.Dis.Sci., 35 (5), 559-566, (1990) »PubMed
- 清木雅雄 他, 日薬理誌, 95 (5), 257-269, (1990) »PubMed
- 清木雅雄 他, Ther.Res., 12 (10), 3243-3251, (1991)
- 森田 仁 他, Ther.Res., 13 (2), 877-883, (1992)
- 伊藤幹雄 他, J.J.Pharmacol., 52 (4), 513-521, (1990) »PubMed
- 米田智幸 他, Ther.Res., 15 (11), 4563-4569, (1994)
- 上木 茂 他, Ther.Res., 13 (2), 851-855, (1992)
- 堀 裕子 他, Ther.Res., 13 (2), 857-861, (1992)
- 清木雅雄 他, 内科宝函, 39 (1), 21-25, (1992)
- C.H.Cho 他, Life Sciences, 49 (23), 189-194, (1991)
- 吉川敏一 他, Biochim.Biophys.Acta, 1115 (1), 15-22, (1991) »PubMed
- 米田智幸 他, 医学のあゆみ, 154 (8), 501-502, (1990)
- 吉川敏一 他, J.Clin.Biochem.Nutr., 7 (2), 107-113, (1989) »DOI
- 吉川敏一 他, Free Rad.Res.Comms., 14 (4), 289-296, (1991)
24. 文献請求先及び問い合わせ先
文献請求先
ゼリア新薬工業株式会社
お客様相談室 受付時間 9:00〜17:50(土日祝日・弊社休業日を除く)
〒103-8351
東京都中央区日本橋小舟町10-11
電話:03-3661-0277
FAX:03-3663-2352
製品情報問い合わせ先
ゼリア新薬工業株式会社
お客様相談室 受付時間 9:00〜17:50(土日祝日・弊社休業日を除く)
〒103-8351
東京都中央区日本橋小舟町10-11
電話:03-3661-0277
FAX:03-3663-2352
26. 製造販売業者等
26.1 製造販売元
ゼリア新薬工業株式会社
東京都中央区日本橋小舟町10-11