医薬品情報
| 総称名 | ペルゴリド |
|---|---|
| 一般名 | ペルゴリドメシル酸塩 |
| 欧文一般名 | Pergolide Mesilate |
| 製剤名 | ペルゴリドメシル酸塩錠 |
| 薬効分類名 | ドパミンD1、D2作動性パーキンソン病治療剤 |
| 薬効分類番号 | 1169 |
| ATCコード | N04BC02 |
| KEGG DRUG |
D00502
ペルゴリドメシル酸塩
|
| KEGG DGROUP |
DG01967
抗パーキンソン病薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年12月 改訂(第1版)
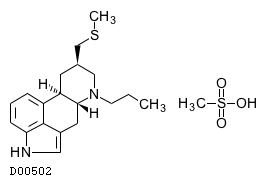
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ペルゴリド錠50μg「サワイ」 (後発品) | PERGOLIDE Tablets [SAWAI] | 沢井製薬 | 1169008F1069 | 15円/錠 | 劇薬, 処方箋医薬品注) |
| ペルゴリド錠250μg「サワイ」 (後発品) | PERGOLIDE Tablets [SAWAI] | 沢井製薬 | 1169008F2065 | 61.1円/錠 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
非麦角製剤の治療効果が不十分又は忍容性に問題があると考えられる患者のみに投与すること。[8.1参照]
6. 用法及び用量
本剤は通常、L-dopa製剤と併用する。
通常、ペルゴリドとして1日1回50μgを夕食直後2日間投与する。以後、2ないし3日ごと、1日用量として50μgずつ増量し、第1週末には1日用量として150μgを投与する。
第2週目は1日用量として300μgより開始し、2ないし3日ごと1日用量として150μgずつ増量する。第2週末には1日用量として600μgを投与する。1日用量100μgの場合は朝食及び夕食直後に、1日用量150μg以上の場合は毎食直後に分けて経口投与する。
第3週目は1日用量750μgより開始し、以後有効性及び安全性を考慮しつつ増量し、維持量(標準1日750〜1250μg)を定める。
なお、上に定める投与量増量速度は随伴症状、年齢等により適宜増減する。
通常、ペルゴリドとして1日1回50μgを夕食直後2日間投与する。以後、2ないし3日ごと、1日用量として50μgずつ増量し、第1週末には1日用量として150μgを投与する。
第2週目は1日用量として300μgより開始し、2ないし3日ごと1日用量として150μgずつ増量する。第2週末には1日用量として600μgを投与する。1日用量100μgの場合は朝食及び夕食直後に、1日用量150μg以上の場合は毎食直後に分けて経口投与する。
第3週目は1日用量750μgより開始し、以後有効性及び安全性を考慮しつつ増量し、維持量(標準1日750〜1250μg)を定める。
なお、上に定める投与量増量速度は随伴症状、年齢等により適宜増減する。
8. 重要な基本的注意
8.1 非麦角製剤と比較して、本剤を含む麦角製剤投与中の心臓弁膜症、線維症の報告が多いので、パーキンソン病に対する薬物療法について十分な知識・経験を持つ医師のもとで本剤の投与を開始するとともに、投与継続中はリスクとベネフィットを考慮すること。[5.、9.1.3、11.1.4参照]
8.2 本剤の投与は、少量から開始し、消化器症状(悪心、嘔吐等)、血圧等の観察を十分に行い、慎重に維持量まで増量すること。
8.3 本剤の長期投与において心臓弁膜症があらわれることがあるので、投与前・投与中に以下の検査を行い、十分な観察を行うこと。なお、投与中止により改善がみられたとの報告例もある。[2.2、11.1.4参照]
・本剤投与開始に際しては、聴診等の身体所見の観察、心エコー検査により潜在する心臓弁膜症の有無を確認すること。
・本剤投与中は、投与開始後3〜6ヵ月以内に、それ以降は少なくとも6〜12ヵ月ごとに心エコー検査を行うこと。また、十分な観察(聴診等の身体所見、胸部X線、CT等)を定期的に行うこと。
8.5 間質性肺炎があらわれることがあるので、患者に対し、本剤の投与中に発熱、咳嗽、呼吸困難等があらわれた場合には、本剤の服用を中止し、直ちに連絡するよう指導すること。[11.1.2参照]
8.6 体位性ないし持続性の低血圧がみられることがあるので、本剤の投与は少量から開始し、血圧等の観察を十分に行い、慎重に投与すること。
8.7 前兆のない突発的睡眠、傾眠がみられることがあるので、自動車の運転、高所での作業等、危険を伴う作業には従事させないように注意すること。[11.1.6参照]
8.8 レボドパ又はドパミン受容体作動薬の投与により、病的賭博(個人的生活の崩壊等の社会的に不利な結果を招くにもかかわらず、持続的にギャンブルを繰り返す状態)、病的性欲亢進、強迫性購買、暴食等の衝動制御障害が報告されているので、このような症状が発現した場合には、減量又は投与を中止するなど適切な処置を行うこと。また、患者及び家族等にこのような衝動制御障害の症状について説明すること。
8.9 本剤の減量、中止が必要な場合は、漸減すること。急激な減量又は中止により、悪性症候群を誘発することがある。また、ドパミン受容体作動薬の急激な減量又は中止により、薬剤離脱症候群(無感情、不安、うつ、疲労感、発汗、疼痛などの症状を特徴とする)があらわれることがある。[11.1.1参照]
8.10 中止する際には漸減すること。本剤を長期にわたり服用している患者で、投与を突然中止すると幻覚を誘発するおそれがある。[11.1.7参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 精神病又はその既往のある患者
ドパミン受容体作動性のため統合失調症の症状である幻覚、妄想等を悪化させる可能性がある。
9.1.2 不整脈又はその既往のある患者
心房性期外収縮、洞性頻脈発症例の増加が報告されている。
9.1.3 胸膜炎、胸水、胸膜線維症、肺線維症、心膜炎、心膜滲出液、後腹膜線維症又はその既往のある患者
特に、麦角製剤投与中にこれらの疾患・症状を発現したことのある患者では、これらを悪化させる可能性がある。[8.1参照]
9.1.4 レイノー病の患者
末梢血管障害を悪化させるおそれがある。
9.2 腎機能障害患者
9.2.1 腎障害又はその既往歴のある患者
腎障害等の症状が悪化することがある。
9.3 肝機能障害患者
9.3.1 肝障害又はその既往歴のある患者
国内臨床試験では除外されている。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないことが望ましい。外国で本剤の投与を受けた女性の一部が妊娠し、33妊娠例で健児を出産したが、6妊娠例では先天異常(重度3例、軽度3例)が認められたとの報告がある。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ヒト乳汁移行の有無は不明であるが、薬理作用より乳汁分泌を抑制する可能性がある。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
用量に留意して患者の状態を観察しながら慎重に投与すること。本剤は主として肝臓で代謝されるが、高齢者では肝機能が低下していることが多いため、高い血中濃度が持続するおそれがある。
10. 相互作用
10.2 併用注意
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 悪性症候群(頻度不明)
高熱、意識障害、高度の筋硬直、不随意運動、血清CKの上昇等があらわれることがある。投与開始初期の場合は中止し、また、継続投与中の用量変更・中止時の場合は一旦もとの投与量に戻した後慎重に漸減し、体冷却、水分補給等の適切な処置を行うこと。[8.9参照]
11.1.2 間質性肺炎(0.1%未満)
発熱、咳嗽、呼吸困難、肺音の異常(捻髪音)等があらわれた場合には、速やかに胸部X線検査を実施し、異常が認められた場合には投与を中止し、副腎皮質ホルモン剤投与等の適切な処置を行うこと。[8.5参照]
11.1.3 胸膜炎、胸水、胸膜線維症、肺線維症、心膜炎、心膜滲出液(いずれも頻度不明)
胸痛、呼吸器症状等があらわれた場合には、速やかに胸部X線検査を実施し、異常が認められた場合には投与を中止し、適切な処置を行うこと。[8.4参照]
11.1.4 心臓弁膜症(頻度不明)
11.1.5 後腹膜線維症(頻度不明)
背部痛、下肢浮腫、腎機能障害等があらわれた場合には、投与を中止し、適切な処置を行うこと。[8.4参照]
11.1.6 突発的睡眠(頻度不明)
前兆のない突発的睡眠があらわれることがある。[8.7参照]
11.1.7 幻覚、妄想(5%以上)、せん妄(0.1〜5%未満)[8.10参照]
11.1.8 腸閉塞(0.1〜5%未満)
11.1.9 意識障害(0.1%未満)、失神(頻度不明)
過度の血圧低下を起こし、一過性の意識障害、失神があらわれることがある。
11.1.10 肝機能障害(0.1%未満)、黄疸(頻度不明)
AST、ALT、γ-GTPの上昇等を伴う肝機能障害、黄疸があらわれることがある。
11.1.11 血小板減少(0.1〜5%未満)
注)発現頻度は使用成績調査を含む。
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | 発疹、紅斑等 | |||
| 精神神経系 | 不安・興奮・焦燥感、ジスキネジア、めまい・ふらつき | 傾眠・ねむけ、頭がボーッとする、不眠、徘徊、夜間驚愕・夜間発声、うつ状態、性欲亢進等の精神症状、頭痛・頭重感、口内異和感、四肢のしびれ、すくみ足、振戦、無動、ジストニア、味覚障害、眼瞼痙攣、硬直感等の神経症状 | 錯乱 | 強剛 |
| 消化器 | 悪心、嘔吐、胃部不快感・胸やけ、食欲不振 | 便秘、口渇、胃痛・心窩部痛、腹部膨満感、口内炎・口中のあれ、下痢等 | 消化性潰瘍 | |
| 肝臓 | 肝機能異常(AST、ALT、Al-P、γ-GTP、LDH、ビリルビン) | |||
| 循環器 | 立ちくらみ・起立性低血圧、動悸、不整脈、徐脈、前胸部圧迫感、血圧上昇、血圧低下 | レイノー現象 | ||
| 呼吸器 | 呼吸困難感・息切れ、鼻閉 | しゃっくり | ||
| 血液 | 白血球減少、貧血 | |||
| 腎臓 | 浮腫、尿蛋白、尿潜血 | BUN上昇、クレアチニン上昇 | ||
| 泌尿器 | 排尿障害 | 尿閉、尿失禁 | ||
| その他 | 全身けん怠感、脱力感、熱感、発汗・冷汗、月経停止、摂食異常、耳痛、脱毛 | 視覚異常 | 嚥下性肺炎、発熱、CK上昇、疼痛、紅痛症(四肢の熱感・発赤・痛みを伴う腫れ)、薬剤離脱症候群(無感情、不安、うつ、疲労感、発汗、疼痛など)a) |
13. 過量投与
13.1 症状
1回量60mgを故意に服用した患者で嘔吐、低血圧、興奮が、また、処方量1日当たり7mgのかわりに1日当たり19mgを誤って3日間服用した患者では、重篤な幻覚が、更に、処方量0.7mgのかわりに不注意で7mgを投与された患者では動悸、低血圧、心室性期外収縮が認められている。
13.2 処置
活性炭の使用も考慮する。多くの例において催吐、胃洗浄よりも有効である。抗不整脈剤、フェノチアジン、ブチロフェノン系の抗精神病薬の投与も必要に応じ考慮する。透析、血液灌流の効果は確立されていない。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.2 薬剤投与時の注意
動物試験で眼刺激性及び吸入毒性が認められており、また、本剤の粉砕時に眼刺激、異臭、頭重感等が認められたとの報告があるので、以下の点に注意すること。
・粉砕は避けること。
・本剤は服薬直前に包装より取り出すこと。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 本剤による治療中、原因不明の突然死が報告されている。
15.1.2 外国の研究において、1日3000μgより多い投与量では、線維化による心臓弁膜症のリスクが高いとの報告がある。
15.2 非臨床試験に基づく情報
動物実験(ラット及びマウス)で、長期大量投与により、子宮内膜腫瘍が低率で発生したとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 外国人健康成人男性3例に14C-ペルゴリドメシル酸塩138μgを単回経口投与したときの薬物動態パラメータは以下のとおりであった2)。
| 投与量 (μg/人) | tmax (h) | Cmax (ng eq/mL) | t1/2,β (h) |
| 138 | 1〜3 | 1.8a) | 15〜42 |
16.1.2 生物学的同等性試験
<ペルゴリド錠50μg「サワイ」>
ペルゴリド錠50μg「サワイ」とペルマックス錠50μgを健康成人男子にそれぞれ1錠(ペルゴリドとして50μg)空腹時単回経口投与(クロスオーバー法)し、血漿中ペルゴリド濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された3)。
| Cmax (pg/mL) | Tmax (hr) | T1/2 (hr) | AUC0-32hr (pg・hr/mL) | |
| ペルゴリド錠50μg「サワイ」 | 9.8±5.8 | 4.5±1.3 | 7.1±2.2 | 107.9±64.6 |
| ペルマックス錠50μg | 8.9±4.7 | 4.7±1.4 | 7.6±2.3 | 98.9±54.6 |
血漿中濃度ならびにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.3 分布
16.3.1 血液−胎盤関門通過性
妊娠12日目のラットに14C-ペルゴリドメシル酸塩2mg/kgを投与したときの胎児内の放射能濃度は、投与後2時間で最高濃度を示し、母体血漿中濃度の50%であった4)。
16.3.2 乳汁への移行性
授乳期ラットに14C-ペルゴリドメシル酸塩2mg/kgを投与したときの乳汁中放射能濃度は、最高値でその時の血漿中濃度の14倍を示し、乳汁中移行性は高かった4)。
16.3.3 血漿蛋白結合率
ヒト血漿蛋白結合率は97.1%であった。また、L-dopa存在下でのペルゴリドメシル酸塩のヒト血漿蛋白結合率は98.6%と変化は認められなかった4)(in vitro)。
16.5 排泄
外国人健康成人男性3例に14C-ペルゴリドメシル酸塩138μgを単回経口投与したときの放射能の排泄率は、尿中55%、糞中40%及び呼気5%であった2)。
16.8 その他
<ペルゴリド錠250μg「サワイ」>
ペルゴリド錠250μg「サワイ」は溶出挙動に基づき、ペルゴリド錠50μg「サワイ」と生物学的に同等とみなされた5)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内後期第II相試験
パーキンソン病(若年性パーキンソニズムを含む)の患者317例に8週間のL-dopa併用オープン試験を行った。原則として投与開始の最初の2日間はペルゴリドを1日50μgから始め、2日ごとに50〜150μgずつ増量した。投与開始後2週間で750μgまで増量し、その後、適宜増減した。
ペルゴリドの1日最終投与量は897±30μg(平均±標準誤差、n=314、最大3900μg)であった注)。その結果、症状別評価スコアにおいては、全29の調査症状中28症状に有意な改善が認められた6)。
ペルゴリドの1日最終投与量は897±30μg(平均±標準誤差、n=314、最大3900μg)であった注)。その結果、症状別評価スコアにおいては、全29の調査症状中28症状に有意な改善が認められた6)。
| 疾患名 | 有効率(%) (中等度改善以上) |
| パーキンソン病 | 52.9 (166/314例) |
また、併用したL-dopa/DCI投与量が下表のように低下した。
| 疾患名 | L-dopa/DCI投与量 (L-dopaとして、mg/日)(n=299) | |
| 開始時 | 終了時 | |
| パーキンソン病 | 430±29 | 407±28 |
副作用発現頻度は42.6%(135/317例)であった。主な副作用は、悪心・嘔気・嘔吐17.0%(54/317例)、胃部不快感・もたれ7.3%(23/317例)、ジスキネジア7.3%(23/317例)、幻覚・幻視・幻聴6.6%(21/317例)、めまい・ふらつき5.4%(17/317例)及び食欲不振5.0%(16/317例)であった。
17.1.2 国内長期試験
パーキンソン病(若年性パーキンソニズムを含む)の患者314例に最長投与期間2年10ヵ月のL-dopa併用長期試験を行った。原則として投与開始の最初の2日間はペルゴリドを1日50μgから始め、2日ごとに50〜150μgずつ増量した。投与開始後2週間で750μgまで増量し、その後、適宜増減した。
ペルゴリドの1日最終投与量は1年未満治療例で852±78μg(平均±標準誤差、n=59)、1年以上治療例で1069±38μg(平均±標準誤差、n=255)であった注)。その結果、症状別評価スコアにおいては、1年以上長期治療例において全29の調査症状中27症状に有意な改善が認められた7)。
ペルゴリドの1日最終投与量は1年未満治療例で852±78μg(平均±標準誤差、n=59)、1年以上治療例で1069±38μg(平均±標準誤差、n=255)であった注)。その結果、症状別評価スコアにおいては、1年以上長期治療例において全29の調査症状中27症状に有意な改善が認められた7)。
| 疾患名 | 治療例 | 有効率(%)a) (中等度改善以上) |
| パーキンソン病 | 1年未満 | 34.2 (13/38例) |
| 1年以上 | 51.4 (126/245例) |
また、併用したL-dopa/DCI投与量が下表のように低下した。
| 疾患名 | 治療例 | L-dopa/DCI投与量 (L-dopaとして、mg/日)(n=298) | |
| 開始時 | 終了時 | ||
| パーキンソン病 | 1年未満 | 425±11 | 382±22 (n=55) |
| 1年以上 | 423±12 (n=243) | ||
副作用発現頻度は49.4%(155/314例)であった。主な副作用は、ジスキネジア14.6%(46/314例)、幻覚13.4%(42/314例)、嘔気・悪心13.1%(41/314例)、胃部不快感11.5%(36/314例)、食欲不振9.9%(31/314例)、めまい・ふらつき7.0%(22/314例)、妄想及び不安・興奮 各5.4%(17/314例)であった。
17.1.3 第III相臨床試験
パーキンソン病(若年性パーキンソニズムを含む)の患者228例を対象にブロモクリプチンを対照薬とする8週間のL-dopa併用二重盲検比較試験を実施した。最終1日平均投与量はペルゴリド1258±60μg注)、ブロモクリプチン14.6±0.6mgであった。その結果、有用性評価(有用以上)はペルゴリド群48.5%(50/103例)、ブロモクリプチン群41.3%(43/104例)と同等性が認められた8)。
副作用発現頻度はペルゴリド群50.5%(55/109例)、ブロモクリプチン群42.2%(49/116例)であった。ペルゴリド群の主な副作用は、胃部不快感21.1%(23/109例)、悪心・嘔気・むかつき20.2%(22/109例)、食欲不振・食欲低下19.3%(21/109例)、幻覚・幻視・幻聴・幻臭及び便秘 各7.3%(8/109例)、嘔吐及び口渇 各5.5%(6/109例)であった。
副作用発現頻度はペルゴリド群50.5%(55/109例)、ブロモクリプチン群42.2%(49/116例)であった。ペルゴリド群の主な副作用は、胃部不快感21.1%(23/109例)、悪心・嘔気・むかつき20.2%(22/109例)、食欲不振・食欲低下19.3%(21/109例)、幻覚・幻視・幻聴・幻臭及び便秘 各7.3%(8/109例)、嘔吐及び口渇 各5.5%(6/109例)であった。
注)本剤の承認された標準維持量は1日750〜1250μgである。
18. 薬効薬理
18.1 作用機序
18.1.1 ペルゴリドは線条体におけるシナプス後ドパミン受容体を直接刺激することによりパーキンソン病に対する治療効果を発現すると考えられている9)。
18.1.2 ウシ脳より抽出した脳線条体膜において、脳内ドパミンD1及びD2両受容体に親和性を有する9)。
18.2 薬理作用
18.2.1 常同行動の誘発作用
ラットにおいて用量依存的に常同行動の誘発作用を示した10)。
18.2.2 回転運動の誘発作用
18.2.3 抗振戦作用
腹内側被蓋野(VMT)を障害したサルにおいて生じる体位性振戦に対し、強い抗振戦作用を示した13)。
18.2.4 黒質線条体ドパミン神経に及ぼす影響
ラットへの長期投与(2年間)により、黒質線条体ドパミン神経の加齢に伴う変性の防止作用を示した14)。
18.2.5 ドパミン代謝回転率に及ぼす影響
ラットの脳内3,4-dihydroxyphenyl acetic acid(DOPAC)含量を減少させ、ドパミン代謝回転率を減少させたが、セロトニン、ノルアドレナリンの代謝に対する影響は弱かった15)。
19. 有効成分に関する理化学的知見
19.1. ペルゴリドメシル酸塩
20. 取扱い上の注意
アルミピロー包装開封後は、湿気を避けて遮光して保存すること。
22. 包装
<ペルゴリド錠50μg「サワイ」>
PTP[乾燥剤入り]
100錠(10錠×10)
<ペルゴリド錠250μg「サワイ」>
PTP[乾燥剤入り]
100錠(10錠×10)
23. 主要文献
- Yen, T. T.et al., Life Sciences, 25, 209-216, (1979) »PubMed
- Rubin, A.et al., Clin. Pharmacol. Ther., 30, 258-265, (1981) »PubMed
- 社内資料:生物学的同等性試験(錠50μg)
- 江角凱夫他, 薬物動態, 7, 61-69, (1992) »DOI
- 社内資料:生物学的同等性試験(錠250μg)
- 楢林博太郎他, 臨床医薬, 7, 151-192, (1991)
- 楢林博太郎他, 医学と薬学, 27, 471-534, (1992)
- 楢林博太郎他, 医学と薬学, 27, 147-211, (1992)
- Wong, D. T.et al., Arz-Forsch., 43, 409-412, (1993) »PubMed
- Koller, W. C.et al., Neuropharmacology, 19, 831-837, (1980) »PubMed
- Clemens, J. A.et al., Arz-Forsch., 43, 281-286, (1993) »PubMed
- Duvoisin, R. C.et al., Neurology, 32, 1387-1391, (1982) »PubMed
- Goldstein, M.et al., Adv. Neurol., 24, 247-252, (1979)
- Felten, D. L.et al., Neurobiol. Aging, 13, 339-351, (1992) »PubMed
- Fuller, R. W.et al., Life Sciences, 24, 375-382, (1979) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
製品情報問い合わせ先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
26. 製造販売業者等
26.1 製造販売元
沢井製薬株式会社
大阪市淀川区宮原5丁目2-30