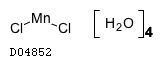医薬品情報
| 総称名 | ボースデル |
|---|---|
| 一般名 | 塩化マンガン四水和物 |
| 製剤名 | 塩化マンガン四水和物内用液 |
| 薬効分類名 | MRI用経口消化管造影剤 |
| 薬効分類番号 | 7290 |
| KEGG DRUG |
D04852
塩化マンガン四水和物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年7月 改訂(第3版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 7.用法及び用量に関連する注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ボースデル内用液10 | Bothdel Oral Solution | 健栄製薬 | 7290006S1021 | 784.1円/袋 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 消化管の穿孔又はその疑いのある患者[消化管外(腹腔内等)に漏れることにより、腹膜炎等の重篤な症状を引き起こすおそれがある。]
2.2 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
磁気共鳴胆道膵管撮影における消化管陰性造影
5. 効能または効果に関連する注意
本剤はT2強調画像で陰性造影効果を示す。なお、T1強調画像では陽性造影効果を示す。
6. 用法及び用量
通常、成人には1袋250mL[塩化マンガン四水和物36mg(マンガンとして10mg)を含む]を経口投与する。
7. 用法及び用量に関連する注意
本剤は1.0T以上のMRI機器で使用することが望ましい(1.0T未満のMRI機器での使用経験がない)。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、診断上の有益性が危険性を上回ると判断される場合にのみ投与すること。ウサギの100mg/kg/日以上の投与群で妊娠早期の全胚・胎児死亡が、ラットの200mg/kg/日以上の投与群で出生児体重の増加抑制が報告されている。
9.6 授乳婦
診断上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。実験(ラットのマンガン静注)で乳汁中への移行が報告されている。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
| テトラサイクリン系経口抗生物質 ミノサイクリン塩酸塩 ドキシサイクリン塩酸塩水和物 ニューキノロン系経口抗菌剤 レボフロキサシン水和物 メシル酸ガレノキサシン水和物 シタフロキサシン水和物 セフジニル | 左記薬剤の作用が減弱するおそれがあるので、造影終了後3時間程度服用時間をあける等注意する。 | 消化管内で難溶性のキレートを形成して左記薬剤の吸収を阻害することが考えられる。 |
11. 副作用
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 頻度不明 | |
| 過敏症 | 発疹・蕁麻疹 | ||
| 消化器 | 軟便 | 下痢、腹痛、腹鳴、悪心、腹部膨満、胸やけ | |
| 精神神経系 | 眠気、頭痛 | ||
| その他 | 尿蛋白陽性、尿糖陽性 | 血清鉄低下、血清フェリチン減少 |
14. 適用上の注意
14.1 薬剤投与時の注意
14.1.1 本剤は経口投与以外には使用しないこと。
14.1.2 投与の際には、本剤容器(アルミラミネートフィルム製のパウチ)から紙コップなどの非金属容器に移すこと。
14.2 薬剤投与後の注意
1回の検査にのみ使用し、飲み残した場合は液剤を廃棄すること。
14.3 診断上の注意
通常、本剤服用後、造影効果は約20分後まで持続するが、胃内通過時間は個人によって大きく異なることがあるので注意すること。なお、追加投与による有効性は確立していない(使用経験がない)。
16. 薬物動態
16.1 血中濃度
健康成人男子6名に本剤18、54、162mg注)を経口投与したところ、1名(54、162mg投与時)に一過性の血液中マンガン濃度の上昇が認められたが、投与量との関連性は認められなかった。また他の被験者では血液中濃度の変動は認められなかった。血清中マンガン濃度は、2名(54、162mg投与時1名、162mg投与時1名)に一過性の上昇が認められたが、これらはいずれも正常範囲内(7ng/mL以下)であった。その他の被験者ではいずれの用量においても投与前後で変化はなく、ほとんどが定量限界(1ng/mL)程度であった1)。
16.5 排泄
健康成人男子6名に本剤18、54、162mg注)を経口投与したところ、投与後48時間までのマンガンの尿中排泄量はいずれも投与量の0.01%未満であった。また162mg投与後48時間までに投与量の88%以上が糞中に排泄された1)。
注)本剤の承認された用量は、1袋250mL〔塩化マンガン四水和物36mg(マンガンとして10mg)を含む〕である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相臨床試験
胆嚢、胆管、膵管またはその周辺領域に病変が疑われる患者を対象とし、塩化マンガン四水和物36mgを投与した結果、投与された106例での有効率は、MRCP90.5%(95/105)、T1強調94.6%(88/93)であった2)。
副作用は、安全性解析対象例106例中、21例(19.8%)24件認められた。主な副作用は軟便9件(8.5%)、下痢4件(3.8%)、腹鳴2件(1.9%)、傾眠2件(1.9%)であった。
副作用は、安全性解析対象例106例中、21例(19.8%)24件認められた。主な副作用は軟便9件(8.5%)、下痢4件(3.8%)、腹鳴2件(1.9%)、傾眠2件(1.9%)であった。
18. 薬効薬理
18.1 測定法
本剤の有効成分は塩化マンガン四水和物中のマンガンである。マンガンイオン(Mn2+)は常磁性を示すため、MRI検査において本剤を投与するとMn2+の強い磁気モーメントにより組織中の水プロトンの緩和時間が短縮する。このためT2強調画像におけるMRI信号の消失によりコントラストが増強される(陰性造影効果)。なお、同じ用量でT1強調画像ではMRI信号強度の上昇によりコントラストが増強される(陽性造影効果)3)。
19. 有効成分に関する理化学的知見
19.1. 塩化マンガン四水和物
22. 包装
5袋
23. 主要文献
- 内田英二ほか, 診療と新薬, 46 (10), 1068-1077, (2009)
- 赤羽正章ほか, 診療と新薬, 49 (3), 355-366, (2012)
- 上野英雄ほか, 新薬と臨床, 54 (11), 1421-1430, (2005)
24. 文献請求先及び問い合わせ先
文献請求先
健栄製薬株式会社
学術情報部
〒541-0044
大阪市中央区伏見町2丁目5番8号
電話:06-6231-5822
FAX:06-6204-0750
製品情報問い合わせ先
健栄製薬株式会社
学術情報部
〒541-0044
大阪市中央区伏見町2丁目5番8号
電話:06-6231-5822
FAX:06-6204-0750
26. 製造販売業者等
26.1 製造販売元
健栄製薬株式会社
大阪市中央区伏見町2丁目5番8号