医薬品情報
| 総称名 | パタノール |
|---|---|
| 一般名 | オロパタジン塩酸塩 |
| 欧文一般名 | Olopatadine Hydrochloride |
| 製剤名 | オロパタジン塩酸塩点眼液 |
| 薬効分類名 | 抗アレルギー点眼剤 |
| 薬効分類番号 | 1319 |
| ATCコード | S01GX09 |
| KEGG DRUG |
D01192
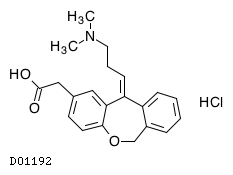
オロパタジン塩酸塩
|
| KEGG DGROUP |
DG01482
ヒスタミンH1受容体拮抗薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年1月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| パタノール点眼液0.1% | Patanol Ophthalmic Solution 0.1% | ノバルティスファーマ | 1319752Q1024 | 85.9円/mL |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対して過敏症の既往歴のある患者
4. 効能または効果
アレルギー性結膜炎
6. 用法及び用量
通常、1回1〜2滴、1日4回(朝、昼、夕方及び就寝前)点眼する。
8. 重要な基本的注意
8.1 本剤の使用により効果が認められない場合には、漫然と長期にわたり投与しないよう注意すること。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット、経口)で乳汁中への移行及び出生児の体重増加抑制が報告されている。
9.7 小児等
低出生体重児、新生児、乳児を対象とした臨床試験は実施していない。
11. 副作用
11.2 その他の副作用
| 0.5〜5%未満 | 0.5%未満 | 頻度不明 | |
| 眼 | 眼痛 | 角膜炎、そう痒症、眼刺激、眼瞼浮腫、眼の異常感、充血、眼瞼炎、眼脂、結膜濾胞、結膜出血、眼瞼湿疹、眼瞼紅斑、流涙増加、眼の異物感、眼部不快感、眼瞼障害 | 眼乾燥、眼瞼縁痂皮、霧視、眼瞼痛 |
| 精神神経系 | 頭痛 | 味覚異常、めまい | |
| 肝臓 | ALT上昇、AST上昇 | ||
| その他 | ヘマトクリット減少、尿中ブドウ糖陽性 | 接触性皮膚炎、口内乾燥、悪心、過敏症、咽喉乾燥 |
14. 適用上の注意
14.1 薬剤交付時の注意
16. 薬物動態
16.1 血中濃度
16.1.1 反復投与
アレルギー患者(12例)に0.1%オロパタジン点眼液を、両眼に1回2滴、6時間ごとに(1日4回点眼)4日間反復点眼したときのオロパタジン(未変化体)の血漿中濃度推移及び薬物動態パラメータは下記のとおりであった(定量限界値は0.05ng/mL)3)。
オロパタジン(未変化体)血漿中濃度推移
(平均値±標準偏差 n=12)
| 点眼日 | Cmax(ng/mL) | Tmax(hr) | AUC0-6(ng・hr/mL) | 消失半減期(hr) |
| 3日目 | 0.610±0.518 | 1.21±0.62 | 2.07±1.46 | 算出できず |
| 4日目 | 0.520±0.416 | 1.23±0.62 | 1.90±1.16※2 | 3.1±1.3 |
| 検定※1(Paired t test) | p=0.0814 | 検定せず | p=0.1249 | 検定せず |
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 海外後期第II相試験(抗原誘発試験)
無症状期の日本人アレルギー性結膜炎患者(147例)を対象に海外で実施した後期第II相試験において、片眼にオロパタジン点眼液(0.01%群38例、0.05%群38例、0.1%群35例、0.15%群36例)、対眼にプラセボをそれぞれ1回1滴点眼し、点眼4時間後に抗原誘発を行った。抗原誘発5分後におけるそう痒感の平均スコアの0.1%群(本剤群)とプラセボ群との差と95%信頼区間は、−1.19、[−1.52,−0.85]であり、抗原誘発20分後における総合充血の平均スコアの本剤群とプラセボ群との差と95%信頼区間は、−0.93、[−1.49,−0.37]であった。
本剤投与群35例(安全評価対象例)で副作用は認められなかった4)。
本剤投与群35例(安全評価対象例)で副作用は認められなかった4)。
17.1.2 国内第III相比較試験(ケトチフェンフマル酸塩点眼液を対照薬とした二重盲検並行群間比較試験)
アレルギー性結膜炎患者(247例)を対象に、本剤又は0.05%ケトチフェンフマル酸塩点眼液を両眼に1回2滴、1日4回(朝、昼、夕、就寝前)28日間点眼投与したところ、そう痒感及び充血の重症度点数において、本剤は0.05%ケトチフェンフマル酸塩点眼液に劣らない有効性を示した。
そう痒感
充血の合計
副作用発現頻度は、本剤投与群で4.8%(6/124例)であった。副作用は眼痛2.4%(3/124例)、角膜炎NOS0.8%(1/124例)、アラニン・アミノトランスフェラーゼ増加1.6%(2/124例)、アスパラギン酸アミノトランスフェラーゼ増加0.8%(1/124例)であった5)。
18. 薬効薬理
18.1 作用機序
オロパタジン塩酸塩は、選択的ヒスタミンH1受容体拮抗作用を主作用とし、更に肥満細胞からの化学伝達物質の遊離・産生抑制作用を有する。
18.2 抗ヒスタミン作用(in vitro)
18.3 抗アレルギー作用(in vitro)
18.4 動物結膜炎モデルにおける作用
ヒスタミン誘発によるモルモット結膜における血管透過性亢進を抑制(ED50値:0.002%)した。感作モルモットの抗原誘発による眼瞼と眼球結膜の充血及び膨疹を抑制(ED50値:0.017%)した11)。
19. 有効成分に関する理化学的知見
19.1. オロパタジン塩酸塩
20. 取扱い上の注意
外箱開封後は、遮光して保存すること。
22. 包装
5mL×10本
23. 主要文献
- Momose T,et al., CLAO J., 23 (2), 96-99, (1997) »PubMed
- Christensen MT,et al., CLAO J., 24 (4), 227-231, (1998) »PubMed
- 社内資料:アレルギー患者における血中濃度(2006年7月26日承認、申請資料概要ヘ-4(2))
- 社内資料:後期第II相試験(抗原誘発試験2)(2006年7月26日承認、申請資料概要ト-1(10))
- 社内資料:第III相試験1−フマル酸ケトチフェン点眼液との比較−(C-06-53試験)(2006年7月26日承認、申請資料概要ト-1(8))
- Sharif NA,et al., J.Ocul.Pharmacol.Ther., 12 (4), 401-407, (1996) »PubMed
- 社内資料:作用機序(ヒスタミン受容体拮抗作用)(2006年7月26日承認、申請資料概要ホ-3)
- Yanni JM,et al., Arch.Ophthalmol., 117 (5), 643-647, (1999) »PubMed
- 社内資料:作用機序(ヒト結膜肥満細胞からの炎症性伝達物質遊離へ及ぼす影響)(2006年7月26日承認、申請資料概要ホ-2)
- Cook EB,et al., Ann.Allergy Asthma Immunol., 84 (5), 504-508, (2000) »PubMed
- Yanni JM,et al., J.Ocul.Pharmacol.Ther., 12 (4), 389-400, (1996) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
協和キリン株式会社
くすり相談窓口
〒100-0004
東京都千代田区大手町1-9-2
電話:0120-850-150 受付時間 9:00〜17:30(土・日・祝日及び弊社休日を除く)
ノバルティスファーマ株式会社
ノバルティスダイレクト
〒105-6333
東京都港区虎ノ門1-23-1
電話:0120-003-293 受付時間:月〜金 9:00〜17:30(祝日及び当社休日を除く)
製品情報問い合わせ先
協和キリン株式会社
くすり相談窓口
〒100-0004
東京都千代田区大手町1-9-2
電話:0120-850-150 受付時間 9:00〜17:30(土・日・祝日及び弊社休日を除く)
ノバルティスファーマ株式会社
ノバルティスダイレクト
〒105-6333
東京都港区虎ノ門1-23-1
電話:0120-003-293 受付時間:月〜金 9:00〜17:30(祝日及び当社休日を除く)
26. 製造販売業者等
26.1 製造販売(輸入)
ノバルティスファーマ株式会社
東京都港区虎ノ門1-23-1
26.2 販売元
協和キリン株式会社
東京都千代田区大手町1-9-2