医薬品情報
| 総称名 | アンコチル |
|---|---|
| 一般名 | フルシトシン |
| 欧文一般名 | Flucytosine |
| 製剤名 | フルシトシン錠 |
| 薬効分類名 | 深在性真菌症治療剤 |
| 薬効分類番号 | 6290 |
| ATCコード | J02AX01 |
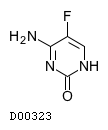
| KEGG DRUG |
D00323
フルシトシン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年12月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アンコチル錠500mg | Ancotil Tablets | 共和薬品工業 | 6290001F1050 | 534.1円/錠 | 劇薬, 処方箋医薬品 |
1. 警告
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
<有効菌種>
クリプトコックス、カンジダ、アスペルギルス、ヒアロホーラ、ホンセカエア
<適応症>
真菌血症、真菌性髄膜炎、真菌性呼吸器感染症、黒色真菌症、尿路真菌症、消化管真菌症
6. 用法及び用量
<真菌血症、真菌性髄膜炎、真菌性呼吸器感染症、黒色真菌症>
通常フルシトシンとして1日100〜200mg/kgを4回に分割経口投与する。
<尿路真菌症、消化管真菌症>
通常フルシトシンとして1日50〜100mg/kgを4回に分割経口投与する。
なお、患者の症状に応じて適宜増減する。
なお、患者の症状に応じて適宜増減する。
8. 重要な基本的注意
本剤の投与に際しては血液検査、腎機能検査(BUN、クレアチニン・クリアランス、尿検査等)・肝機能検査等を定期的に行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 血液障害のある患者又は既往に血液障害を起こした患者
重篤な血液障害があらわれることがある。
9.1.2 薬物過敏症の既往歴のある患者(ただし、本剤の成分に対し過敏症の既往歴のある患者には投与しないこと)
9.2 腎機能障害患者
投与前にクレアチニン・クリアランス試験を行い、用量並びに投与間隔に留意して使用すること。腎排泄の障害により本剤が蓄積する。[16.6.1参照]
9.3 肝機能障害患者
重篤な肝障害があらわれるおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。ラットで外形、骨格異常(40mg/kg/日以上)が、マウスで外形異常(400mg/kg/日)の催奇形作用が報告されている。[2.2参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
用量並びに投与間隔に留意するなど注意すること。本剤は、主として腎臓から排泄されるが、高齢者では腎機能が低下していることが多いため高い血中濃度が持続するおそれがある。
10. 相互作用
10.1 併用禁忌
| テガフール・ギメラシル・オテラシルカリウム配合剤 (ティーエスワン)[1.、2.3参照] | 早期に重篤な血液障害や下痢、口内炎等の消化管障害等が発現するおそれがあるので、テガフール・ギメラシル・オテラシルカリウム配合剤投与中及び投与中止後少なくとも7日以内は本剤を投与しないこと。 | ギメラシルがフルオロウラシルの異化代謝を阻害し、血中フルオロウラシル濃度が著しく上昇する。 |
10.2 併用注意
| 骨髄抑制を起こすおそれのある薬剤 抗悪性腫瘍剤等 放射線照射 | 血液障害等の副作用が増強するおそれがある | 骨髄抑制作用を増強するためと考えられている。 |
| アムホテリシンB | 本剤の毒性(骨髄抑制作用)が増強されるおそれがある。 | アムホテリシンBによるフルシトシンの細胞内取り込み促進や腎排泄障害作用により、本剤の毒性が増強される可能性がある。 |
| トリフルリジン・チピラシル塩酸塩配合剤 | 重篤な骨髄抑制等の副作用が発現するおそれがある。 | 本剤との併用により、トリフルリジンのDNA取り込みが増加する可能性がある。 チピラシル塩酸塩がチミジンホスホリラーゼを阻害することにより、本剤の代謝に影響を及ぼす可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 汎血球減少、無顆粒球症(いずれも頻度不明)
11.1.2 腎不全(頻度不明)
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 血液 | 白血球減少 | 貧血、顆粒球減少、血小板減少 | ||
| 腎臓 | BUN上昇 | クレアチニン上昇、腎障害 | ||
| 肝臓 | AST、ALTの上昇 | Al-P上昇 | ||
| 消化器 | 食欲不振、嘔気 | 胃部不快感、下痢 | 嘔吐、腹痛 | |
| 神経系 | 頭痛、しびれ感、視力低下、幻覚、難聴、傾眠、不随意運動、痙攣 | |||
| 過敏症 | 発疹 | 光線過敏症 | ||
| その他 | 血清カリウム低下 | 血清カルシウム、血清リンの低下 |
12. 臨床検査結果に及ぼす影響
酵素法によるクレアチニン値の測定ではみかけ上の高値を呈することがあるので注意すること。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
フルオロウラシルの異化代謝酵素であるジヒドロピリミジンデヒドロゲナーゼ(DPD)欠損等の患者がごくまれに存在し、このような患者に他のフッ化ピリミジン系薬剤を投与した場合、投与初期に重篤な副作用(口内炎、下痢、血液障害、神経障害等)が発現したとの報告がある。
16. 薬物動態
16.1 血中濃度
健康成人男子12例にフルシトシン1.5g(本剤500mg3錠)を単回経口投与したときの血漿中濃度及び各種パラメータは以下の表16-1、図16-1のとおりであった1)。
| AUC(μg・hr/mL) | Cmax(μg/mL) | Tmax(hr) | T1/2(hr) |
| 220.5±7.2 | 35.7±1.9 | 1.1±0.2 | 4.6±0.2 |
図16-1 血漿中濃度(健康成人男子)
16.3 分布
16.3.1 髄液内濃度
黒色真菌症患者にフルシトシン200mg/kg/日を3日間連続経口投与したとき、血清中及び髄液内濃度の最高値はそれぞれ52μg/mL、40μg/mLであり、血中から髄液への移行率はおよそ80%であった2)。
16.3.2 喀痰中濃度
肺アスペルギローム患者にフルシトシン5g(本剤500mg10錠)を単回経口投与したとき、血清及び喀痰中濃度は、投与3時間後にはそれぞれ113μg/mL、16.5μg/mLであり、投与6時間後にはそれぞれ68μg/mL、26μg/mLであった3)。
16.4 代謝
健康成人男子にフルシトシン3.5gを単回経口投与したとき、本薬はほとんど代謝されず98%以上が未変化体として尿中に排泄された4)(外国人データ)。
16.5 排泄
健康成人男子12例にフルシトシン1.5g(本剤500mg3錠)を単回経口投与したときの尿中濃度は、投与後速やかに上昇し、投与後24時間までに約90%が尿中に排泄された1)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
健康成人10例及び腎機能障害患者40例にフルシトシン2gを単回経口投与したときの血清中薬物濃度半減期と血清クレアチニン値の関係、クレアチニン・クリアランス値によるフルシトシンの投与量は以下の表16-2、表16-3のとおりであった5)(外国人データ)。[9.2参照]
| 血清クレアチニン(mg/dL) | 例数 | 半減期(hr) |
| 0.6〜1.1(健康成人) | 10 | 2.89 |
| 1.0〜2.0 | 13 | 5.37 |
| 2.2〜4.5 | 8 | 16.8 |
| >4.5(Max 15.3) | 14 | 38.6 |
| 無尿患者及び腎摘出患者 | 5 | 85.0 |
| クレアチニン・クリアランス値(mL/min) | 1回用量(mg/kg) | 投与間隔 |
| >40 | 25〜50 | 6時間(1日4回) |
| 40〜20 | 25〜50 | 12時間(1日2回) |
| 20〜10 | 25〜50 | 24時間(1日1回) |
| <10 | 50 | 24時間以上※ |
16.6.2 血液透析患者
血液透析患者にフルシトシンを単回経口投与したところ、蛋白結合率が5%未満であり、血液透析により速やかに除かれ、毎透析後25〜50mg/kgを1回投与することにより治療上有効な血中濃度が得られた報告がある6)(外国人データ)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内一般臨床試験
承認時迄及び効能追加等に実施された一般臨床試験135例における有効率注1)は表17-1、表17-2のとおりであった7)。
| 疾患名 | 例数 | 有効率(%) |
| 真菌血症 | 7 | 71.4 |
| 真菌性髄膜炎 | 22 | 54.5 |
| 真菌性呼吸器感染症 | 27 | 66.7 |
| 黒色真菌症 | 29 | 72.4 |
| 尿路真菌症 | 41 | 87.8 |
| 消化管真菌症 | 9 | 100.0 |
| 菌種 | 例数 | 有効率(%) |
| クリプトコックス | 16 | 43.8 |
| カンジダ | 72 | 86.1 |
| アスペルギルス | 15 | 53.3 |
| ヒアロホーラ | 7 | 42.9 |
| ホンセカエア | 23 | 78.3 |
注1)「治癒、著効、有効、無効」の判定から有効以上を集計した。
18. 薬効薬理
18.1 作用機序
18.2 抗真菌作用
最小発育阻止濃度(MIC、μg/mL)は以下の表18-1のとおりであった11)。
| 菌種 | MIC |
| クリプトコックス | <0.5 |
| カンジダ | 0.5〜2 |
| アスペルギルス | 0.5〜4 |
| ヒアロホーラ | 1〜4 |
| ホンセカエア | 0.5〜32 |
18.3 その他
本剤は単独投与により耐性化が認められた症例が報告されている12)。
19. 有効成分に関する理化学的知見
19.1. フルシトシン
20. 取扱い上の注意
外箱開封後は遮光して保存すること。本剤は吸湿性が強いので湿気を避けて保存し、服用直前までPTPシートから取り出さないこと。
22. 包装
100錠[10錠(PTP)×10]
23. 主要文献
- 社内資料:生物学的同等性試験
- 小野博久,他, 基礎と臨床, 10, 2469-2476, (1976)
- 池本秀雄,他, 真菌と真菌症, 17, 193-198, (1976) »DOI
- Polak,A.,et al., Chemotherapy., 22, 137-153, (1976) »PubMed
- Block,E.R.,et al., Ann.Intern.Med., 80, 613-617, (1974) »PubMed
- Schonebeck,J.,et al., Chemotherapy., 18, 321-336, (1973) »PubMed
- 社内資料:臨床試験
- 新井正,他, 真菌と真菌症, 16, 41-49, (1975) »DOI
- 山口英世,他, 真菌と真菌症, 17, 201-211, (1977)
- Polak,A.,et al., Chemotherapy., 21, 113-130, (1975) »PubMed
- 岩田和夫,他, 真菌と真菌症, 17, 156-163, (1976) »DOI
- 高木繁治,他, 神経内科, 13, 426-432, (1980)
24. 文献請求先及び問い合わせ先
文献請求先
共和薬品工業株式会社
お問い合わせ窓口
〒530-0005
大阪市北区中之島3-2-4
電話:0120-041-189
FAX:06-6121-2858
製品情報問い合わせ先
共和薬品工業株式会社
お問い合わせ窓口
〒530-0005
大阪市北区中之島3-2-4
電話:0120-041-189
FAX:06-6121-2858
26. 製造販売業者等
26.1 製造販売元
共和薬品工業株式会社
大阪市北区中之島3-2-4