医薬品情報
| 総称名 | ペミラストン |
|---|---|
| 一般名 | ペミロラストカリウム |
| 欧文一般名 | Pemirolast Potassium |
| 薬効分類名 | アレルギー性疾患治療剤 |
| 薬効分類番号 | 4490 |
| KEGG DRUG |
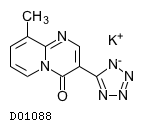
D01088
ペミロラストカリウム
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年3月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ペミラストンドライシロップ0.5% | PEMILASTON Dry Syrup 0.5% | アルフレッサファーマ | 4490011R1060 | 27.3円/g |
2. 禁忌
次の患者には投与しないこと
2.1 妊婦又は妊娠している可能性のある女性[9.5参照]
2.2 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
<気管支喘息>
通常、小児にはペミロラストカリウムとして1回0.2mg/kgを1日2回、朝食後及び就寝前に、用時溶解して経口投与する。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
年齢別の標準投与量は、通常、下記の用量を1回量とし、1日2回朝食後及び就寝前に、用時溶解して経口投与する。
| 年齢 | ドライシロップ1回投与量 |
| 1歳以上5歳未満 | 0.5g(ペミロラストカリウムとして2.5mg) |
| 5歳以上11歳未満 | 1.0g(ペミロラストカリウムとして5.0mg) |
| 11歳以上 | 2.0g(ペミロラストカリウムとして10.0mg) |
<アレルギー性鼻炎>
通常、小児にはペミロラストカリウムとして1回0.1mg/kgを1日2回、朝食後及び就寝前に、用時溶解して経口投与する。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
年齢別の標準投与量は、通常、下記の用量を1回量とし、1日2回朝食後及び就寝前に、用時溶解して経口投与する。
| 年齢 | ドライシロップ1回投与量 |
| 1歳以上5歳未満 | 0.25g(ペミロラストカリウムとして1.25mg) |
| 5歳以上11歳未満 | 0.5g(ペミロラストカリウムとして2.5mg) |
| 11歳以上 | 1.0g(ペミロラストカリウムとして5.0mg) |
7. 用法及び用量に関連する注意
高齢者への本剤の投与により副作用があらわれた場合は、減量(例えば半量)又は休薬するなど注意すること。[9.8参照]
8. 重要な基本的注意
<効能共通>
8.1 本剤は、気管支拡張剤、ステロイド剤、抗ヒスタミン剤等と異なり、すでに起こっている発作や症状を速やかに軽減する薬剤ではないので、このことは患者に十分説明しておく必要がある。
8.2 本剤の使用によりステロイド維持量を減量し得た患者で、本剤の投与を中止する場合は、原疾患再発のおそれがあるので、注意すること。
8.3 本剤を季節性の患者に投与する場合は、好発季節を考えて、その直前から投与を開始し、好発季節終了時まで続けることが望ましい。
8.4 本剤の使用により効果が認められない場合には、漫然と長期にわたり投与しないよう注意すること。
<気管支喘息>
8.5 本剤を投与中、大発作をみた場合は、気管支拡張剤あるいはステロイド剤を投与する必要がある。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 長期ステロイド療法を受けている患者
本剤投与によりステロイドの減量をはかる場合は、十分な管理下で徐々に行うこと。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。動物実験(ラット)で大量投与により、胎児発育遅延が報告されている。[2.1参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中への移行が報告されている。
9.7 小児等
低出生体重児、新生児を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
一般に生理機能が低下している。[7.参照]
11. 副作用
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | |
| 過敏症 | − | 発疹、そう痒、蕁麻疹、浮腫(顔面、四肢等)、湿疹、顔面潮紅 |
| 精神神経系 | 眠気 | 倦怠感、頭痛、頭がボーッとする |
| 消化器 | 腹痛、嘔気 | 下痢、口渇、便秘、食欲不振、胸やけ、胃もたれ感、嘔吐、口内炎 |
| 血液 | − | 貧血、血小板増加 |
| 肝臓 | ALT上昇、AST上昇 | γ-GTP上昇、Al-P上昇 |
| 腎臓 | − | 蛋白尿、BUN上昇 |
| 泌尿器 | − | 頻尿、血尿等の膀胱炎様症状 |
| その他 | − | 全身関節痛、鼻腔乾燥感、鼻痛 |
14. 適用上の注意
14.1 薬剤調製時
本剤は他剤と配合し液剤とした場合には、pHの変化により沈殿が生じることがあるので配合を避けること。
16. 薬物動態
16.1 血中濃度
小児の気管支喘息患者6例(7〜13歳、体重19〜35kg)にペミロラストカリウム0.2mg/kgを食後経口投与したところ、投与後1.5時間で最高血漿中濃度(Cmax)0.682μg/mLに達し、半減期(T1/2)は4.12時間であった1)。
16.2 吸収
ペミロラストカリウム5mg錠、10mg錠及びドライシロップの生物学的同等性試験を12名の健康成人男子を対象として行った結果、3製剤は生物学的に同等であった2)。
16.5 排泄
小児の気管支喘息患者6例(7〜13歳、体重19〜35kg)にペミロラストカリウム0.2mg/kgを食後経口投与したところ、投与後12時間以内に投与量の約70%が尿中に排出され、その大部分はグルクロン酸抱合体であった1)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<気管支喘息>
17.1.1 国内第II相試験
(1)後期第II相試験
小児気管支喘息患者を対象に体重区分ごとに低用量あるいは高用量を無作為に割り付け、ペミロラストカリウム5mg/日、10mg/日又は20mg/日を1日2回6週間経口投与した。有用率注1)は低用量群(0.349mg/kg/日以下)でやや有用以上87.7%(71/81例)、高用量群(0.350mg/kg/日以上)でやや有用以上82.6%(71/86例)であった。副作用発現頻度は低用量群0%(0/87例)、高用量群3.2%(3/93例)であり、副作用は嘔気、蕁麻疹、AST上昇が各0.6%(1/180例)であった3)。
17.1.2 国内第III相試験
(1)二重盲検群間比較試験
小児気管支喘息患者を対象に体重区分ごとにペミロラストカリウム5mg/日、10mg/日、20mg/日を1日2回、又はトラニラスト57mg/日、81mg/日、114mg/日、162mg/日、213mg/日、267mg/日を1日3回6週間経口投与した。ペミロラストカリウム群はトラニラスト群に比し有意に有用率注1)が高かった。ペミロラストカリウム群の副作用発現頻度は1.8%(2/111例)であり、副作用はAST上昇0.9%(1/111例)及び判定不能1例であった。一方、トラニラスト群3.7%(4/109例)であった4)。
| 投与群 | Fisher | U検定 | |||
| ペミロラスト群 | トラニラスト群 | ||||
| n | 108 | 102 | |||
| 有用率注1) (%)、(例数) | 極めて有用 | 16.7(18) | 7.8(8) | p=0.0607 | p=0.0049 |
| 有用以上 | 63.0(68) | 45.1(46) | p=0.0125 | ||
| やや有用以上 | 81.5(88) | 70.6(72) | p=0.0752 | ||
(2)長期投与試験
(3)非盲検・非対照試験
小児気管支喘息患者を対象に体重区分に従いペミロラストカリウム5mg/日、10mg/日又は20mg/日を1日2回6週間経口投与した。有用率注1)はやや有用以上92.6%(25/27例)であった。副作用発現頻度は3.3%(1/30例)で、副作用は腹痛3.3%(1/30例)であった7)。
注1)投与終了時に、観察項目、併用薬剤の使用状況より判断した最終全般改善度と概括安全度から総合的に評価した全般有用度から算出。
<アレルギー性鼻炎>
17.1.3 国内第II相試験
(1)後期第II相試験
小児アレルギー性鼻炎患者を対象に体重区分ごとに低用量あるいは高用量を無作為に割り付け、ペミロラストカリウム2.5mg/日、5mg/日、10mg/日又は20mg/日を1日2回4週間経口投与した。有用率注2)は低用量群(平均投与量0.185mg/kg/日)でやや有用以上94.7%(36/38例)、高用量群(平均投与量0.387mg/kg/日)でやや有用以上92.6%(25/27例)であった。副作用発現頻度は低用量群2.5%(1/40例)、高用量群0%(0/30例)であり、副作用は下痢が1.4%(1/70例)であった8)。
注2)投与終了時に、投与全期間の改善度を対照観察期間中の自他覚所見と比較し判断した最終全般改善度と、概括安全度から総合的に評価した有用度から算出。
18. 薬効薬理
18.1 作用機序
18.2 ケミカルメディエーター遊離抑制作用
18.3 好酸球機能抑制作用
18.4 I型アレルギー反応に対する作用
19. 有効成分に関する理化学的知見
19.1. ペミロラストカリウム
22. 包装
0.5g×200[4連包×50]
1g×200[4連包×50]
100g[プラスチック瓶、バラ、乾燥剤入り]
500g[プラスチック瓶、バラ、乾燥剤入り]
23. 主要文献
- 黒沼忠由樹 他, 診療と新薬, 27, 1961-1965, (1990)
- 西野晴夫 他, 薬理と治療, 20, 869-877, (1992)
- 三河春樹 他, 小児科臨床, 43, 1785-1799, (1990)
- 馬場 實 他, 小児科臨床, 43, 2477-2484, (1990)
- 三河春樹 他, 基礎と臨床, 24, 8085-8092, (1990)
- 市村登寿 他, 小児科臨床, 44, 401-407, (1991)
- 馬場 實 他, 小児科臨床, 44, 1071-1093, (1991)
- 馬場駿吉 他, 耳鼻咽喉科展望, 38, 657-676, (1995) »DOI
- Fujimiya,H.et al., Int Arch Allergy Appl Immunol., 96, 62-67, (1991) »PubMed
- Fujimiya,H.et al., アレルギー, 43, 142-151, (1994) »DOI
- Yanagihara,Y.et al., Jpn J Pharmacol., 48, 103-112, (1988) »PubMed
- 川島敏男 他, アレルギー, 37, 438-447, (1988) »DOI
- Yanagihara,Y.et al., Jpn J Pharmacol., 51, 83-92, (1989) »PubMed
- Kawashima,T.et al., 応用薬理, 46, 265-271, (1993)
- 大塚博邦 他, 薬理と治療, 20, 4081-4087, (1992)
- Kawashima,T.et al., Int Arch Allergy Appl Immunol., 103, 405-409, (1994)
- 高田秀之 他, アレルギー, 41, 1187, (1992)
- Yanagihara,Y.et al., Jpn J Pharmacol., 48, 91-101, (1988) »PubMed
- 鈴木義裕 他, 応用薬理, 44, 675-678, (1992)
24. 文献請求先及び問い合わせ先
文献請求先
アルフレッサファーマ株式会社
製品情報部
〒540-8575
大阪市中央区石町二丁目2番9号
電話:06-6941-0306
FAX:06-6943-8212
製品情報問い合わせ先
アルフレッサファーマ株式会社
製品情報部
〒540-8575
大阪市中央区石町二丁目2番9号
電話:06-6941-0306
FAX:06-6943-8212
26. 製造販売業者等
26.1 製造販売元
アルフレッサファーマ株式会社
大阪市中央区石町二丁目2番9号