医薬品情報
| 総称名 | モディオダール |
|---|---|
| 一般名 | モダフィニル |
| 欧文一般名 | Modafinil |
| 製剤名 | モダフィニル錠 |
| 薬効分類名 | 精神神経用剤 |
| 薬効分類番号 | 1179 |
| ATCコード | N06BA07 |
| KEGG DRUG |
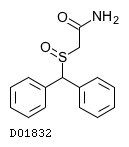
D01832
モダフィニル
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年12月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| モディオダール錠100mg | MODIODAL Tablets 100mg | アルフレッサファーマ | 1179047F1022 | 303.6円/錠 | 劇薬, 向精神薬(第一種), 処方箋医薬品注) |
1. 警告
本剤の投与は、本剤の適正使用推進策について十分に理解し、あらかじめ登録された医師・薬剤師のいる登録医療機関・薬局のもとでのみ行うとともに、それら薬局においては、調剤前に当該医師・医療機関を確認した上で調剤を行うこと。[5.1参照]
2. 禁忌
次の患者には投与しないこと
2.1 重篤な不整脈のある患者[症状を悪化させるおそれがある。]
2.2 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
下記疾患に伴う日中の過度の眠気
5. 効能または効果に関連する注意
<効能共通>
5.1 本剤の投与は、睡眠障害に関する十分な知識と治療経験を有し、本剤の安全性及び有効性を十分理解し、本剤による治療方法に関し精通した医師が行うこと。[1.参照]
<ナルコレプシー>
5.2 本剤の適用にあたっては、米国睡眠医学会が編纂した睡眠障害国際分類(ICSD-1、ICSD-2又はICSD-3)の診断基準を参考に他の睡眠障害と鑑別した上で、ナルコレプシーと診断された患者を対象とすること。また、終夜睡眠ポリグラフ検査(終夜PSG)及び反復睡眠潜時検査(MSLT)等の客観的検査で確認した上で本剤の投与を判断すること。
5.3 本剤はカタプレキシー等の日中の過度の眠気以外のナルコレプシー症状に対する効果は認められていない。
<特発性過眠症>
5.4 本剤の適用にあたっては、米国睡眠医学会が編纂した睡眠障害国際分類(ICSD-1、ICSD-2又はICSD-3)の診断基準を参考に他の睡眠障害と鑑別した上で、特発性過眠症と診断された患者を対象とすること。また、終夜睡眠ポリグラフ検査(終夜PSG)及び反復睡眠潜時検査(MSLT)等の客観的検査で確認した上で本剤の投与を判断すること。
<閉塞性睡眠時無呼吸症候群>
5.5 本剤の投与は、睡眠時無呼吸症候群の診断・治療に精通した医師と睡眠障害の診断・治療に精通した医師との連携のもとで行うこと。
5.6 本剤の適用にあたっては、閉塞性睡眠時無呼吸症候群と診断され、CPAP療法等の気道閉塞に対する治療が3ヵ月以上適切に行われているにもかかわらず、日中の過度の眠気が残存する患者に対し、眠気の原因となる他の疾患との鑑別診断を行った上で投与すること。なお、日中の過度の眠気については、反復睡眠潜時検査(MSLT)等の客観的検査で確認した上で本剤の投与を判断すること。
5.7 本剤は日中の過度の眠気以外の閉塞性睡眠時無呼吸症候群の症状及び気道閉塞に対する効果は認められていない。
6. 用法及び用量
通常、成人にはモダフィニルとして1日1回200mgを朝に経口投与する。
なお、年齢、症状により適宜増減するが、1日最大投与量は300mgまでとする。
なお、年齢、症状により適宜増減するが、1日最大投与量は300mgまでとする。
7. 用法及び用量に関連する注意
覚醒効果があるので、不眠に注意し、夕刻以後の服用は原則として避けさせること。
8. 重要な基本的注意
<効能共通>
8.1 眠気の程度によっては本剤の服用によっても覚醒レベルが正常に復さない可能性があるので、日中の眠気等の臨床症状について観察を十分に行い、必要に応じて自動車の運転等危険を伴う機械の操作には従事させないように注意すること。
8.2 動物実験(サル)より、精神依存の形成が示唆されており、連用により薬物依存が生じるおそれがある。観察を十分に行い、用量及び使用期間に注意すること。[9.1.5参照]
8.3 うつ病、躁病、その他の精神系疾患又はその既往のない患者においても、幻覚、妄想、自殺念慮等の精神症状が報告されている。これらの症状があらわれた場合は本剤の投与中止を考慮すること。[9.1.3参照]
<閉塞性睡眠時無呼吸症候群>
8.4 本剤の効果は睡眠に代わるものではなく、適切な睡眠を確保する必要があることを患者に説明すること。
8.5 本剤投与にあたっては、CPAP療法等の気道閉塞に対する治療を継続し、患者に対して生活習慣の改善を指導するとともに、投与継続の要否について定期的に検討し、本剤を漫然と投与しないよう注意すること。
8.6 高血圧、心血管疾患を合併していることが多いので、本剤投与前及び投与中は、心電図検査を実施するなど、合併症の状態を定期的に確認すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 心障害又はその既往歴のある患者(重篤な不整脈のある患者を除く)
症状を悪化させるおそれがある。
9.1.2 高血圧の患者
血圧を上昇させるおそれがある。
9.1.3 うつ病、躁病、その他の精神系疾患又はその既往のある患者
症状を悪化させるおそれがある。[8.3参照]
9.1.4 てんかん又はその既往歴のある患者
痙攣閾値を低下させるおそれがある。
9.1.5 薬物依存、アルコール依存等の既往歴のある患者
観察を十分に行い、用量及び使用期間に注意すること。[8.2参照]
9.2 腎機能障害患者
9.2.1 重篤な腎機能障害のある患者
排泄が遅延するおそれがある。[16.6.1参照]
9.3 肝機能障害患者
9.3.1 重篤な肝機能障害のある患者
低用量から投与を開始するなど慎重に投与すること。高い血中濃度が持続し副作用が発現するおそれがある。[16.6.2参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないことが望ましい。ウサギの生殖発生毒性試験の高用量群(180mg/kg/日)において胎児に眼瞼開裂、前・後肢の内側転回、指の癒合が報告されている。
9.6 授乳婦
授乳中の女性には本剤投与中は授乳しないことが望ましい。動物実験(ラット)において、モダフィニルが乳汁中に移行することが認められている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
低用量から投与を開始するなど慎重に投与すること。クリアランスの低下及びCmax、AUCが増加する。[16.6.3参照]
10. 相互作用
相互作用序文
本剤は、一部薬物代謝酵素CYP3A4で代謝される。また、本剤はCYP2C9、CYP2C19を阻害し、CYP1A2、CYP2B6、CYP3A4を誘導すると考えられている。
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
CYP2C9
薬物代謝酵素用語
CYP2C19
薬物代謝酵素用語
CYP1A2
薬物代謝酵素用語
CYP2B6
10.2 併用注意
| 経口避妊薬 エチニルエストラジオール シクロスポリン トリアゾラム [16.7.3、16.7.4参照] | これらの薬剤の血中濃度が低下するおそれがある。 | 本剤がこれらの主代謝酵素であるCYP3A4を誘導するためと考えられる。 |
| 昇圧剤 ノルアドレナリン、アドレナリン | 昇圧剤の作用を増強するおそれがある。 | 本剤の交感神経刺激作用によるものと考えられる。 |
| MAO阻害剤 セレギリン塩酸塩 ラサギリンメシル酸塩 サフィナミドメシル酸塩 | MAO阻害剤の作用を増強するおそれがある。 | 本剤の交感神経刺激作用によるものと考えられる。 |
| ワルファリン | ワルファリンの作用を増強するおそれがある。 | 本剤がワルファリンの主代謝酵素であるCYP2C9を阻害するためと考えられる。 |
| フェノバルビタール | 本剤の血中濃度が低下するおそれがある。 | フェノバルビタールがCYP3A4を誘導することにより、本剤の代謝が促進するためと考えられる。 |
| CYP2C19により代謝される薬剤 プロトンポンプ阻害剤等 | これらの薬剤の血中濃度が上昇するおそれがある。 | 本剤がCYP2C19を阻害するためと考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)、多形紅斑(いずれも頻度不明)
11.1.2 薬剤性過敏症症候群1)(頻度不明)
初期症状として発疹、発熱がみられ、さらに肝機能障害、リンパ節腫脹、白血球増加、好酸球増多、異型リンパ球出現等を伴う遅発性の重篤な過敏症状があらわれることがある。なお、発疹、発熱、肝機能障害等の症状が再燃あるいは遷延化することがあるので注意すること。
11.1.3 ショック、アナフィラキシー(いずれも頻度不明)
蕁麻疹、そう痒感、血管性浮腫、呼吸困難、血圧低下、チアノーゼ等があらわれた場合には投与を中止し、適切な処置を行うこと。
11.2 その他の副作用
| 5%以上 | 5%未満 | 頻度不明 | |
| 過敏症 | − | 発疹、そう痒 | 血管性浮腫 |
| 肝臓 | − | AST、ALT、γ-GTP、Al-P、LDHの上昇 | − |
| 精神神経系 | 頭痛(23.2%)、不眠 | めまい、傾眠、いらいら感、カタプレキシーの増悪、しびれ、神経過敏、振戦、ジスキネジー、不安、うつ状態、躁状態 | 錯感覚、幻覚、妄想、攻撃性、興奮、思考異常 |
| 循環器 | 動悸 | 血圧上昇、頻脈、胸痛 | − |
| 消化器 | 口渇 | 食欲不振、胃部不快感、悪心・嘔吐、下痢、便秘、胃炎、腹痛、口内炎、食欲亢進、舌炎、鼓腸 | 消化不良 |
| その他 | 体重減少 | 鼻咽頭炎、肩こり、発汗、発熱、倦怠感、トリグリセリド上昇、コレステロール上昇、白血球数減少、熱感、耳鳴、体重増加、背部痛、鼻炎、咳嗽、尿臭異常 | 血管拡張(潮紅)、末梢性浮腫 |
13. 過量投与
13.1 症状
過量投与により、不眠症、中枢神経系症状(落ち着きのなさ、失見当識、錯乱、激越、不安、興奮、幻覚)、消化器系症状(悪心、下痢)、心血管系症状(頻脈、徐脈、高血圧、胸痛)が起こることがある。
外国の市販後において過量服用による死亡例が報告されている。
外国の市販後において過量服用による死亡例が報告されている。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男性24例にモダフィニル50mg、100mg、200mg及び400mg注)を空腹時単回経口投与した場合、血漿中未変化体濃度は投与後1.9〜3.0時間にピークに達し、以後9.9〜14.8時間の半減期で消失した。また、未変化体のAUC0-∞及びCmaxに用量直線性が認められた2)。
未変化体(ラセミ体)の平均血漿中濃度(平均値±標準偏差)
| 投与量(mg) | Cmax(μg/mL) | Tmax(hr) | T1/2(hr) | AUC0-∞(μg・hr/mL) |
| 50 | 1.49±0.28 | 2.2±1.4 | 9.92±3.24 | 16.95±5.28 |
| 100 | 3.20±0.56 | 1.9±1.4 | 11.77±2.22 | 40.34±9.58 |
| 200 | 6.19±0.87 | 2.5±0.8 | 13.39±3.12 | 83.75±11.59 |
| 400 | 10.53±2.30 | 3.0±0.9 | 14.78±2.76 | 191.39±61.93 |
注)本剤の承認された1日最大投与量は300mgである。
16.1.2 反復投与
健康成人男性18例にモダフィニル100mg、200mg及び300mgを1日1回7日間反復経口投与した場合、血漿中未変化体濃度は投与4日目に定常状態に達した。また、未変化体のAUC0-24及びCmaxに用量直線性が認められた3)。
| 投与量(mg) | 投与日 | Cmax(μg/mL) | Tmax(hr) | T1/2(hr) | AUC0-24(μg・hr/mL) |
| 100 | 1日目 | 2.30±0.17 | 1.9±0.7 | − | 23.70±2.84 |
| 7日目 | 3.06±0.11 | 2.0±0.9 | 12.08±3.05 | 34.45±3.84 | |
| 200 | 1日目 | 5.12±0.33 | 2.5±0.8 | − | 52.32±4.81 |
| 7日目 | 6.40±0.42 | 2.6±0.9 | 12.83±1.58 | 74.79±6.50 | |
| 300 | 1日目 | 7.15±0.61 | 3.0±0.9 | − | 81.62±10.98 |
| 7日目 | 10.30±1.45 | 2.3±1.0 | 13.51±1.85 | 113.99±19.89 |
16.2 吸収
16.2.1 食事の影響
健康成人男性12例に、モダフィニル200mgをクロスオーバー法で食後又は空腹時に単回経口投与した場合、血漿中未変化体の薬物動態パラメータに差が認められなかったことから、本剤の吸収に対する食事の影響はないものと考えられた4)。
| 食事条件 | Cmax(μg/mL) | Tmax(hr) | T1/2(hr) | AUC0-∞(μg・hr/mL) |
| 空腹時 | 5.16±1.42 | 2.4±0.9 | 14.27±3.07 | 69.78±20.05 |
| 食後 | 5.10±0.82 | 2.9±1.1 | 14.86±2.43 | 75.00±17.16 |
16.3 分布
16.3.1 蛋白結合率
ヒト血漿蛋白結合率は約60%であり、主にアルブミンと結合する。モダフィニル200mg/日投与により定常状態に達した後の血清を用いたex vivo試験において、モダフィニルはワルファリン、ジアゼパム及びプロプラノロールの蛋白結合に影響を及ぼさなかった5)。
16.4 代謝
16.4.1 代謝経路
モダフィニルは加水分解による脱アミド化、S酸化、水酸化及びグルクロン酸抱合を通して代謝される6)。
16.4.2 薬物代謝酵素
ヒト肝実質初代培養細胞を用いたin vitro試験でモダフィニルはCYP1A2、CYP2B6及びCYP3A4を濃度依存的に誘導することが認められた。ヒト肝実質細胞を用いたin vitro試験でモダフィニルはCYP2C9活性を濃度依存的に阻害することが認められた。ヒト肝ミクロソームを用いたin vitro試験でモダフィニル及び代謝物であるスルホン体は可逆的にCYP2C19を阻害することが認められた7)。
16.5 排泄
健康成人男性6例(外国人)に、14C-モダフィニル200mgを単回経口投与したとき、投与量の約80%が投与11日までの尿中に排泄された。糞中は1%であった。血漿及び尿中の主たる代謝物はモダフィニルアシッドであった。未変化体として排泄される量は投与量の10%未満である6)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者における薬物動態
16.6.2 肝機能障害患者における薬物動態
16.6.3 高齢者における薬物動態
健康高齢男性(外国人)6例に、モダフィニル200mgを単回経口投与したとき、非高齢男性(外国人)に比し、クリアランスの低下及びCmax、AUC0-∞の増加が認められたが、他の薬物動態パラメータに差は認められなかった10)。[9.8参照]
| 平均年齢 | n | Cmax(μg/mL) | Tmax(hr) | T1/2(hr) | AUC0-∞(μg・hr/mL) | CL/F(mL/min) | Vd/F(L) | |
| 非高齢男性 | 29 | 12 | 4.21±0.44 | 2.0±1.0 | 12.7±3.2 | 57.0±7.6 | 59.5±9.3 | 64.1±11.9 |
| 高齢男性 | 68 | 6 | 4.90±0.84* | 1.7±0.8 | 14.6±3.8 | 69.7±11.1* | 49.0±8.7* | 60.0±8.8 |
16.7 薬物相互作用
16.7.1 メチルフェニデート塩酸塩
健康成人男性(外国人)を対象としたモダフィニル(200mg)とメチルフェニデート塩酸塩(40mg)の単回経口投与による併用試験の結果、モダフィニルのTmaxが約1時間延長した以外、両剤の薬物動態に有意な変化は認められなかった11)。
16.7.2 クロミプラミン
健康成人男性(外国人)を対象にモダフィニル(200mg/日)を3日間投与し、その1日目にクロミプラミン(50mg)を単回併用したところ、両剤の薬物動態に有意な変化は認められなかったが、CYP2D6が欠損したナルコレプシー患者(外国人)1例でクロミプラミン及び代謝物デスメチルクロミプラミン血中濃度の上昇が認められたとの報告がある。これは、クロミプラミンの主たる代謝経路はCYP2D6で、副次的な代謝経路はCYP2C19によるN-脱メチル化であり、CYP2D6の欠損者ではCYP2C19によるクロミプラミンの代謝の寄与が大きくなる。モダフィニルの併用投与によりCYP2C19が阻害され、その結果として血漿中クロミプラミン及びその活性代謝物が上昇したと考えられる12)13)。
16.7.3 エチニルエストラジオール・ノルゲスチメート合剤及びトリアゾラム
16.7.4 シクロスポリン
17. 臨床成績
17.1 有効性及び安全性に関する試験
<ナルコレプシー>
17.1.1 国内第III相試験
(1)プラセボ対照無作為化二重盲検並行群間比較試験
ナルコレプシー患者95例を対象にモダフィニル200mg又はプラセボを1日1回3週間投与した結果、有効性の主要評価項目である覚醒維持検査(MWT)による平均睡眠潜時の投与前からの変化量は下表のとおりであり、プラセボ群と比較してモダフィニル群で統計学的に有意な延長が認められた。また、副次的な評価項目である日中の過度の眠気(EDS)の回数、総時間及びエプワース眠気尺度(ESS)の合計スコアはプラセボ群と比較してモダフィニル群で有意な改善が認められた。
副作用発現頻度はモダフィニル群で57.8%(26/45例)、プラセボ群で46.0%(23/50例)であり、モダフィニル群の主な副作用は頭痛37.8%(17/45例)、動悸13.3%(6/45例)、口渇8.9%(4/45例)、筋骨格硬直6.7%(3/45例)であった16)。
副作用発現頻度はモダフィニル群で57.8%(26/45例)、プラセボ群で46.0%(23/50例)であり、モダフィニル群の主な副作用は頭痛37.8%(17/45例)、動悸13.3%(6/45例)、口渇8.9%(4/45例)、筋骨格硬直6.7%(3/45例)であった16)。
| 投与群 | MWT平均睡眠潜時a) | ベースラインからの変化量b,c) | プラセボとの対比較c) | |
| ベースライン | 最終評価時 | 差 [95%信頼区間] p値 | ||
| プラセボ群 (例数) | 4.66±3.76 (n=50) | 4.00±4.01 (n=48) | −0.72±0.53 (n=48) | 3.22 [1.67,4.77] <0.001 |
| モダフィニル群 (例数) | 4.45±3.25 (n=45) | 6.84±5.44 (n=41) | 2.50±0.57 (n=41) | |
(2)長期投与試験
ナルコレプシー患者63例を対象にモダフィニル100〜300mgを1日1回52週間投与した結果、モダフィニルは日中の過度の眠気(EDS)の回数、総時間及びエプワース眠気尺度(ESS)の合計スコアを投与前に比し有意に改善し、その効果は52週間にわたり維持された。
副作用発現頻度は90.5%(57/63例)であり、主な副作用は口渇38.1%(24/63例)、頭痛23.8%(15/63例)、不眠症、腹部不快感各9.5%(6/63例)、傾眠7.9%(5/63例)であった17)。
副作用発現頻度は90.5%(57/63例)であり、主な副作用は口渇38.1%(24/63例)、頭痛23.8%(15/63例)、不眠症、腹部不快感各9.5%(6/63例)、傾眠7.9%(5/63例)であった17)。
<特発性過眠症>
17.1.2 国内第III相試験
(1)プラセボ対照無作為化二重盲検並行群間比較試験
特発性過眠症患者71例を対象にモダフィニル200mg又はプラセボを1日1回3週間投与した結果、主要評価項目である覚醒維持検査(MWT)平均睡眠潜時の投与前からの変化量は下表のとおりであり、プラセボ群と比較してモダフィニル群で統計学的に有意な延長が認められた。また、副次的な評価項目である日本語版エプワース眠気尺度(JESS)の合計スコアはプラセボ群と比較してモダフィニル群で有意な減少が認められ、また、全般改善度(CGI-C)の有効例(軽度改善以上)の割合はプラセボ群と比較してモダフィニル群で有意に高かった。
副作用発現頻度はモダフィニル群で47.1%(16/34例)、プラセボ群で13.5%(5/37例)であり、モダフィニル群の主な副作用は頭痛17.6%(6/34例)、口渇、悪心各8.8%(3/34例)、食欲減退5.9%(2/34例)であった18)。
副作用発現頻度はモダフィニル群で47.1%(16/34例)、プラセボ群で13.5%(5/37例)であり、モダフィニル群の主な副作用は頭痛17.6%(6/34例)、口渇、悪心各8.8%(3/34例)、食欲減退5.9%(2/34例)であった18)。
| 投与群 | MWT平均睡眠潜時a) | ベースラインからの変化量b,c) | プラセボとの対比較c) | |
| ベースライン | 最終評価時 | 差 [95%信頼区間] p値 | ||
| プラセボ群 (例数) | 7.91±5.29 (n=37) | 6.46±5.35 (n=37) | −1.42±0.60 (n=37) | 5.02 [3.26,6.77] <0.001 |
| モダフィニル群 (例数) | 8.05±5.11 (n=34) | 11.32±4.71 (n=33) | 3.60±0.64 (n=33) | |
(2)長期投与試験
特発性過眠症患者57例を対象にモダフィニル100〜300mgを1日1回52週間投与した結果、日本語版エプワース眠気尺度(JESS)の合計スコアは投与後1週より減少し、以降ほぼ一定に推移した。また、全般改善度(CGI-C)の有効率(軽度改善以上)は52週時において100.0%(47/47例)であった。
副作用発現頻度は77.2%(44/57例)であり、主な副作用は頭痛29.8%(17/57例)、体重減少28.1%(16/57例)、口渇12.3%(7/57例)、動悸10.5%(6/57例)、悪心8.8%(5/57例)、初期不眠症、心拍数増加各7.0%(4/57例)、倦怠感、不安、浮動性めまい、頻脈、食欲減退、血圧上昇各5.3%(3/57例)であった19)。
副作用発現頻度は77.2%(44/57例)であり、主な副作用は頭痛29.8%(17/57例)、体重減少28.1%(16/57例)、口渇12.3%(7/57例)、動悸10.5%(6/57例)、悪心8.8%(5/57例)、初期不眠症、心拍数増加各7.0%(4/57例)、倦怠感、不安、浮動性めまい、頻脈、食欲減退、血圧上昇各5.3%(3/57例)であった19)。
<閉塞性睡眠時無呼吸症候群>
17.1.3 国内第III相試験
(1)プラセボ対照無作為化二重盲検並行群間比較試験
CPAP療法を3ヵ月以上実施しているにもかかわらず眠気が残存する(エプワース眠気尺度(ESS)合計スコア11点以上)閉塞性睡眠時無呼吸症候群患者114例を対象に、モダフィニル200mg又はプラセボを1日1回4週間投与した結果、主要評価項目であるエプワース眠気尺度(ESS)の合計スコアの投与前からの変化量は下表のとおりであり、プラセボ群と比較してモダフィニル群で統計学的に有意な減少が認められた。
副作用発現頻度はモダフィニル群で36.5%(19/52例)、プラセボ群で22.6%(14/62例)であり、モダフィニル群の主な副作用は頭痛11.5%(6/52例)、不眠症、動悸各3.8%(2/52例)であった20)21)。
副作用発現頻度はモダフィニル群で36.5%(19/52例)、プラセボ群で22.6%(14/62例)であり、モダフィニル群の主な副作用は頭痛11.5%(6/52例)、不眠症、動悸各3.8%(2/52例)であった20)21)。
| 投与群 | ESS合計スコアa) | ベースラインからの変化量b,c) | プラセボとの対比較c) | |
| ベースライン | 最終評価時 | 差 [95%信頼区間] p値 | ||
| プラセボ群 (例数) | 14.60±3.12 (n=62) | 12.08±3.93 (n=62) | −2.44±0.51 (n=62) | −4.17 [−5.66,−2.69] <0.001 |
| モダフィニル群 (例数) | 14.27±2.67 (n=52) | 7.75±4.52 (n=52) | −6.61±0.55 (n=52) | |
(2)長期投与試験
CPAP療法を実施中の閉塞性睡眠時無呼吸症候群患者114例を対象にモダフィニル100〜300mgを1日1回52週間投与した結果、エプワース眠気尺度(ESS)の合計スコアの推移は下表のとおりであった。
副作用発現頻度は52.6%(60/114例)であり、主な副作用は頭痛16.7%(19/114例)、動悸3.5%(4/114例)であった22)。
副作用発現頻度は52.6%(60/114例)であり、主な副作用は頭痛16.7%(19/114例)、動悸3.5%(4/114例)であった22)。
| 評価時期 | 例数 | ESS合計スコア | 変化量 |
| ベースライン | 114 | 14.71±2.75 | − |
| 1週 | 114 | 8.94±4.67 | −5.77±5.12 |
| 4週 | 112 | 8.84±4.23 | −5.88±4.71 |
| 12週 | 106 | 8.03±4.27 | −6.77±4.51 |
| 24週 | 103 | 7.11±4.07 | −7.67±4.38 |
| 52週 | 97 | 6.66±3.86 | −7.96±4.21 |
| 最終評価時 | 114 | 7.15±4.06 | −7.56±4.45 |
18. 薬効薬理
18.1 作用機序
18.2 覚醒促進作用
19. 有効成分に関する理化学的知見
19.1. モダフィニル
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
21.2 特発性過眠症について、国内での治験症例が極めて限られていることから、製造販売後、一定数の症例に係るデータが集積されるまでの間は、全症例を対象に使用成績調査を実施することにより、本剤の使用患者の背景情報を把握するとともに、本剤の安全性及び有効性に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
21.3 本剤が、睡眠障害の診断、治療に精通した医師・医療機関のもとでのみ処方されるとともに、薬局においては調剤前に当該医師・医療機関を確認した上で調剤がなされるよう、製造販売にあたって必要な措置を講じること。なお、令和3年3月31日までは従前の例によることができる。
22. 包装
100錠[10錠(PTP)×10]
23. 主要文献
- 厚生労働省:重篤副作用疾患別対応マニュアル 薬剤性過敏症症候群
- 社内資料:国内第I相単回投与時の薬物動態に関する資料(2007年1月26日承認、CTD2.7.6.9)
- 社内資料:国内第I相反復投与時の薬物動態に関する資料(2007年1月26日承認、CTD2.7.6.10)
- 社内資料:国内第I相食事による影響の検討に関する資料(2007年1月26日承認、CTD2.7.6.1)
- 社内資料:反復経口投与時の薬物動態に関する資料(2007年1月26日承認、CTD2.7.6.7)
- 社内資料:ヒトにおける代謝及び排泄の検討に関する資料(2007年1月26日承認、CTD2.7.6.8)
- Robertson,P.et al., Drug Metab Dispos., 28, 664-671, (2000) »PubMed
- 社内資料:腎機能障害患者における薬物動態に関する資料(2007年1月26日承認、CTD2.7.6.15)
- 社内資料:肝機能障害患者における薬物動態に関する資料(2007年1月26日承認、CTD.2.7.6.16)
- 社内資料:高齢者における薬物動態に関する資料(2007年1月26日承認、CTD2.7.6.17)
- Wong,YN.et al., J Clin Pharmacol., 38, 276-282, (1998) »PubMed
- 社内資料:クロミプラミン併用時の薬物動態に関する資料(2007年1月26日承認、CTD2.7.6.21)
- Groezinger,M.et al., Clin Neuropharmacol., 21, 127-129, (1998)
- Robertson,P.et al., Clin Pharmacol Ther., 71, 46-56, (2002) »PubMed
- Le Cacheux,P.et al., Presse Med., 26, 466, (1997) »PubMed
- 井上雄一 他, 睡眠医療, 1, 85-97, (2007)
- 井上雄一 他, 臨床精神薬理, 14, 479-491, (2011)
- 社内資料:特発性過眠症を対象とした国内第III相D.B.試験(2020年2月21日承認、CTD2.7.6.1)
- 社内資料:特発性過眠症を対象とした国内第III相長期投与試験(2020年2月21日承認、CTD2.7.6.4)
- Inoue,Y.et al., J Clin Sleep Med., 9, 751-757, (2013) »PubMed
- 社内資料:閉塞性睡眠時無呼吸症候群を対象とした国内第III相D.B.試験(2011年11月25日承認、CTD2.7.6.1)
- 社内資料:閉塞性睡眠時無呼吸症候群を対象とした国内第III相長期投与試験(2011年11月25日承認、CTD2.7.6.9)
- Lin,JS.et al., Proc Natl Acad Sci U S A., 93, 14128-14133, (1996) »PubMed
- Tanganelli,S.et al., Naunyn Schmiedebergs Arch Pharmacol., 345, 461-465, (1992) »PubMed
- Ferraro,L.et al., Neurosci Lett., 220, 5-8, (1996) »PubMed
- Ferraro,L.et al., Eur J Pharmacol., 306, 33-39, (1996) »PubMed
- Ishizuka,T.et al., Neurosci Lett., 339, 143-146, (2003) »PubMed
- Ishizuka,T.et al., Eur J Pharmacol., 578, 209-215, (2008) »PubMed
- 社内資料:神経伝達物質受容体等に対する親和性の検討に関する資料(2007年1月26日承認、CTD2.6.2.2.2)
- 社内資料:トランスポーターに対する親和性の検討に関する資料(2007年1月26日承認、CTD2.6.2.2.2)
- Shelton,J.et al., Sleep., 18, 817-826, (1995) »PubMed
- Edgar,DM.et al., J Pharmacol Exp Ther., 283, 757-769, (1997) »PubMed
- Panckeri,KA.et al., Sleep., 19, 626-631, (1996) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
田辺ファーマ株式会社
くすり相談センター
〒541-8505
大阪市中央区道修町3-2-10
電話:0120-753-280
製品情報問い合わせ先
田辺ファーマ株式会社
くすり相談センター
〒541-8505
大阪市中央区道修町3-2-10
電話:0120-753-280
25. 保険給付上の注意
25.1 投薬期間制限医薬品に関する情報
本剤は厚生労働省告示第42号(平成30年3月5日付)に基づき、投薬は1回30日分を限度とされています。
26. 製造販売業者等
26.1 製造販売元
アルフレッサファーマ株式会社
大阪市中央区石町二丁目2番9号
26.2 販売元
田辺ファーマ株式会社
大阪市中央区道修町3-2-10
26.3 提携先
Cephalon