医薬品情報
| 総称名 | セフジトレンピボキシル |
|---|---|
| 一般名 | セフジトレン ピボキシル |
| 欧文一般名 | Cefditoren Pivoxil |
| 薬効分類名 | 経口用セフェム系抗生物質製剤 |
| 薬効分類番号 | 6132 |
| ATCコード | J01DD16 |
| KEGG DRUG |
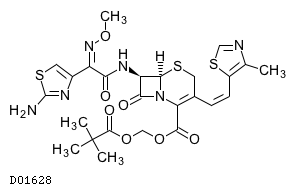
D01628
セフジトレンピボキシル
|
| KEGG DGROUP |
DG01488
セフェム系抗生物質
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年9月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| セフジトレンピボキシル錠100mg「CH」 | Cefditoren Pivoxil Tablets | 長生堂製薬 | 6132015F1045 | 56.6円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
<適応菌種>
<適応症>
5. 効能または効果に関連する注意
<咽頭・喉頭炎、扁桃炎(扁桃周囲炎、扁桃周囲膿瘍を含む)、急性気管支炎、中耳炎、副鼻腔炎>
「抗微生物薬適正使用の手引き」1)を参照し、抗菌薬投与の必要性を判断した上で、本剤の投与が適切と判断される場合に投与すること。
6. 用法及び用量
通常、成人にはセフジトレン ピボキシルとして1回100mg(力価)を1日3回食後に経口投与する。
なお、年齢及び症状に応じて適宜増減するが、重症又は効果不十分と思われる場合は、1回200mg(力価)を1日3回食後に経口投与する。
なお、年齢及び症状に応じて適宜増減するが、重症又は効果不十分と思われる場合は、1回200mg(力価)を1日3回食後に経口投与する。
8. 重要な基本的注意
8.1 本剤の使用にあたっては、耐性菌の発現等を防ぐため、原則として感受性を確認し、疾病の治療上必要な最小限の期間の投与にとどめること。
8.2 ショックを起こすおそれがあるので、十分な問診を行うこと。[11.1.1参照]
8.3 肝機能障害があらわれることがあるので、定期的に検査を行うこと。[11.1.5参照]
8.4 急性腎障害等の重篤な腎障害があらわれることがあるので、定期的に検査を行うこと。[11.1.6参照]
8.5 無顆粒球症、溶血性貧血があらわれることがあるので、定期的に検査を行うこと。[11.1.7参照]
8.6 投与期間が長い患者では、臨床検査値異常(AST、ALT上昇、好酸球増多等)の発現率が高くなる傾向がみられるため、定期的に検査を行うなど注意すること。[11.2参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 セフェム系又はペニシリン系抗生物質に対し過敏症の既往歴のある患者(ただし、本剤に対し過敏症の既往歴のある患者には投与しないこと)
9.1.2 本人又は両親、兄弟に気管支喘息、発疹、蕁麻疹等のアレルギー症状を起こしやすい体質を有する患者
9.1.3 経口摂取の不良な患者又は非経口栄養の患者、全身状態の悪い患者
観察を十分に行うこと。ビタミンK欠乏症状があらわれることがある。
9.2 腎機能障害患者
9.2.1 高度の腎障害のある患者
投与間隔をあけて使用すること。血中濃度が持続する。[16.6.1参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。妊娠後期にピボキシル基を有する抗生物質を投与された妊婦と、その出生児において低カルニチン血症の発現が報告されている。
9.7 小児等
9.7.1 小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.7.2 カルニチンの低下に注意すること。血清カルニチンが低下する先天性代謝異常であることが判明した場合には投与しないこと。小児(特に乳幼児)においてピボキシル基を有する抗生物質(小児用製剤)の投与により、低カルニチン血症に伴う低血糖があらわれることがある。[15.1参照]
9.8 高齢者
次の点に注意して、投与間隔を変更するなどして投与すること。高齢者とそれ以外の成人では副作用に差がみられなかったが、一般に生理機能が低下していることが多い。
・本剤は腎機能低下患者で排泄に遅延が認められているので、血中濃度が高く推移する可能性がある。[16.6.1参照]
・類薬で、ビタミンK欠乏による出血傾向があらわれるとの報告がある。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
不快感、口内異常感、喘鳴、眩暈、便意、耳鳴、発汗等の異常が認められた場合には、投与を中止し、適切な処置を行うこと。[8.2参照]
11.1.2 偽膜性大腸炎等の血便を伴う重篤な大腸炎(頻度不明)
腹痛、頻回の下痢があらわれた場合には、直ちに投与を中止し、適切な処置を行うこと。
11.1.3 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)、多形紅斑(いずれも頻度不明)
11.1.4 間質性肺炎、PIE症候群(いずれも頻度不明)
発熱、咳嗽、呼吸困難、胸部X線像異常、好酸球増多等を伴う間質性肺炎、PIE症候群等があらわれることがあるので、観察を十分に行い、このような症状があらわれた場合には、投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.5 肝機能障害(頻度不明)
黄疸、AST、ALT、Al-Pの著しい上昇等を伴う肝機能障害があらわれることがある。[8.3参照]
11.1.6 急性腎障害等の重篤な腎障害(頻度不明)[8.4参照]
11.1.7 無顆粒球症、溶血性貧血(いずれも頻度不明)[8.5参照]
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | 発疹 | 蕁麻疹、紅斑、そう痒、発熱 | リンパ節腫脹、関節痛 |
| 血液 | 顆粒球減少、好酸球増多注) | 血小板減少 | |
| 肝臓 | AST、ALT、Al-Pの上昇注) | 黄疸 | |
| 腎臓 | BUN上昇、蛋白尿 | 血中クレアチニン上昇 | |
| 消化器 | 下痢、軟便、嘔気、胃不快感、腹痛 | 腹部膨満感、悪心、嘔吐 | |
| 菌交代症 | 口内炎 | カンジダ症 | |
| ビタミン欠乏症 | ビタミンK欠乏症状(低プロトロンビン血症、出血傾向等)、ビタミンB群欠乏症状(舌炎、口内炎、食欲不振、神経炎等) | ||
| その他 | 頭痛、めまい | 浮腫、しびれ、血清カルニチン低下 |
12. 臨床検査結果に及ぼす影響
12.1 テステープ反応を除くベネディクト試薬、フェーリング試薬による尿糖検査では偽陽性を呈することがあるので注意すること。
12.2 直接クームス試験陽性を呈することがあるので注意すること。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
本剤を含むピボキシル基を有する抗生物質(セフジトレン ピボキシル、セフカペン ピボキシル塩酸塩水和物、セフテラム ピボキシル、テビペネム ピボキシル)の投与により、ピバリン酸(ピボキシル基を有する抗生物質の代謝物)の代謝・排泄に伴う血清カルニチン低下が報告されている。[9.7.2参照]
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人に1回100mg、200mgをそれぞれ食後単回経口投与した場合、セフジトレンの薬物動態パラメータは、表1のとおりであり、用量依存性を示した2)。
| 投与量(mg) | Tmax(hr) | Cmax(μg/mL) | T1/2(hr) | AUC0→∞(μg・hr/mL) |
| 100 | 1.4 | 1.66 | 0.80 | 3.67 |
| 200 | 2.0 | 3.44 | 1.06 | 10.02 |
16.1.2 生物学的同等性試験
セフジトレンピボキシル錠100mg「CH」とメイアクト錠100を、クロスオーバー法によりそれぞれ1錠(セフジトレン ピボキシルとして100mg(力価))健康成人男子に空腹時単回経口投与して血漿中セフジトレン濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された3)。
| 判定パラメータ | 参考パラメータ | |||
| AUC0-8(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | t1/2(hr) | |
| セフジトレンピボキシル錠100mg「CH」 | 3551.6±973.0 | 1204.7±334.2 | 1.4±0.3 | 1.5±0.2 |
| メイアクト錠100 | 3696.4±1114.5 | 1257.4±308.9 | 1.4±0.4 | 1.5±0.2 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2 吸収
16.3 分布
16.4 代謝
16.5 排泄
16.5.1 尿中排泄
健康成人に1回100mg、200mgをそれぞれ食後単回経口投与した場合、セフジトレンとしての尿中排泄率(0〜24時間)は約20%であった。なお、健康成人に1回200mg、1日3回8日間反復投与した場合、蓄積性は認められなかった2)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
腎機能障害患者及び人工透析導入患者(いずれも成人)に200mgを食後単回経口投与した場合、セフジトレンの血清中濃度・薬物動態パラメータは、図1・表2のとおりであり、いずれの場合も高値で推移し、腎機能の障害の程度に応じたT1/2の遅延が認められた。また、尿中排泄率は腎機能の障害の程度が大きくなるにつれて低下し、排泄の遅延が認められた16)。[9.2.1、9.8参照]
図1 腎機能障害患者におけるセフジトレンの血清中濃度
| 患者条件〔Ccr(mL/min)〕 | 例数 | Tmax(hr) | Cmax(μg/mL) | T1/2(hr) | AUC0→∞(μg・hr/mL) |
| 軽度〔51〜70〕 | 3 | 2 | 2.32 | 1.13 | 10.2 |
| 中等度〔30〜50〕 | 4 | 4 | 2.17 | 2.06 | 16.4 |
| 高度〔<30〕 | 2 | 8 | 3.70 | 5.68 | 53.5 |
| 透析患者※ | 1 | 6 | 4.60 | 5.37 | 50.2 |
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内用量設定試験(慢性気管支炎)
1回100mg又は200mgを1日3回14日間食後投与した。その結果、有効率は300mg群91.7%(33/36)、600mg群88.6%(31/35)であった。副作用は300mg群で嘔気・上腹部痛1件(2.6%)が報告された17)。
17.1.2 国内用量設定試験(複雑性尿路感染症)
1回100mg又は200mgを1日3回5日間食後投与した。その結果、有効率は300mg群75.0%(36/48)、600mg群76.6%(36/47)であった。副作用は300mg群でめまい・冷感、胃のもたれ、胃痛、めまい、600mg群で下痢各1件(1.5%)が報告された18)。
17.1.3 国内二重盲検試験(複雑性尿路感染症)
1回100mgを1日3回5日間食後投与した。その結果、有効率は78.6%(77/98)であった。副作用は下痢2件(1.5%)、胃痛、軟便各1件(0.7%)が報告された19)。
17.1.4 国内二重盲検試験(細菌性肺炎)
1回100mgを1日3回14日間食後投与した。その結果、有効率は89.9%(62/69)であった。副作用は下痢3件(3.4%)、発疹、嘔気(悪心)各2件(2.3%)、胃部不快感・下痢1件(1.1%)が報告された20)。
17.1.5 国内二重盲検試験(慢性気道感染症)
1回200mgを1日3回14日間食後投与した。その結果、有効率は85.9%(73/85)であった。副作用は下痢3件(3.1%)、発疹・掻痒感、発熱、嘔気、胃部不快感、軟便、便秘各1件(1.0%)が報告された21)。
17.1.6 国内二重盲検試験(浅在性化膿性疾患)
1回200mgを1日3回7日間食後投与した。その結果、有効率は97.3%(71/73)であった。副作用は軟便2件(2.6%)、胃のもたれ、胃部不快感・軟便、嘔気・軟便、腹部膨満感、胃部不快感、嘔気、水様便各1件(1.3%)が報告された22)。
18. 薬効薬理
18.1 作用機序
18.2 抗菌作用
18.2.1 セフジトレン ピボキシルは、吸収時に腸管壁で代謝を受けてセフジトレンとなり、抗菌力を示す25)。
18.3 実験的感染症に対する治療効果
19. 有効成分に関する理化学的知見
19.1. セフジトレン ピボキシル
20. 取扱い上の注意
アルミピロー包装開封後は、湿気を避けて保存すること。
22. 包装
100錠[10錠(PTP)×10、乾燥剤入り]
23. 主要文献
- 厚生労働省健康局結核感染症課編:抗微生物薬適正使用の手引き
- 島田 馨ほか, Chemotherapy., 40 (S-2), 105-119, (1992) »DOI
- 社内資料:生物学的同等性試験
- 齋藤 玲ほか, Chemotherapy., 40 (S-2), 308-315, (1992) »DOI
- 高橋 淳ほか, Chemotherapy., 40 (S-2), 434-445, (1992) »DOI
- 馬場駿吉ほか, 耳鼻と臨床, 38 (5), 663-680, (1992) »DOI
- 西園浩文ほか, Chemotherapy., 40 (S-2), 643-650, (1992) »DOI
- 秋山尚範ほか, Chemotherapy., 40 (S-2), 619-623, (1992) »DOI
- 谷村 弘ほか, Chemotherapy., 40 (S-2), 573-581, (1992) »DOI
- 保田仁介ほか, Chemotherapy., 40 (S-2), 610-613, (1992) »DOI
- 由良二郎ほか, Chemotherapy., 41 (1), 24-40, (1993) »DOI
- 大石正夫ほか, Chemotherapy., 40 (S-2), 651-659, (1992) »DOI
- 佐々木次郎ほか, Chemotherapy., 40 (S-2), 664-672, (1992) »DOI
- 松元 隆ほか, Chemotherapy., 40 (S-2), 120-130, (1992) »DOI
- 柴 孝也ほか, Chemotherapy., 40 (11), 1310-1319, (1992) »DOI
- 青木信樹ほか, Chemotherapy., 40 (S-2), 371-381, (1992) »DOI
- 柴 孝也ほか, Chemotherapy., 40 (S-2), 459-478, (1992) »DOI
- 荒川創一ほか, Chemotherapy., 40 (S-2), 543-558, (1992) »DOI
- 荒川創一ほか, 西日本泌尿器科, 54 (8), 1418-1434, (1992)
- 柴 孝也ほか, Chemotherapy., 40 (12), 1472-1498, (1992) »DOI
- 柴 孝也ほか, Chemotherapy., 40 (12), 1499-1528, (1992) »DOI
- 荒田次郎ほか, Chemotherapy., 41 (1), 57-77, (1993) »DOI
- 横田 健ほか, Chemotherapy., 40 (S-2), 7-15, (1992) »DOI
- 西野武志ほか, Chemotherapy., 40 (S-2), 37-50, (1992) »DOI
- 河原條勝己ほか, Chemotherapy., 40 (S-2), 51-58, (1992) »DOI
- 五島瑳智子ほか, Chemotherapy., 40 (S-2), 16-29, (1992) »DOI
- 渡辺邦友ほか, Chemotherapy., 40 (S-2), 30-36, (1992) »DOI
- 田村 淳ほか, Chemotherapy., 40 (S-2), 1-6, (1992) »DOI
- 生方公子ほか, 日本化学療法学会雑誌, 50 (11), 794-804, (2002) »DOI
24. 文献請求先及び問い合わせ先
文献請求先
日本ジェネリック株式会社
お客さま相談室
〒108-0014
東京都港区芝五丁目33番11号
電話:0120-893-170
FAX:0120-893-172
製品情報問い合わせ先
日本ジェネリック株式会社
お客さま相談室
〒108-0014
東京都港区芝五丁目33番11号
電話:0120-893-170
FAX:0120-893-172
26. 製造販売業者等
26.1 製造販売元
長生堂製薬株式会社
徳島市国府町府中92番地
26.2 販売元
日本ジェネリック株式会社
東京都港区芝五丁目33番11号