医薬品情報
| 総称名 | エフピー |
|---|---|
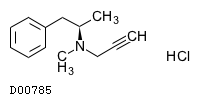
| 一般名 | セレギリン塩酸塩 |
| 欧文一般名 | Selegiline hydrochloride |
| 製剤名 | セレギリン塩酸塩口腔内崩壊錠 |
| 薬効分類名 | パーキンソン病治療剤(選択的MAO-B阻害剤) |
| 薬効分類番号 | 1169 |
| ATCコード | N04BD01 |
| KEGG DRUG |
D00785
セレギリン塩酸塩
|
| KEGG DGROUP |
DG01967
抗パーキンソン病薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年2月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| エフピーOD錠2.5 | FP-OD TABLETS | エフピー | 1169010F2020 | 260.9円/錠 | 劇薬, 覚醒剤原料, 処方箋医薬品注) |
1. 警告
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 ペチジン塩酸塩含有製剤、トラマドール塩酸塩又はタペンタドール塩酸塩を投与中の患者[10.1参照]
2.3 他の選択的MAO-B阻害剤(ラサギリンメシル酸塩及びサフィナミドメシル酸塩)を投与中の患者[10.1参照]
2.4 統合失調症又はその既往歴のある患者[精神症状の悪化が報告されている。]
2.5 覚醒剤、コカイン等の中枢興奮薬の依存又はその既往歴のある患者
2.7 選択的セロトニン再取り込み阻害剤(フルボキサミンマレイン酸塩等)、セロトニン再取り込み阻害・セロトニン受容体調節剤(ボルチオキセチン臭化水素酸塩)、ノルアドレナリン・セロトニン作動性抗うつ剤(ミルタザピン)、セロトニン・ノルアドレナリン再取り込み阻害剤(ミルナシプラン塩酸塩等)、選択的ノルアドレナリン再取り込み阻害剤(アトモキセチン塩酸塩)、マジンドール、メタンフェタミン塩酸塩又はリスデキサンフェタミンメシル酸塩を投与中の患者[10.1参照]
4. 効能または効果
パーキンソン病(レボドパ含有製剤を併用する場合:Yahr重症度ステージI〜IV、レボドパ含有製剤を併用しない場合:Yahr重症度ステージI〜III)
6. 用法及び用量
<レボドパ含有製剤を併用する場合>
通常、成人にセレギリン塩酸塩として1日1回2.5mgを朝食後服用から始め、2週ごとに1日量として2.5mgずつ増量し、最適投与量を定めて、維持量とする(標準維持量1日7.5mg)。1日量がセレギリン塩酸塩として5.0mg以上の場合は朝食及び昼食後に分服する。ただし、7.5mgの場合は朝食後5.0mg及び昼食後2.5mgを服用する。
なお、年齢、症状に応じて適宜増減するが1日10mgを超えないこととする。
なお、年齢、症状に応じて適宜増減するが1日10mgを超えないこととする。
<レボドパ含有製剤を併用しない場合>
通常、成人にセレギリン塩酸塩として1日1回2.5mgを朝食後服用から始め、2週ごとに1日量として2.5mgずつ増量し、1日10mgとする。1日量がセレギリン塩酸塩として5.0mg以上の場合は朝食及び昼食後に分服する。ただし、7.5mgの場合は朝食後5.0mg及び昼食後2.5mgを服用する。
なお、年齢、症状に応じて適宜増減するが1日10mgを超えないこととする。
なお、年齢、症状に応じて適宜増減するが1日10mgを超えないこととする。
7. 用法及び用量に関連する注意
レボドパ含有製剤投与中の患者に本剤の投与を開始する場合、及び本剤投与中の患者にレボドパ含有製剤の投与を開始する場合には、レボドパ含有製剤と本剤の併用によりレボドパの副作用が増強されることがあるので、観察を十分に行い慎重に維持量を決定すること。維持量投与後、レボドパと本剤との併用効果と思われる不随意運動、幻覚、妄想等があらわれた場合には、本剤又はレボドパの減量等適切に処置を行うこと。なお、本剤又はレボドパの減量を行う際には、本剤のMAO-B阻害作用が長期間持続して効果の減弱に時間を要することも考慮すること。[18.2参照]
8. 重要な基本的注意
8.1 本剤の投与中は、定期的に効果が持続していることを確認し、効果が消失している場合は使用を中止し、漫然と投与しないこと。
8.2 めまい、注意力・集中力・反射機能等の低下が起こることがあるので、自動車の運転、機械の操作、高所作業等危険を伴う作業に従事させないように注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 高用量のレボドパ投与を受けている患者
副作用発現率が高い。
9.1.2 心・脳循環器系障害を有する患者
英国において、レボドパ単独群とセレギリン塩酸塩投与後にレボドパを併用投与した群を比較した試験1)において、レボドパ単独群に対してセレギリン塩酸塩投与後にレボドパ併用投与した群に心・脳循環器系障害による死亡が多かったと報告されている。
9.1.3 狭心症のある患者
心電図をモニターするなど、特に注意すること。本剤により増悪するおそれがある。[11.1.2参照]
9.2 腎機能障害患者
9.2.1 重篤な腎障害のある患者
本剤の代謝物が蓄積され、その代謝物による中枢作用が生じるおそれがある。
9.3 肝機能障害患者
9.3.1 重篤な肝障害のある患者
本剤の代謝が抑制され、毒性が大幅に増強されるおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。ラットにおいて胎盤通過が認められている2)。
9.6 授乳婦
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
増量にあたっては、血圧のモニタリングを行うなど、患者の状態を観察しながら、慎重に投与すること。起立性低血圧があらわれやすい。
10. 相互作用
相互作用序文
本剤はCYP2D6及びCYP3A4で代謝される。[16.4参照]
薬物代謝酵素用語
CYP2D6
薬物代謝酵素用語
CYP3A4
10.1 併用禁忌
| ペチジン塩酸塩含有製剤 ペチロルファン トラマドール塩酸塩 トラマール タペンタドール塩酸塩 タペンタ [2.2参照] | 高度の興奮、精神錯乱等の発現が報告されている。なお、本剤の投与を中止してからトラマドール塩酸塩及びタペンタドール塩酸塩の投与を開始するには少なくとも14日間の間隔を置くこと。またトラマドール塩酸塩から本剤に切り換える場合には2〜3日間の間隔を置くこと。 | 機序は不明である。 |
| 選択的MAO-B阻害剤 ラサギリンメシル酸塩 アジレクト サフィナミドメシル酸塩 エクフィナ [2.3参照] | 高血圧クリーゼ及びセロトニン症候群等の重篤な副作用発現のおそれがある。本剤の投与を中止してからラサギリンメシル酸塩及びサフィナミドメシル酸塩の投与を開始するまでに、少なくとも14日間の間隔を置くこと。また、ラサギリンメシル酸塩及びサフィナミドメシル酸塩の投与を中止してから本剤の投与を開始するまでに少なくとも14日間の間隔を置くこと。 | 相加作用のおそれがある。 |
| 三環系抗うつ剤 アミトリプチリン塩酸塩 トリプタノール アモキサピン アモキサン イミプラミン塩酸塩 トフラニール クロミプラミン塩酸塩 アナフラニール ドスレピン塩酸塩 プロチアデン トリミプラミンマレイン酸塩 スルモンチール ノルトリプチリン塩酸塩 ノリトレン ロフェプラミン塩酸塩 アンプリット [1.1、2.6参照] | 高血圧、失神、不全収縮、発汗、てんかん、動作・精神障害の変化及び筋強剛等の副作用があらわれ、更に三環系抗うつ剤との併用下において死亡例も報告されている。本剤の投与を中止してから三環系抗うつ剤及び四環系抗うつ剤の投与を開始するまでに、少なくとも14日間の間隔を置くこと。また、三環系抗うつ剤及び四環系抗うつ剤の投与を中止してから本剤の投与を開始するまでに、少なくとも2〜3日間の間隔を置くこと。 | 詳細は不明であるが、相加・相乗作用によると考えられる。 |
| 四環系抗うつ剤 マプロチリン塩酸塩 ルジオミール ミアンセリン塩酸塩 テトラミド セチプチリンマレイン酸塩 テシプール [2.6参照] | 高血圧、失神、不全収縮、発汗、てんかん、動作・精神障害の変化及び筋強剛等の副作用があらわれ、更に三環系抗うつ剤との併用下において死亡例も報告されている。本剤の投与を中止してから三環系抗うつ剤及び四環系抗うつ剤の投与を開始するまでに、少なくとも14日間の間隔を置くこと。また、三環系抗うつ剤及び四環系抗うつ剤の投与を中止してから本剤の投与を開始するまでに、少なくとも2〜3日間の間隔を置くこと。 | 詳細は不明であるが、相加・相乗作用によると考えられる。 |
| 選択的セロトニン再取り込み阻害剤 フルボキサミンマレイン酸塩 ルボックス デプロメール パロキセチン塩酸塩水和物 パキシル セルトラリン塩酸塩 ジェイゾロフト エスシタロプラムシュウ酸塩 レクサプロ [2.7参照] | 両薬剤の作用が増強される可能性があるので、本剤の投与を中止してから選択的セロトニン再取り込み阻害剤、セロトニン再取り込み阻害・セロトニン受容体調節剤、ノルアドレナリン・セロトニン作動性抗うつ剤、セロトニン・ノルアドレナリン再取り込み阻害剤、選択的ノルアドレナリン再取り込み阻害剤、マジンドール、メタンフェタミン塩酸塩及びリスデキサンフェタミンメシル酸塩の投与を開始するには少なくとも14日間の間隔を置くこと。 また本剤に切り換える場合にはミルナシプラン塩酸塩は2〜3日間、デュロキセチン塩酸塩は5日間、フルボキサミンマレイン酸塩及びベンラファキシン塩酸塩は7日間、パロキセチン塩酸塩水和物、セルトラリン塩酸塩、ボルチオキセチン臭化水素酸塩、アトモキセチン塩酸塩、ミルタザピン及びエスシタロプラムシュウ酸塩は14日間の間隔を置くこと。 | セロトニン再取り込み阻害作用があるため脳内セロトニン濃度が高まると考えられている。 |
| セロトニン再取り込み阻害・セロトニン受容体調節剤 ボルチオキセチン臭化水素酸塩 トリンテリックス [2.7参照] | 両薬剤の作用が増強される可能性があるので、本剤の投与を中止してから選択的セロトニン再取り込み阻害剤、セロトニン再取り込み阻害・セロトニン受容体調節剤、ノルアドレナリン・セロトニン作動性抗うつ剤、セロトニン・ノルアドレナリン再取り込み阻害剤、選択的ノルアドレナリン再取り込み阻害剤、マジンドール、メタンフェタミン塩酸塩及びリスデキサンフェタミンメシル酸塩の投与を開始するには少なくとも14日間の間隔を置くこと。 また本剤に切り換える場合にはミルナシプラン塩酸塩は2〜3日間、デュロキセチン塩酸塩は5日間、フルボキサミンマレイン酸塩及びベンラファキシン塩酸塩は7日間、パロキセチン塩酸塩水和物、セルトラリン塩酸塩、ボルチオキセチン臭化水素酸塩、アトモキセチン塩酸塩、ミルタザピン及びエスシタロプラムシュウ酸塩は14日間の間隔を置くこと。 | セロトニン再取り込み阻害作用があるため脳内セロトニン濃度が高まると考えられている。 |
| ノルアドレナリン・セロトニン作動性抗うつ剤 ミルタザピン レメロン リフレックス [2.7参照] | 両薬剤の作用が増強される可能性があるので、本剤の投与を中止してから選択的セロトニン再取り込み阻害剤、セロトニン再取り込み阻害・セロトニン受容体調節剤、ノルアドレナリン・セロトニン作動性抗うつ剤、セロトニン・ノルアドレナリン再取り込み阻害剤、選択的ノルアドレナリン再取り込み阻害剤、マジンドール、メタンフェタミン塩酸塩及びリスデキサンフェタミンメシル酸塩の投与を開始するには少なくとも14日間の間隔を置くこと。 また本剤に切り換える場合にはミルナシプラン塩酸塩は2〜3日間、デュロキセチン塩酸塩は5日間、フルボキサミンマレイン酸塩及びベンラファキシン塩酸塩は7日間、パロキセチン塩酸塩水和物、セルトラリン塩酸塩、ボルチオキセチン臭化水素酸塩、アトモキセチン塩酸塩、ミルタザピン及びエスシタロプラムシュウ酸塩は14日間の間隔を置くこと。 | 脳内ノルアドレナリン、セロトニンの神経伝達が高まると考えられている。 |
| セロトニン・ノルアドレナリン再取り込み阻害剤 ミルナシプラン塩酸塩 トレドミン デュロキセチン塩酸塩 サインバルタ ベンラファキシン塩酸塩 イフェクサー [2.7参照] | 両薬剤の作用が増強される可能性があるので、本剤の投与を中止してから選択的セロトニン再取り込み阻害剤、セロトニン再取り込み阻害・セロトニン受容体調節剤、ノルアドレナリン・セロトニン作動性抗うつ剤、セロトニン・ノルアドレナリン再取り込み阻害剤、選択的ノルアドレナリン再取り込み阻害剤、マジンドール、メタンフェタミン塩酸塩及びリスデキサンフェタミンメシル酸塩の投与を開始するには少なくとも14日間の間隔を置くこと。 また本剤に切り換える場合にはミルナシプラン塩酸塩は2〜3日間、デュロキセチン塩酸塩は5日間、フルボキサミンマレイン酸塩及びベンラファキシン塩酸塩は7日間、パロキセチン塩酸塩水和物、セルトラリン塩酸塩、ボルチオキセチン臭化水素酸塩、アトモキセチン塩酸塩、ミルタザピン及びエスシタロプラムシュウ酸塩は14日間の間隔を置くこと。 | 脳内モノアミン総量の増加が考えられている。 |
| 選択的ノルアドレナリン再取り込み阻害剤 アトモキセチン塩酸塩 ストラテラ [2.7参照] | 両薬剤の作用が増強される可能性があるので、本剤の投与を中止してから選択的セロトニン再取り込み阻害剤、セロトニン再取り込み阻害・セロトニン受容体調節剤、ノルアドレナリン・セロトニン作動性抗うつ剤、セロトニン・ノルアドレナリン再取り込み阻害剤、選択的ノルアドレナリン再取り込み阻害剤、マジンドール、メタンフェタミン塩酸塩及びリスデキサンフェタミンメシル酸塩の投与を開始するには少なくとも14日間の間隔を置くこと。 また本剤に切り換える場合にはミルナシプラン塩酸塩は2〜3日間、デュロキセチン塩酸塩は5日間、フルボキサミンマレイン酸塩及びベンラファキシン塩酸塩は7日間、パロキセチン塩酸塩水和物、セルトラリン塩酸塩、ボルチオキセチン臭化水素酸塩、アトモキセチン塩酸塩、ミルタザピン及びエスシタロプラムシュウ酸塩は14日間の間隔を置くこと。 | 脳内モノアミン総量の増加が考えられている。 |
| マジンドール サノレックス [2.7参照] | 両薬剤の作用が増強される可能性があるので、本剤の投与を中止してから選択的セロトニン再取り込み阻害剤、セロトニン再取り込み阻害・セロトニン受容体調節剤、ノルアドレナリン・セロトニン作動性抗うつ剤、セロトニン・ノルアドレナリン再取り込み阻害剤、選択的ノルアドレナリン再取り込み阻害剤、マジンドール、メタンフェタミン塩酸塩及びリスデキサンフェタミンメシル酸塩の投与を開始するには少なくとも14日間の間隔を置くこと。 また本剤に切り換える場合にはミルナシプラン塩酸塩は2〜3日間、デュロキセチン塩酸塩は5日間、フルボキサミンマレイン酸塩及びベンラファキシン塩酸塩は7日間、パロキセチン塩酸塩水和物、セルトラリン塩酸塩、ボルチオキセチン臭化水素酸塩、アトモキセチン塩酸塩、ミルタザピン及びエスシタロプラムシュウ酸塩は14日間の間隔を置くこと。 | 脳内モノアミン総量の増加が考えられている。 |
| メタンフェタミン塩酸塩 ヒロポン リスデキサンフェタミンメシル酸塩 ビバンセ [2.7参照] | 両薬剤の作用が増強される可能性があるので、本剤の投与を中止してから選択的セロトニン再取り込み阻害剤、セロトニン再取り込み阻害・セロトニン受容体調節剤、ノルアドレナリン・セロトニン作動性抗うつ剤、セロトニン・ノルアドレナリン再取り込み阻害剤、選択的ノルアドレナリン再取り込み阻害剤、マジンドール、メタンフェタミン塩酸塩及びリスデキサンフェタミンメシル酸塩の投与を開始するには少なくとも14日間の間隔を置くこと。 また本剤に切り換える場合にはミルナシプラン塩酸塩は2〜3日間、デュロキセチン塩酸塩は5日間、フルボキサミンマレイン酸塩及びベンラファキシン塩酸塩は7日間、パロキセチン塩酸塩水和物、セルトラリン塩酸塩、ボルチオキセチン臭化水素酸塩、アトモキセチン塩酸塩、ミルタザピン及びエスシタロプラムシュウ酸塩は14日間の間隔を置くこと。 | 脳内モノアミン総量の増加が考えられている。 |
10.2 併用注意
| CYP2D6及びCYP3A4の阻害作用を有する製剤注) シメチジン キニジン硫酸塩 プロパフェノン塩酸塩 ハロペリドール エリスロマイシン ジョサマイシン クラリスロマイシン イトラコナゾール フルコナゾール ミコナゾール クロトリマゾール エチニルエストラジオール ベラパミル塩酸塩 ジルチアゼム塩酸塩等 | 本剤の作用、毒性が大幅に増強される可能性がある。 | 本剤はCYP2D6及びCYP3A4によって代謝されることが判明しており、これを阻害する薬剤との併用により血中濃度の上昇をもたらす。 |
| レセルピン誘導体 レセルピン等 テトラベナジン バルベナジントシル酸塩 | 本剤の作用が減弱される可能性がある。 | 脳内ドパミンを減少させる。 |
| フェノチアジン系薬剤 プロクロルペラジン クロルプロマジン ペラジン等 ブチロフェノン系薬剤 ブロムペリドール等 スルピリド メトクロプラミド | 本剤の作用が減弱される可能性がある。 | 脳内ドパミン受容体を遮断する。 |
| トラゾドン塩酸塩 | 相互作用は明らかになっていないが、トラゾドン塩酸塩の中止直後あるいは併用する場合には、本剤の投与量を徐々に増加するなど、慎重に投与を開始すること。 | セロトニン再取り込み阻害作用があるため脳内セロトニン濃度が高まると考えられている。 |
| デキストロメトルファン臭化水素酸塩水和物 | セロトニン症候群が発現する可能性がある。 | 脳内のセロトニン濃度を上昇させる作用を有するため、併用によりセロトニン濃度が更に高まると考えられる。 |
| 交感神経興奮剤 エフェドリン塩酸塩 メチルエフェドリン塩酸塩 プソイドエフェドリン塩酸塩含有医薬品 フェニルプロパノールアミン塩酸塩含有医薬品 | 血圧上昇、頻脈等の発現が報告されている。 | 本剤のMAO-B選択性が低下した場合、交感神経刺激作用が増強されると考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 幻覚(4.5%)、妄想(1.3%)、錯乱(0.5%)、せん妄(0.1%)
11.1.2 狭心症(頻度不明)
狭心症の発現又は増悪が報告されている。[9.1.3参照]
11.1.3 悪性症候群(頻度不明)
本剤の急激な減量又は中止により、高熱、意識障害、高度の筋硬直、不随意運動、血清CK上昇等があらわれることがある。このような場合には、再投与後、漸減するとともに、体冷却、水分補給等の適切な処置を行うこと。なお、投与継続中に同様の症状があらわれることがある。
11.1.4 低血糖(頻度不明)
低血糖症状(意識障害、昏睡等)があらわれた場合には、投与を中止するなど適切な処置を行うこと。
11.1.5 胃潰瘍(0.4%)
11.2 その他の副作用
| 1〜5%未満 | 1%未満 | |
| 精神神経系 | 不随意運動、めまい・ふらつき、頭痛・頭重感、不眠、眠気 | 興奮、精神症状、ジストニア(筋緊張異常)、構音障害、歩行異常、不安、体のこわばり、しびれ、多夢、うつ症状、意識レベルの低下、緊張低下 |
| 消化器 | 悪心、嘔吐、食欲不振、口渇、胃痛・腹痛、便秘 | 下痢、消化不良 |
| 循環器 | 起立性低血圧、高血圧 | 動悸、低血圧、不整脈、心電図異常 |
| 肝臓 | 肝機能障害(AST、ALTの上昇) | |
| 過敏症 | 発疹 | |
| 泌尿器 | 排尿困難 | |
| 血液 | 白血球減少 | |
| 眼 | 視野狭窄 | |
| その他 | 血清CK上昇 | 浮腫、胸痛(胸部不快感)、倦怠感、ほてり・のぼせ、味覚異常、多汗、気分不良、疲労感、筋骨格硬直、腰痛、発熱、悪寒、体重減少、味覚低下、舌の違和感、意欲低下、筋攣縮、四肢痛、状態悪化 |
13. 過量投与
13.1 症状
本剤の過量投与によりMAO-Bの選択性が低下し非選択的なMAO阻害による副作用が発現する可能性があるため、患者の状態には十分注意すること。過剰投与により発現する可能性のある症状として、精神神経系症状(失神、激越、眠気、幻覚、妄想、痙攣、自殺的行動、認知症、不安、不眠、抑うつ、神経過敏、頭痛、無動症や振戦の悪化等)、循環器系症状(ショック、血圧上昇、起立性低血圧、心悸亢進、紅潮、不整脈、血圧低下、発汗等)、超高熱、呼吸抑制と不全、下胸部痛、開口障害等があらわれるおそれがある。[1.2参照]
13.2 処置
痙攣等の中枢神経系の刺激の徴候と症状はジアゼパムの点滴静注で治療する。
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.1.2 本剤の投与にあたっては、本剤の目的以外への使用あるいは他人への譲渡をしないよう指導すること。
14.1.3 本剤が不要となった際に病院・薬局等へ返却する場合の処置について、適切に指導すること。
14.1.4 本剤は口腔内で崩壊するが、口腔粘膜からの吸収を目的としないため、唾液又は水で飲み込むこと。
14.1.5 本剤は舌の上にのせ唾液を浸潤させ舌で軽くつぶし、崩壊後唾液のみで服用可能である。また、水で服用することもできる。
14.1.6 本剤は寝たままの状態では、水なしで服用させないこと。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 レボドパ含有製剤併用及び非併用のパーキンソン病患者を対象とした国内の臨床試験にて、明らかに因果関係が否定出来ない抑うつからの自殺例が488例中2例に認められた。
15.1.2 英国において、早期・軽症パーキンソン病患者を対象に、レボドパ単独群とセレギリン塩酸塩投与後にレボドパを併用投与した群を比較した神経保護作用に関する長期臨床試験が実施された。その結果、レボドパ単独群の死亡率に対し、セレギリン塩酸塩投与後にレボドパを併用投与した群の死亡率が約1.6倍と有意に高かったとの報告1)がある。その後の追跡調査4)では約1.3倍高かったが有意差はなかったとの報告がなされている。また、英国の医薬品庁が依頼した12,621人の一般診療のデータベースを用いたコホート研究5)では約1.1倍高かったが、有意差はなかったとの報告がなされている。さらに、英国以外(米国、ノルウェー、スウェーデン、ドイツ、フィンランド)の5試験のメタアナリシスの結果6)では約1.05倍で有意差はなく、また2000年英国のコホート研究の報告7)では、セレギリン塩酸塩とレボドパ併用患者の死亡率は健常人と変わらず、セレギリン塩酸塩治療に関連した死亡率の増加はないと報告している。
15.2 非臨床試験に基づく情報
過量連用により、依存性発現の可能性がある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人(9例)にセレギリン塩酸塩2.5〜15mg注)を単回経口投与した場合、未変化体のTmaxは0.08〜2.42時間で、t1/2は0.22〜1.47時間となり、未変化体の吸収ならびに血中からの消失は非常に速かった8)。
注)本剤の承認最大用量は10mg/日である。
16.1.2 反復投与
健康成人にセレギリン塩酸塩1日1回5mg又は10mgを1週間連続経口投与した場合においても体内への蓄積性は認められなかった19)。
16.1.3 生物学的同等性試験
健康成人にエフピー錠2.5及びエフピーOD錠2.5(10mg)を単回経口投与したクロスオーバー試験で、代謝物であるN-デスメチルセレギリンの血漿中濃度測定の試験結果は下記のとおりであり、エフピーOD錠2.5はエフピー錠2.5と生物学的に同等であることが確認された9)。
| 投与製剤 | AUCt (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) |
| エフピー錠2.5 (水で服用) | 63.412±20.979 | 22.262±4.806 | 1.00±0.23 | 5.37±1.47 |
| エフピーOD錠2.5 (水なしで服用) | 62.358±25.979 | 21.323±7.579 | 1.03±0.47 | 5.29±1.59 |
| 投与製剤 | AUCt (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) |
| エフピー錠2.5 (水で服用) | 71.035±30.218 | 22.271±7.314 | 1.03±0.34 | 5.12±1.86 |
| エフピーOD錠2.5 (水で服用) | 69.190±24.122 | 19.902±6.203 | 1.10±0.45 | 4.77±1.88 |
16.3 分布
16.4 代謝
本剤は肝臓のチトクロームP-450 2D6及び3A4によって代謝される。[10.参照]
16.5 排泄
健康成人にセレギリン塩酸塩10mgを単回経口投与したとき、尿中へ排泄され、未変化体及び主代謝物の48時間尿中累積排泄率を測定すると34.5%であった8)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<レボドパ含有製剤を併用する場合>
17.1.1 国内第III相試験
レボドパ含有製剤併用のパーキンソン病患者を対象とした多施設共同プラセボ対照二重盲検群間比較試験における改善率は、中等度改善以上が30.2%(48/159例)、軽度改善以上が65.4%(104/159例)であった。
副作用は159例中65例(40.9%)に発現した。主な副作用は幻覚(10.7%)、悪心・嘔吐(7.5%)、ジスキネジア(6.3%)、食欲不振(5.0%)、頭痛・頭重感(4.4%)であった10)(エフピー錠2.5承認時)。
副作用は159例中65例(40.9%)に発現した。主な副作用は幻覚(10.7%)、悪心・嘔吐(7.5%)、ジスキネジア(6.3%)、食欲不振(5.0%)、頭痛・頭重感(4.4%)であった10)(エフピー錠2.5承認時)。
<レボドパ含有製剤を併用しない場合>
17.1.2 国内第III相試験
レボドパ含有製剤非併用のパーキンソン病患者を対象とした多施設共同プラセボ対照無作為化二重盲検並行群間比較試験において、第III相試験における日本語版UPDRS partI,II,III合計スコアのベースラインからの変化量を本剤単独群(139例)とプラセボ群(140例)で比較した結果、有意な差が認められた。
| 投与群 | 例数 | 日本語版UPDRS partI,II,IIIの合計スコアa) | 変化量b,c) | |||
| ベースラインからの変化量 | プラセボ群との比較 | |||||
| ベースライン | 最終評価時 | 群間差 [95%信頼区間] | p値 | |||
| 本剤単独群 | 139 | 26.5±11.2 | 20.2±13.0 | -6.3±0.6 | -3.1±0.9 [-4.9〜-1.4] | 0.0005 |
| プラセボ群 | 140 | 26.6±11.5 | 23.4±13.6 | -3.1±0.6 | ||
副作用は本剤投与群142例中53例(37.3%)に発現した。主な副作用は便秘(6.3%)、高血圧(3.5%)、不眠症(2.8%)、腹部不快感(2.8%)、口渇(2.8%)であった11)(エフピーOD錠2.5効能追加承認時)。
17.1.3 国内第III相試験
レボドパ含有製剤非併用のパーキンソン病患者131例を対象とした56週間投与の長期試験において、日本語版UPDRS partI,II,III合計スコアのベースラインからの変化量(LSMEAN)は、投与4週後で-2.6、投与20週後で-5.6、投与56週後で-2.8であり、長期投与時も効果が維持された。
副作用は131例中58例(44.3%)に発現した。主な副作用は不眠症(5.3%)、便秘(4.6%)、血中CK増加(3.8%)、高血圧(3.1%)、背部痛(3.1%)であった12)(エフピーOD錠2.5効能追加承認時)。
副作用は131例中58例(44.3%)に発現した。主な副作用は不眠症(5.3%)、便秘(4.6%)、血中CK増加(3.8%)、高血圧(3.1%)、背部痛(3.1%)であった12)(エフピーOD錠2.5効能追加承認時)。
18. 薬効薬理
18.1 作用機序
本剤は、脳内MAO-B活性を不可逆かつ選択的に阻害し、シナプス間隙のドパミン量の減少を抑制する。また、シナプスへのドパミンの再取り込み阻害作用によっても、ドパミン量の減少を抑制する。これらの作用により細胞外ドパミン量が増加し、増加したドパミンが受容体の刺激を持続的に高め、パーキンソン病の症状を改善する。
18.2 血小板MAO-B活性の阻害
健康成人(男性)にセレギリン塩酸塩2.5〜15mg注)を単回経口投与した場合、セレギリン塩酸塩7.5mg以上の用量でほぼ完全に血小板MAO活性は抑制された。また、セレギリン塩酸塩5mg1日1回連続経口投与では投与期間中血小板MAO活性が完全に阻害された。その血小板MAO活性阻害は、極めて速やかであったが、未変化体の血中濃度に関係なく長期間にわたり、その回復には約10〜15日間を要し血小板の産生に一致していた。[7.参照]
注)本剤の承認最大用量は10mg/日である。
18.3 MAO-B選択的阻害作用
本剤のラット脳におけるin vitro(IC50)及びex vivo(ED50)でのMAO-A/MAO-B阻害比はそれぞれ1,000と200でMAO-B阻害の高度な選択性が認められている。
18.4 ドパミン再取り込み阻害作用
18.5 線条体ドパミン濃度の増加作用
18.5.1 ラットを用いた脳内微小透析法による実験で、本剤は線条体ドパミン濃度を増加させることが認められている。
18.5.2 レボドパと本剤の反復投与で、サルの線条体ドパミン濃度はレボドパ単独投与に比べ有意な増加を認めている。
18.6 黒質-線条体ドパミン神経に及ぼす作用
19. 有効成分に関する理化学的知見
19.1. セレギリン塩酸塩
20. 取扱い上の注意
開封後、直射日光及び高温・高湿を避けて保存すること。
22. 包装
30錠[10錠(PTP)×3、乾燥剤入り]
100錠[10錠(PTP)×10、乾燥剤入り]
23. 主要文献
- Lees AJ,et al., Br Med J., 311, 1602-1607, (1995)
- 社内資料:14C-FPF1100の妊娠152日目及び18日目ラットにおける胎盤通過性の検討
- 社内資料:14C-FPF1100のラットにおける乳汁移行性の検討
- Ben-Shlomo Y,et al., Br Med J., 316, 1191-1196, (1998)
- Thorogood M,et al., Br Med J., 317, 252-254, (1998)
- Olanow CW,et al., Neurology., 51, 825-830, (1998) »PubMed
- Donnan PT,et al., Neurology., 55, 1785-1789, (2000) »PubMed
- 尾野 敏雄 他, 臨床医薬, 7, 1475-1498, (1991)
- 社内資料:エフピーOD錠2.5のヒトにおける血中濃度に関する資料-エフピー錠2.5との比較試験
- 近藤 智善 他, 医学のあゆみ, 177, 157-231, (1996)
- Yoshikuni M,et al., Clin Neuropharm., 40, 201-207, (2017)
- Yoshikuni M,et al., Clin Neuropharma., 42, 123-130, (2019)
- Yang HYT,Neff NH, J Pharmacol Exp Ther., 187, 365-371, (1973)
- Yang HYT,Neff NH, J Pharmacol Exp Ther., 189, 733-740, (1974)
- Knoll J:Ed by N.S.Shah&A.G.Donald, Movement Disorders chapter 2, 53-81, (1986), (Plenum Publishing Corp.)
- Zsilla G,et al., Pol J Pharmacol Pharm., 38, 57-67, (1986) »PubMed
- Shimazu S,et al., Jpn Pharmacol Ther., 25, 955-963, (1997)
- Kaseda S,et al., Brain Res., 815, 44-50, (1999) »PubMed
- Heikkila RE,et al., Nature., 311, 467-469, (1984) »PubMed
- Cohen G,et al., Eur J Pharmacol., 106, 209-210, (1984) »PubMed
- Harsing LG,et al., Pol J Pharmacol.Pharm., 31, 297-307, (1979) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
エフピー株式会社
学術部
〒580-0011
大阪府松原市西大塚1丁目3番40号
電話:0120-545-427
FAX:0120-116-026
製品情報問い合わせ先
エフピー株式会社
学術部
〒580-0011
大阪府松原市西大塚1丁目3番40号
電話:0120-545-427
FAX:0120-116-026
26. 製造販売業者等
26.1 製造販売元
エフピー株式会社
〒580-0011
大阪府松原市西大塚1丁目3番40号