医薬品情報
| 総称名 | アレギサール |
|---|---|
| 一般名 | ペミロラストカリウム |
| 欧文一般名 | Pemirolast Potassium |
| 薬効分類名 | 抗アレルギー点眼剤 |
| 薬効分類番号 | 1319 |
| KEGG DRUG |
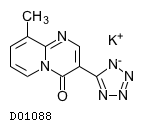
D01088
ペミロラストカリウム
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年12月 改訂(第1版)

|
4.効能または効果 6.用法及び用量 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アレギサール点眼液0.1% | Alegysal ophthalmic solution | 参天製薬 | 1319735Q1071 | 421.8円/瓶 |
4. 効能または効果
アレルギー性結膜炎、春季カタル
6. 用法及び用量
通常、1回1滴、1日2回(朝、夕)点眼する。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.7 小児等
低出生体重児、新生児、乳児を対象とした臨床試験は実施していない。
11. 副作用
11.2 その他の副作用
| 1%未満 | 頻度不明 | |
| 眼 | 眼瞼炎、眼刺激、結膜充血、眼脂 | そう痒感、結膜炎 |
14. 適用上の注意
14.1 薬剤交付時の注意
患者に対し以下の点に注意するよう指導すること。
・薬液汚染防止のため、点眼のとき、容器の先端が直接目に触れないように注意すること。
・点眼したときに液が眼瞼皮膚等についた場合には、すぐにふき取ること。
・患眼を開瞼して結膜嚢内に点眼し、1〜5分間閉瞼して涙嚢部を圧迫させた後、開瞼すること。
・他の点眼剤を併用する場合には、少なくとも5分以上間隔をあけてから点眼すること。
16. 薬物動態
16.1 血中濃度
16.1.1 1日点眼試験
健康成人男性(5例)に0.1%及び0.5%のペミロラストカリウム点眼液を1回2滴、1日4回点眼注)した結果、血漿中ペミロラスト濃度は0.1%、0.5%ともに点眼後1時間に最高値(0.1%:2.8ng/mL、0.5%:9.7ng/mL)を示した後、半減期3〜6時間で消失した1)。
16.1.2 1週間連続点眼試験
健康成人男性(6例)に0.5%ペミロラストカリウム点眼液を1日4回注)、1週間連続点眼した結果、1日目と7日目の血漿中薬物濃度変化のパターンには類似性が認められ、点眼後1時間に最高値(1日目:約15ng/mL、7日目:約17ng/mL)を示した後、穏やかに減少した。連続点眼による蓄積性は認められなかった。
また、最終点眼後35時間の血漿中ペミロラスト濃度は検出限界(1.0ng/mL)以下であった1)。
また、最終点眼後35時間の血漿中ペミロラスト濃度は検出限界(1.0ng/mL)以下であった1)。
16.3 分布
0.1%ぺミロラストカリウム点眼液50μLをウサギに点眼したときの眼組織中のぺミロラスト濃度は、結膜、角膜及び前部強膜等の外眼部では内眼部に比べて高い値を示した。角膜及び前部強膜ではぺミロラスト濃度は経時的に低下したが、結膜では滞留性があり、点眼後24時間でも十分薬効を期待できる濃度を維持した。房水、虹彩・毛様体及び網脈絡膜では点眼後15〜30分に最大となり、8時間以降では痕跡程度となった。水晶体、硝子体への移行はわずかであった。血漿では、点眼後15分にわずかに検出されたが、4時間では検出限界(1.0ng/mL)以下となった2)。
16.5 排泄
16.5.1 1日点眼試験
健康成人男性(5例)に0.1%及び0.5%のペミロラストカリウム点眼液を1回2滴、1日4回点眼注)した結果、0.1%点眼液では点眼日の24時間尿には、52.4±19.6μgのペミロラストが検出されたが、点眼翌日の24時間尿では検出限界(10ng/mL)以下であった1)。
16.5.2 1週間連続点眼試験
健康成人男性(6例)に0.5%ペミロラストカリウム点眼液を1日4回注)、1週間連続点眼した結果、点眼1日目、4日目、7日目(点眼終了日)の24時間尿のペミロラスト排泄量には特に変動は認められず、点眼終了日の排泄量は286.0±54.0μgで、点眼終了翌日の24時間尿は54.5±8.6μgとなり、翌々日では1例を除いて検出されなかった1)。
注)本剤が承認されている用法・用量は、0.1%ペミロラストカリウム点眼液として、1回1滴、1日2回(朝、夕)点眼である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(クロモグリク酸ナトリウム対照比較試験)
アレルギー性結膜炎患者205例(解析対象194例)及び春季カタル患者59例(解析対象54例)を対象とした無作為化二重盲検比較試験において、本剤0.1%又は2%クロモグリク酸ナトリウム点眼液を1回1〜2滴、1日4回注)、原則としてアレルギー性結膜炎は2週間、春季カタルは4週間点眼した結果、全般改善度は表1の通りであり、両疾患とも両群間に有意差は認められなかった。
副作用は本剤群では123例中2例(2%)に認められ、結膜浮腫及び眼刺激が各1件であった3)。
副作用は本剤群では123例中2例(2%)に認められ、結膜浮腫及び眼刺激が各1件であった3)。
| 本剤0.1% | 2%クロモグリク酸ナトリウム点眼液 | |
| アレルギー性結膜炎 | 67% | 68% |
| 春季カタル | 60% | 61% |
17.1.2 国内第III相試験(至適点眼回数の検討)
アレルギー性結膜炎患者81例(解析対象74例)及び春季カタル患者9例(解析対象8例)を対象に、本剤0.1%を1回1滴、1日2回又は1日4回注)、原則としてアレルギー性結膜炎は2週間、春季カタルは4週間点眼した結果、全般改善度は表2の通りであり、両疾患とも1日2回群と1日4回群の間に有意差は認められなかった。
副作用は1日2回群では39例中2例(5%)に認められ、眼瞼発赤、違和感及び刺激感が各1件であり、1日4回群では43例中2例(5%)に認められ、眼瞼縁炎及び刺激感が各1件であった4)。
副作用は1日2回群では39例中2例(5%)に認められ、眼瞼発赤、違和感及び刺激感が各1件であり、1日4回群では43例中2例(5%)に認められ、眼瞼縁炎及び刺激感が各1件であった4)。
| 1日2回 | 1日4回 | |
| アレルギー性結膜炎 | 68% | 71% |
| 春季カタル | 67% | 50% |
17.1.3 国内第III相試験(追加試験)
アレルギー性結膜炎患者85例(解析対象69例)及び春季カタル患者35例(解析対象33例)を対象に、本剤0.1%を1回1滴、1日2回、原則としてアレルギー性結膜炎は2週間、春季カタルは4週間点眼した結果、全般改善度は表3の通りであった。
副作用は120例中2例(2%)に認められ、眼脂の増加、眼瞼の粘着感、異物感及び充血が各1件であった5)。
副作用は120例中2例(2%)に認められ、眼脂の増加、眼瞼の粘着感、異物感及び充血が各1件であった5)。
| アレルギー性結膜炎 | 76% |
| 春季カタル | 67% |
注)本剤が承認されている用法・用量は、通常、1回1滴、1日2回(朝、夕)点眼である。
18. 薬効薬理
18.1 作用機序
18.2 実験的アレルギー性結膜炎抑制作用
18.3 作用持続性
ウサギ受動感作アレルギー性結膜炎に対する抑制作用を経時的に検討した結果、2時間後で約60%の最高抑制率を示した後、40〜50%程度の有意な抑制作用を12時間後まで維持した10)。
19. 有効成分に関する理化学的知見
19.1. ペミロラストカリウム
22. 包装
プラスチック点眼容器
5mL×5本、5mL×10本、5mL×50本
23. 主要文献
- 社内資料:抗アレルギー点眼剤(TBX点眼液)の第1相臨床試験
- 山口秀文他, 日本眼科紀要, 41, 2095-2100, (1990)
- 北野周作他, 日本眼科紀要, 42, 532-544, (1991)
- 北野周作他, 日本眼科紀要, 42, 201-211, (1991)
- 北野周作他, あたらしい眼科, 10, 323-332, (1993)
- Fujimiya,H.et al., Int.Arch.Allergy Appl.Immunol., 96, 62-67, (1991) »PubMed
- 川島敏男他, アレルギー, 37, 438-447, (1988) »DOI
- 壬生寛之他, 日本眼科紀要, 41, 867-870, (1990)
- 社内資料:アレルギー性結膜炎(モルモットPCA反応)における細胞遊走に対するTBXの効果
- 澤健治郎他, あたらしい眼科, 12, 1565-1567, (1995)
24. 文献請求先及び問い合わせ先
文献請求先
参天製薬株式会社
製品情報センター 受付時間9:00〜17:00(土・日・祝日を除く)
〒530-8552(個別郵便番号)
大阪市北区大深町4-20
電話:0120-921-839
06-7664-8624
06-7664-8624
製品情報問い合わせ先
参天製薬株式会社
製品情報センター 受付時間9:00〜17:00(土・日・祝日を除く)
〒530-8552(個別郵便番号)
大阪市北区大深町4-20
電話:0120-921-839
06-7664-8624
06-7664-8624
26. 製造販売業者等
26.1 製造販売元
参天製薬株式会社
大阪市北区大深町4-20