医薬品情報
| 総称名 | トリテレン |
|---|---|
| 一般名 | トリアムテレン |
| 欧文一般名 | Triamterene |
| 製剤名 | トリアムテレンカプセル |
| 薬効分類名 | 利尿・血圧降下剤 |
| 薬効分類番号 | 2133 |
| ATCコード | C03DB02 |
| KEGG DRUG |
D00386
トリアムテレン
|
| KEGG DGROUP |
DG03231
血圧降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年4月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| トリテレン・カプセル50mg | Triteren Capsules | 京都薬品工業 | 2133002M1062 | 19.9円/カプセル | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
高血圧症(本態性、腎性等)、心性浮腫(うっ血性心不全)、腎性浮腫、肝性浮腫
6. 用法及び用量
トリアムテレンとして、通常成人1日90〜200mgを2〜3回に分割経口投与する。なお、年齢、症状により適宜増減する。
7. 用法及び用量に関連する注意
1日当たりの製剤量は2〜4カプセルである。
8. 重要な基本的注意
8.1 連用する場合、電解質異常があらわれることがあるので定期的に検査を行うこと。
8.2 降圧作用に基づくめまい等があらわれることがあるので、高所作業、自動車の運転等危険を伴う機械を操作する際には注意させること。
8.3 夜間の休息がとくに必要な患者には、夜間の排尿を避けるため、午前中に投与することが望ましい。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 重篤な冠動脈硬化症又は脳動脈硬化症のある患者
急激な利尿があらわれた場合、急速な血漿量減少、血液濃縮をきたし、血栓塞栓症を誘発するおそれがある。
9.1.2 減塩療法を受けている患者
低ナトリウム血症等の電解質異常があらわれるおそれがある。
9.1.3 葉酸欠乏又は葉酸代謝異常のある患者
本剤の葉酸拮抗作用により巨赤芽球性貧血等の血液障害があらわれることがある。
9.2 腎機能障害患者
9.2.1 急性腎不全の患者
投与しないこと。高カリウム血症等の電解質異常があらわれるおそれがある。[2.2参照]
9.2.2 重篤な腎障害のある患者
高カリウム血症等の電解質異常があらわれるおそれがある。
9.3 肝機能障害患者
9.3.1 肝疾患・肝機能障害のある患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
9.7.1 小児等を対象とした臨床試験は実施していない。
9.7.2 乳児は電解質バランスがくずれやすい。
9.8 高齢者
以下の点に注意し、少量から投与を開始するなど患者の状態を観察しながら慎重に投与すること。
・一般に過度の降圧、利尿は好ましくないとされている。脳梗塞、脱水、低血圧等による立ちくらみ、めまい、失神等を起こすことがある。
・特に心疾患等で浮腫のある高齢者では急激な利尿は急速な血漿量の減少と血液濃縮をきたし、脳梗塞等の血栓塞栓症を誘発するおそれがある。
・高カリウム血症があらわれやすい。
10. 相互作用
10.1 併用禁忌
| インドメタシン インテバン等 ジクロフェナク ボルタレン等 [2.5参照] | 急性腎障害があらわれることがある。 | プロスタグランジン合成阻害作用により、本剤の腎血流量低下作用が増強される。 腎障害のある患者への投与には注意すること。 |
10.2 併用注意
| 非ステロイド性消炎鎮痛剤(インドメタシン、ジクロフェナクを除く) | 類薬(インドメタシン、ジクロフェナク)で急性腎障害があらわれるとの報告がある。 | 非ステロイド性消炎鎮痛剤のプロスタグランジン合成阻害作用により、本剤の腎血流量低下作用が増強されるおそれがある。 腎障害のある患者への投与には注意すること。 |
| ACE阻害剤 エナラプリルマレイン酸塩 カプトプリル等 A-II受容体拮抗薬 ロサルタンカリウム カンデサルタンシレキセチル カリウム製剤 塩化カリウム グルコン酸カリウム アスパラギン酸カリウム等 | 血清カリウム値が上昇するおそれがある。 | 併用によりカリウム貯留作用が増強され血清カリウム値が上昇するおそれがある。腎障害のある患者への投与には注意すること。 |
| 降圧作用を有する薬剤 | 相互に作用を増強することがあるので、用量調節等に注意すること。 | 相互に作用を増強することがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 急性腎障害(0.1%未満)
注)発現頻度は再評価結果に基づく。
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | |
| 血液 | 好酸球増加、巨赤芽球性貧血等の血液障害 | |
| 代謝異常 | 高カリウム血症等の電解質異常 | |
| 腎臓 | 腎結石 | |
| 過敏症 | 発疹等の過敏症状又は光線過敏症 | |
| 消化器 | 食欲不振、悪心・嘔吐、口渇、下痢 | |
| 精神・神経系 | 眩暈、頭痛等 | |
| その他 | 倦怠感、疲労感 |
13. 過量投与
13.1 症状
高カリウム血症等電解質異常、悪心・嘔吐・その他の消化器障害、脱力、低血圧を起こす可能性がある。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
健康成人6名にトリアムテレンとして100mg単回経口投与したとき、0.8〜2.3時間で最高血漿中濃度125.1ng/mLに達した1)(外国人データ)。
| 投与量(mg) | Tmax(hr) | Cmax(ng/mL) | AUC0-24(ng・hr/mL) |
| 100 | 1.23±0.54 | 125.1±42.2 | 488.4±122.1 |
16.3 分布
16.3.1 血漿蛋白結合率
約60%(in vitro、ヒト血漿、外国人データ)。
16.4 代謝
肝で代謝され、p-hydroxytriamterene及びその硫酸抱合体となる。
代謝物であるp-hydroxytriamtereneの硫酸抱合体はナトリウム利尿作用、カリウム排泄抑制作用を有する2)(in vitro、ラット)。
代謝物であるp-hydroxytriamtereneの硫酸抱合体はナトリウム利尿作用、カリウム排泄抑制作用を有する2)(in vitro、ラット)。
16.5 排泄
健康成人15名にトリアムテレン200mg注)を単回経口投与したとき、トリアムテレンは尿中から排泄され、尿中濃度は2〜3時間でピークに達した。8時間後にはその80%が排泄された3)(外国人データ)。
注)本剤の承認用量は「トリアムテレンとして、通常成人1日90〜200mgを2〜3回に分割経口投与する。なお、年齢、症状により適宜増減する。」である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床試験
臨床試験結果の概要は次のとおりである。(再評価資料)
| 対象疾患 | 有効率 |
| 本態性高血圧症 | 77.4%(209/270例) |
| 腎性高血圧症 | 73.7%(14/19例) |
| 心性浮腫(うっ血性心不全) | 89.4%(93/104例) |
| 腎性浮腫 | 76.1%(51/67例) |
| 肝性浮腫 | 92.5%(74/80例) |
18. 薬効薬理
18.1 作用機序
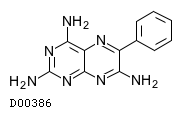
19. 有効成分に関する理化学的知見
19.1. トリアムテレン
22. 包装
100カプセル[10カプセル(PTP)×10]
23. 主要文献
- Hasegawa,J.et al., J.Pharmacok.Biopharm., 10 (5), 507-523, (1982) »PubMed
- Knauf,V.H.et al., Arzneim.Forsch./Drug Res., 28 (8), 1417-1420, (1978)
- Pupita,F.et al., Minerva Med., 54 (81 Suppl), 3039-3042, (1963 Oct 10)
- Senft,G.et al., Klin.Wochenschr., 39, 1205-1206, (1961 Dec 1)
- Wiebelhaus,V.D.et al., J.Pharmacol.Exp.Ther., 149 (3), 397-403, (1965) »PubMed
- 吉利和ほか, 日本腎臓学会誌, 5 (1), 107, (1963)
- Ambrosoli,S.et al., Minerva Nefrol., 11 (1), 25-29, (1964)
- Baba,W.I.et al., Br.Med.J., 2 (5307), 756-760, (1962) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
住友ファーマ株式会社
くすり情報センター
〒541-0045
大阪市中央区道修町2-6-8
電話:0120-034-389
製品情報問い合わせ先
住友ファーマ株式会社
くすり情報センター
〒541-0045
大阪市中央区道修町2-6-8
電話:0120-034-389
26. 製造販売業者等
26.1 製造販売元
京都薬品工業株式会社
京都市中京区西ノ京月輪町38
26.2 販売元
住友ファーマ株式会社
大阪市中央区道修町2-6-8