医薬品情報
| 総称名 | プロギノン |
|---|---|
| 一般名 | エストラジオール吉草酸エステル |
| 欧文一般名 | Estradiol Valerate |
| 製剤名 | エストラジオール吉草酸エステル注射液 |
| 薬効分類名 | 持続性卵胞ホルモン剤 |
| 薬効分類番号 | 2473 |
| ATCコード | G03CA03 |
| KEGG DRUG |
D01413
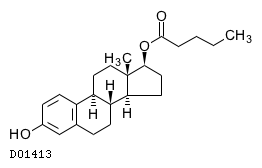
エストラジオール吉草酸エステル
|
| KEGG DGROUP |
DG00462
エストラジオール
DG01986
卵胞ホルモン
DG01584
エストロゲン受容体作動薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年7月 改訂(第1版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| プロギノン・デポー筋注10mg | Progynon-Depot intramuscular injection | 富士製薬工業 | 2473402A2059 | 310円/管 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 エストロゲン依存性悪性腫瘍(例えば乳癌、子宮内膜癌)及びその疑いのある患者[腫瘍の悪化あるいは顕性化を促すことがある。][8.2参照]
2.2 乳癌の既往歴のある患者[乳癌が再発するおそれがある。][8.2参照]
2.3 未治療の子宮内膜増殖症のある患者[子宮内膜増殖症は細胞異型を伴う場合がある。][8.2参照]
2.4 血栓性静脈炎や肺塞栓症の患者又はその既往歴のある患者[症状の悪化又は再発のおそれがある。][11.1.1参照]
2.6 重篤な肝障害のある患者[9.3.1参照]
2.7 診断の確定していない異常性器出血のある患者[出血が子宮内膜癌による場合は、癌の悪化あるいは顕性化を促すことがある。][8.2参照]
2.8 妊婦又は妊娠している可能性のある女性[9.5.1参照]
4. 効能または効果
無月経、月経周期異常(稀発月経・多発月経)、月経量異常(過少月経・過多月経)、月経困難症、機能性子宮出血、子宮発育不全症、卵巣欠落症状、更年期障害、不妊症
5. 効能または効果に関連する注意
<無月経>
続発性無月経の患者は少なくとも最終月経終了後8週間経過するまで投与しないこと。
6. 用法及び用量
エストラジオール吉草酸エステルとして、通常成人1回5〜10mgを1〜4週間毎に筋肉内注射する。なお、症状により適宜増減する。
8. 重要な基本的注意
8.1 外国において、卵胞ホルモン剤と黄体ホルモン剤を長期併用した女性では、乳癌になる危険性が対照群の女性と比較して高くなり、その危険性は併用期間が長期になるに従って高くなるとの報告があるので、本剤の投与にあたっては、患者に対し本剤のリスクとベネフィットについて十分な説明を行うとともに必要最小限の使用にとどめ、漫然と長期投与を行わないこと。[15.1.2参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 乳癌家族素因が強い患者、乳房結節のある患者、乳腺症の患者又は乳房レントゲン像に異常がみられた患者
症状を悪化させるおそれがある。[8.2参照]
9.1.2 術前又は長期臥床状態の患者
血液凝固能が亢進され、心血管系の副作用の危険性が高くなることがある。[11.1.1参照]
9.1.3 子宮筋腫のある患者
子宮筋腫の発育を促進するおそれがある。[8.2参照]
9.1.4 子宮内膜症のある患者
症状が増悪するおそれがある。[8.2参照]
9.1.5 心疾患のある患者又はその既往歴のある患者
ナトリウム又は体液の貯留があらわれることがある。
9.1.6 てんかん患者
症状を悪化させるおそれがある。
9.1.7 糖尿病患者
十分コントロールを行いながら投与すること。
9.1.8 全身性エリテマトーデスの患者
症状を悪化させるおそれがある。
9.1.9 骨成長が終了していない可能性がある患者、思春期前の患者
骨端の早期閉鎖、性的早熟をきたすおそれがある。[9.7参照]
9.2 腎機能障害患者
9.2.1 腎疾患のある患者又はその既往歴のある患者
ナトリウム又は体液の貯留があらわれることがある。
9.3 肝機能障害患者
9.3.1 重篤な肝障害のある患者
投与しないこと。代謝能が低下しており肝臓への負担が増加するため、症状が増悪することがある。[2.6参照]
9.3.2 肝障害のある患者(重篤な肝障害のある患者を除く)
症状を悪化させるおそれがある。
9.4 生殖能を有する者
<無月経、子宮発育不全症>
投与中に妊娠することがあってはならないので、適切な非ホルモン法(クナウス−荻野によるリズム法と体温法を除く)による避妊を行うよう注意すること。また治療プランに基づいて(約28日という規則正しい間隔で)消退性出血が起こらない場合は、妊娠を考慮すべきであり、鑑別診断によって、状況が明らかになるまで、投与を中止すること。
9.5 妊婦
9.5.1 妊婦又は妊娠している可能性のある女性には投与しないこと。妊婦の投与を対象とした有効性及び安全性を指標とした臨床試験は実施していない。[2.8参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。健康女性で乳汁中へ移行することが認められている。
9.7 小児等
[9.1.9参照]
10. 相互作用
10.2 併用注意
| 血糖降下剤 インスリン製剤 スルフォニル尿素系製剤 トルブタミド等 ビグアナイド系製剤 ブホルミン塩酸塩等 | 血糖降下作用が減弱することがある。血糖値その他患者の状態を十分観察し、血糖降下剤の用量を調節するなど注意すること。 | 卵胞ホルモンは耐糖能を変化させ血糖を上昇させる作用が認められている。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど、適切な処置を行うこと。
11.1.1 血栓症(頻度不明)
11.2 その他の副作用
| 頻度不明 | |
| 過敏症 | 過敏症状 |
| 精神神経系 | 精神障害の再発 |
| 電解質代謝 | 高カルシウム血症、ナトリウム・体液の貯留 |
| 子宮 | 消退出血、不正出血、経血量の変化 |
| 乳房 | 乳房痛、乳房緊満感 |
| その他 | 頭痛 |
14. 適用上の注意
14.1 薬剤投与時の注意
14.1.1 筋肉内注射にのみ使用すること。
14.1.2 生理的月経の発現に障害を及ぼすような投与を避けること。
14.1.3 筋肉内注射にあたっては、組織、神経等への影響を避けるため以下の点に注意すること。
・筋肉内投与はやむをえない場合にのみ、必要最小限に行うこと。なお、特に同一部位への反復注射は行わないこと。また、低出生体重児、新生児、乳児、幼児、小児には特に注意すること。
・神経走行部位を避けるよう注意すること。
・注射針を刺入したとき、激痛を訴えたり、血液の逆流をみた場合は、直ちに針を抜き、部位を変えて注射すること。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 ホルモン補充療法(HRT)と子宮内膜癌の危険性
卵胞ホルモン剤を長期間(約1年以上)使用した閉経期以降の女性では、子宮内膜癌になる危険性が対照群の女性と比較して高く、この危険性は、使用期間に相関して上昇し(1〜5年間で2.8倍、10年以上で9.5倍)、黄体ホルモン剤の併用により抑えられる(対照群の女性と比較して0.8倍)との疫学調査の結果が報告されている4)。
15.1.2 HRTと乳癌の危険性
15.1.3 HRTと冠動脈性心疾患の危険性
15.1.4 HRTと脳卒中の危険性
15.1.5 HRTと認知症の危険性
15.1.6 HRTと卵巣癌の危険性
(2)米国におけるWHI試験の結果、結合型エストロゲン・黄体ホルモン配合剤投与群において、卵巣癌になる危険性がプラセボ投与群と比較して有意ではないが、高い傾向がみられた(ハザード比:1.58)との報告がある17)。
15.1.7 HRTと胆嚢疾患の危険性
米国におけるWHI試験の結果、結合型エストロゲン・黄体ホルモン配合剤投与群において、胆嚢疾患になる危険性がプラセボ投与群と比較して有意に高くなる(ハザード比:1.59)との報告がある。並行して行われた子宮摘出者に対する試験の結果、結合型エストロゲン単独投与群では、胆嚢疾患になる危険性がプラセボ投与群と比較して有意に高くなる(ハザード比:1.67)との報告がある18)。
16. 薬物動態
18. 薬効薬理
18.1 作用機序
19. 有効成分に関する理化学的知見
19.1. エストラジオール吉草酸エステル
22. 包装
10mg/1mL 10アンプル
23. 主要文献
- 安田佳子他, 医学のあゆみ, 98 (8), 537-538, (1976)
- 安田佳子他, 医学のあゆみ, 99 (8), 611-612, (1976)
- 守隆夫, 医学のあゆみ, 95 (11), 599-602, (1975)
- Grady D,et al., Obstet Gynecol., 85 (2), 304-313, (1995) »PubMed
- Chlebowski RT,et al., JAMA., 289 (24), 3243-3253, (2003) »PubMed
- Anderson GL,et al., JAMA., 291 (14), 1701-1712, (2004) »PubMed
- Stefanick ML,et al., JAMA., 295 (14), 1647-1657, (2006) »PubMed
- Beral V,et al., Lancet., 362 (9382), 419-427, (2003) »PubMed
- Manson JE,et al., N Engl J Med., 349 (6), 523-534, (2003) »PubMed
- Wassertheil-Smoller S,et al., JAMA., 289 (20), 2673-2684, (2003) »PubMed
- Hendrix SL,et al., Circulation., 113 (20), 2425-2434, (2006) »PubMed
- Shumaker SA,et al., JAMA., 289 (20), 2651-2662, (2003) »PubMed
- Shumaker SA,et al., JAMA., 291 (24), 2947-2958, (2004) »PubMed
- Rodriguez C,et al., JAMA., 285 (11), 1460-1465, (2001) »PubMed
- Lacey JV Jr,et al., JAMA., 288 (3), 334-341, (2002) »PubMed
- Beral V,et al., Lancet., 369 (9574), 1703-1710, (2007) »PubMed
- Anderson GL,et al., JAMA., 290 (13), 1739-1748, (2003) »PubMed
- Cirillo DJ,et al., JAMA., 293 (3), 330-339, (2005) »PubMed
- Dusterberg B,et al., Maturitas., 4 (4), 315-324, (1982) »PubMed
- Dusterberg B,et al., Hormone Res., 21 (3), 145-154, (1985) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
富士製薬工業株式会社
富山工場 学術情報課
〒939-3515
富山県富山市水橋辻ヶ堂1515番地
電話:0120-956-792
FAX:076-478-0336
製品情報問い合わせ先
富士製薬工業株式会社
富山工場 学術情報課
〒939-3515
富山県富山市水橋辻ヶ堂1515番地
電話:0120-956-792
FAX:076-478-0336
26. 製造販売業者等
26.1 製造販売元
富士製薬工業株式会社
富山県富山市水橋辻ヶ堂1515番地