医薬品情報
| 総称名 | プリモジアン |
|---|---|
| 一般名 | テストステロンエナント酸エステル エストラジオール吉草酸エステル |
| 欧文一般名 | Testosterone Enanthate Estradiol Valerate |
| 製剤名 | テストステロンエナント酸エステル・エストラジオール吉草酸エステル注射液 |
| 薬効分類名 | 持続性男性・卵胞混合ホルモン剤 |
| 薬効分類番号 | 2481 |
| ATCコード | G03EA02 |
| KEGG DRUG |
D04454
テストステロンエナント酸エステル・吉草酸エストラジオール
|
| KEGG DGROUP |
DG03232
骨粗鬆症治療薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年10月 改訂(第2版)
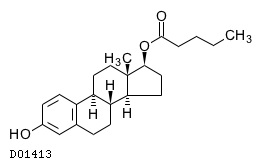
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| プリモジアン・デポー筋注 | Primodian-Depot intramuscular injection | 富士製薬工業 | 2481402A1054 | 530円/管 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 アンドロゲン依存性悪性腫瘍(例えば前立腺癌)及びその疑いのある患者[症状を悪化させるおそれがある。][8.5参照]
2.2 エストロゲン依存性悪性腫瘍(例えば乳癌、子宮内膜癌)及びその疑いのある患者[腫瘍の悪化あるいは顕性化を促すことがある。][8.2参照]
2.3 乳癌の既往歴のある患者[乳癌が再発するおそれがある。][8.2参照]
2.4 未治療の子宮内膜増殖症のある患者[子宮内膜増殖症は細胞異型を伴う場合がある。][8.2参照]
2.5 血栓性静脈炎や肺塞栓症の患者又はその既往歴のある患者[症状の悪化又は再発のおそれがある。][11.1.1参照]
2.7 重篤な肝障害のある患者[9.3.1参照]
2.9 脂質代謝障害のある患者[症状を悪化させるおそれがある。]
2.10 妊娠中に悪化した耳硬化症の既往歴のある患者[症状の悪化又は再発のおそれがある。]
2.11 妊婦又は妊娠している可能性のある女性[9.5.1参照]
2.12 小児[9.7参照]
4. 効能または効果
更年期障害、卵巣欠落症状、骨粗鬆症
5. 効能または効果に関連する注意
<更年期障害、卵巣欠落症状>
男性に対する適応は認められていない。
6. 用法及び用量
通常、2〜4週毎に1回1mLを筋肉内注射する。
なお、症状により適宜増減する。
なお、症状により適宜増減する。
7. 用法及び用量に関連する注意
<更年期障害>
7.1 治療を要する症状が残存しているかどうかを確かめるために、約6ヵ月毎に治療を中断すること。
<骨粗鬆症>
7.2 投与後6ヵ月〜1年後に骨密度を測定し、効果が認められない場合には投与を中止し、他の療法を考慮すること。
8. 重要な基本的注意
<効能共通>
8.1 外国において、卵胞ホルモン剤と黄体ホルモン剤を長期併用した女性では、乳癌になる危険性が対照群の女性と比較して高くなり、その危険性は併用期間が長期になるに従って高くなるとの報告があるので、本剤の投与にあたっては、患者に対し本剤のリスクとベネフィットについて十分な説明を行うとともに必要最小限の使用にとどめ、漫然と長期投与を行わないこと。[15.1.2参照]
8.2 女性に投与する場合には、投与前に病歴、家族素因等の問診、乳房検診並びに婦人科検診(子宮を有する患者においては子宮内膜細胞診及び超音波検査による子宮内膜厚の測定を含む)を行い、投与開始後は定期的に乳房検診並びに婦人科検診を行うこと。[2.2-2.4、2.8、9.1.1、9.1.3、9.1.4参照]
8.3 女性に投与する場合には、変声の可能性があることを告げておき、投与に際しては観察を十分に行い、異常が認められた場合には投与を中止すること。
8.4 月経出血以外の子宮出血があらわれた場合は、その原因を明らかにすること。[2.8参照]
<骨粗鬆症>
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 乳癌家族素因が強い患者、乳房結節のある患者、乳腺症の患者又は乳房レントゲン像に異常がみられた患者
症状を悪化させるおそれがある。[8.2参照]
9.1.2 術前又は長期臥床状態の患者
血液凝固能が亢進され、心血管系の副作用の危険性が高くなることがある。[11.1.1参照]
9.1.3 子宮筋腫のある患者
子宮筋腫の発育を促進するおそれがある。[8.2参照]
9.1.4 子宮内膜症のある患者
症状を悪化させるおそれがある。[8.2参照]
9.1.5 前立腺肥大のある患者
症状を悪化させるおそれがある。[8.5参照]
9.1.6 心疾患のある患者又はその既往歴のある患者、癌の骨転移のある患者
ナトリウム又は体液の貯留、高カルシウム血症があらわれることがある。
9.1.7 てんかんの患者
症状を悪化させるおそれがある。
9.1.8 糖尿病の患者
十分コントロールを行いながら投与すること。糖尿病が増悪することがある。
9.1.9 耳硬化症の患者
症状を悪化させるおそれがある。
9.1.10 多発性硬化症の患者
症状を悪化させるおそれがある。
9.1.11 ポルフィリン症の患者
症状を悪化させるおそれがある。
9.1.12 テタニーのある患者
症状を悪化させるおそれがある。
9.1.13 高血圧症の患者
症状を悪化させるおそれがある。
9.1.14 全身性エリテマトーデスの患者
症状を悪化させるおそれがある。
9.2 腎機能障害患者
9.2.1 腎疾患のある患者又はその既往歴のある患者
ナトリウム又は体液の貯留、高カルシウム血症があらわれることがある。
9.3 肝機能障害患者
9.3.1 重篤な肝障害のある患者
投与しないこと。代謝能が低下しており肝臓への負担が増加するため、症状が増悪することがある。[2.7参照]
9.3.2 肝障害のある患者(重篤な肝障害のある患者を除く)
症状を悪化させるおそれがある。
9.4 生殖能を有する者
投与中に妊娠することがあってはならないので、月経のある患者には、適切な非ホルモン法による避妊を行うよう注意すること。また投与中に、通常の間隔で月経が起こらない場合は、妊娠を考慮すべきであり、鑑別診断により状況が明らかになるまで、投与を中止すること。[9.5.1参照]
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
骨成長が終了していない可能性がある患者、思春期前の患者には投与しないこと。骨端の早期閉鎖、性的早熟を来すことがある。[2.12参照]
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。アンドロゲン依存性腫瘍が潜在している可能性がある。また、一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
| 血糖降下剤 インスリン製剤 スルフォニル尿素系製剤 トルブタミド等 ビグアナイド系製剤 ブホルミン塩酸塩等 | 卵胞ホルモンとの併用により血糖降下作用が減弱することがある。血糖値その他患者の状態を十分観察し、血糖降下剤の用量を調節するなど注意すること。 | 卵胞ホルモンは耐糖能を変化させ血糖を上昇させる作用が認められている。 |
| 抗凝血剤 ワルファリンカリウム等 | 男性ホルモンとの併用により抗凝血剤の作用を増強することがある。患者の状態を十分観察し、抗凝血剤を減量するなど注意すること。 | 機序は不明 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど、適切な処置を行うこと。
11.1.1 血栓症(頻度不明)
11.2 その他の副作用
| 頻度不明 | |
| 過敏症 | 過敏症状 |
| 肝臓 | 肝機能異常 |
| 電解質代謝 | 高カルシウム血症、ナトリウム・体液の貯留 |
| 女性 | 月経異常、消退出血、不正出血、経血量の変化、乳房痛、乳房緊満感、嗄声・多毛、陰核肥大等の男性化症状、性欲亢進、体重の増減 |
| 男性 | 陰茎肥大、持続性勃起、睾丸萎縮・精子減少・精液減少等の睾丸機能抑制 |
| 精神神経系 | 多幸感 |
| 皮膚 | ざ瘡、色素沈着、脱毛、紅斑 |
| その他 | 頭痛 |
14. 適用上の注意
14.1 薬剤投与時の注意
14.1.1 静脈内には投与しないこと。筋肉内注射にのみ使用すること。
14.1.2 注射局所の発赤、腫脹又は疼痛が起こることがある。
14.1.3 筋肉内注射にあたっては、組織、神経等への影響を避けるため以下の点に注意すること。
・特に同一部位への反復注射は行わないこと。
・神経走行部位を避けるよう注意すること。
・注射針を刺入したとき、激痛を訴えたり、血液の逆流をみた場合は直ちに針を抜き、部位をかえて注射すること。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 ホルモン補充療法(HRT)と子宮内膜癌の危険性
卵胞ホルモン剤を長期間(約1年以上)使用した閉経期以降の女性では、子宮内膜癌になる危険性が対照群の女性と比較して高く、この危険性は、使用期間に相関して上昇し(1〜5年間で2.8倍、10年以上で9.5倍)、黄体ホルモン剤の併用により抑えられる(対照群の女性と比較して0.8倍)との疫学調査の結果が報告されている4)。
15.1.2 HRTと乳癌の危険性
HRTと乳癌発生との因果関係については明らかではないが、次のような報告がある。
(1)米国における閉経後女性を対象とした無作為化臨床試験(Women’s Health Initiative[WHI]試験)の結果、結合型エストロゲン・黄体ホルモン配合剤投与群では、乳癌になる危険性がプラセボ投与群と比較して有意に高くなる(ハザード比:1.24)との報告がある5)。並行して行われた子宮摘出者に対する試験の結果、結合型エストロゲン単独投与群では、乳癌になる危険性がプラセボ投与群と比較して有意差はない(ハザード比:0.80)との報告がある6)7)。[8.1参照]
(2)英国における疫学調査(Million Women Study[MWS])の結果、卵胞ホルモン剤と黄体ホルモン剤を併用している女性では、乳癌になる危険性が対照群と比較して有意に高くなり(2.00倍)、この危険性は、併用期間が長期になるに従って高くなる(1年未満:1.45倍、1〜4年:1.74倍、5〜9年:2.17倍、10年以上:2.31倍)との報告がある8)。[8.1参照]
(3)閉経後女性を対象とした大規模な疫学調査のメタアナリシスの結果、閉経期ホルモン補充療法(MHT)として卵胞ホルモン剤を単独投与又は卵胞ホルモン剤と黄体ホルモン剤を併用した女性は、乳癌になる危険性がMHTの期間とともに高くなり(調整リスク比[95%信頼区間]は1〜4年間の卵胞ホルモン剤と黄体ホルモン剤併用:1.60[1.52-1.69]、卵胞ホルモン剤単独:1.17[1.10-1.26]、5〜14年間の卵胞ホルモン剤と黄体ホルモン剤併用:2.08[2.02-2.15]、卵胞ホルモン剤単独:1.33[1.28-1.37])、MHT非使用者に対する調整リスク比はMHT過去使用者よりMHT現使用者の方が高かった。また、MHT過去使用者において、投与中止後も過去の投与期間に依存して乳癌になる危険性が10年以上持続する場合があるとの報告がある9)。[8.1参照]
15.1.3 HRTと冠動脈性心疾患の危険性
15.1.4 HRTと脳卒中の危険性
15.1.5 HRTと認知症の危険性
15.1.6 HRTと卵巣癌の危険性
(2)米国におけるWHI試験の結果、結合型エストロゲン・黄体ホルモン配合剤投与群において、卵巣癌になる危険性がプラセボ投与群と比較して有意ではないが、高い傾向がみられた(ハザード比:1.58)との報告がある18)。
15.1.7 HRTと胆嚢疾患の危険性
米国におけるWHI試験の結果、結合型エストロゲン・黄体ホルモン配合剤投与群において、胆嚢疾患になる危険性がプラセボ投与群と比較して有意に高くなる(ハザード比:1.59)との報告がある。並行して行われた子宮摘出者に対する試験の結果、結合型エストロゲン単独投与群では、胆嚢疾患になる危険性がプラセボ投与群と比較して有意に高くなる(ハザード比:1.67)との報告がある19)。
16. 薬物動態
16.2 吸収
16.2.1 エストラジオール吉草酸エステルは筋肉内投与後、徐々に放出され、エストラジオールと吉草酸に分かれる。血中エストラジオールは投与3〜5日後に最高濃度に達し、約4〜5日の半減期で低下した23)24)(外国人データ)。
16.2.2 テストステロンエナント酸エステルは筋肉内投与後、徐々に放出されテストステロンとエナント酸に分かれる。健康成人男子にテストステロンエナント酸エステル投与後の血中テストステロン値は投与1〜3日後に最高に達し、約3〜5日の半減期で消失した25)(外国人データ)。
16.5 排泄
18. 薬効薬理
18.1 作用機序
19. 有効成分に関する理化学的知見
19.1. テストステロンエナント酸エステル
19.2. エストラジオール吉草酸エステル
20. 取扱い上の注意
低温で白濁することがあるが、その場合は水浴中で温めて溶解後使用すること。
22. 包装
1mL 10アンプル
23. 主要文献
- 安田佳子他, 医学のあゆみ, 98 (8), 537-538, (1976)
- 安田佳子他, 医学のあゆみ, 99 (8), 611-612, (1976)
- 守隆夫, 医学のあゆみ, 95 (11), 599-602, (1975)
- Grady D,et al., Obstet Gynecol., 85 (2), 304-313, (1995) »PubMed
- Chlebowski RT,et al., JAMA., 289 (24), 3243-3253, (2003) »PubMed
- Anderson GL,et al., JAMA., 291 (14), 1701-1712, (2004) »PubMed
- Stefanick ML,et al., JAMA., 295 (14), 1647-1657, (2006) »PubMed
- Beral V,et al., Lancet., 362 (9382), 419-427, (2003) »PubMed
- Collaborative Group on Hormonal Factors in Breast Cancer, Lancet., 394, 1159-1168, (2019)
- Manson JE,et al., N Engl J Med., 349 (6), 523-534, (2003) »PubMed
- Wassertheil-Smoller S,et al., JAMA., 289 (20), 2673-2684, (2003) »PubMed
- Hendrix SL,et al., Circulation., 113 (20), 2425-2434, (2006) »PubMed
- Shumaker SA,et al., JAMA., 289 (20), 2651-2662, (2003) »PubMed
- Shumaker SA,et al., JAMA., 291 (24), 2947-2958, (2004) »PubMed
- Rodriguez C,et al., JAMA., 285 (11), 1460-1465, (2001) »PubMed
- Lacey JV Jr,et al., JAMA., 288 (3), 334-341, (2002) »PubMed
- Beral V,et al., Lancet., 369 (9574), 1703-1710, (2007) »PubMed
- Anderson GL,et al., JAMA., 290 (13), 1739-1748, (2003) »PubMed
- Cirillo DJ,et al., JAMA., 293 (3), 330-339, (2005) »PubMed
- 太田裕彦 他, 肝臓, 18, 958, (1977) »DOI
- Falk H,et al., Lancet., 2 (8152), 1120-1123, (1979) »PubMed
- 岡 輝明 他, 病理と臨床, 6 (3), 337-346, (1988)
- Dusterberg B,et al., Maturitas., 4 (4), 315-324, (1982) »PubMed
- Dusterberg B,et al., Hormone Res., 21 (3), 145-154, (1985) »PubMed
- 社内資料:男性被験者5例で42mgの重水素化テストステロン(DT)、50mgプロピオン酸DT、250mgエナント酸DTを筋注後に放出されるテストステロンおよび内因性テストステロンの血漿中濃度およびFSH血漿中濃度に対する影響
- 社内資料:薬物動態の検討に基づくテストステロン・デポー製剤の評価:Testoviron Depot 100mg製剤各成分のバイオアベイラビリティ
- 織田 明 他, 産婦人科の世界, 8 (8), 81-85, (1956)
24. 文献請求先及び問い合わせ先
文献請求先
富士製薬工業株式会社
くすり相談室
〒939-3515
富山県富山市水橋辻ヶ堂1515番地
電話:0120-956-792
FAX:076-478-0336
製品情報問い合わせ先
富士製薬工業株式会社
くすり相談室
〒939-3515
富山県富山市水橋辻ヶ堂1515番地
電話:0120-956-792
FAX:076-478-0336
26. 製造販売業者等
26.1 製造販売元
富士製薬工業株式会社
富山県富山市水橋辻ヶ堂1515番地