医薬品情報
| 総称名 | レボカバスチン |
|---|---|
| 一般名 | レボカバスチン塩酸塩 |
| 欧文一般名 | Levocabastine Hydrochloride |
| 製剤名 | レボカバスチン塩酸塩点眼液 |
| 薬効分類名 | H1ブロッカー点眼剤 |
| 薬効分類番号 | 1319 |
| ATCコード | S01GX02 |
| KEGG DRUG |
D01717
レボカバスチン塩酸塩
|
| KEGG DGROUP |
DG01482
ヒスタミンH1受容体拮抗薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年10月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| レボカバスチン点眼液0.025%「サワイ」 (後発品) | LEVOCABASTINE Ophthalmic Solution[SAWAI] | 沢井製薬 | 1319746Q1045 | 46.3円/mL |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者[15.1参照]
4. 効能または効果
アレルギー性結膜炎
6. 用法及び用量
1回1〜2滴を1日4回(朝、昼、夕方及び就寝前)点眼する。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(ラット)で、レボカバスチン80mg/kg経口投与(臨床投与量の33000倍以上に相当)により、胎児死亡及び催奇形性(多指、水頭、過剰中足骨及び無眼球)が報告されている1)。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ヒト母乳中へ移行することが報告されている。[16.5.2参照]
9.7 小児等
低出生体重児、新生児、乳児、幼児を対象とした臨床試験は実施していない。
10. 相互作用
10.2 併用注意
| オキシメタゾリン | 本剤の吸収が低下する可能性がある。 | 機序不明 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(頻度不明)
呼吸困難、顔面浮腫等があらわれることがある。
11.2 その他の副作用
| 0.5%以上 | 0.5%未満 | 頻度不明 | |
| 眼 | 眼刺激 | 眼瞼炎、眼脂、眼球乾燥感、羞明、そう痒感 | 角膜上皮障害(角膜びらん、点状表層角膜炎等)、結膜充血、霧視(感)、結膜炎、眼瞼浮腫、眼痛、流涙 |
| 免疫系 | 血管神経性浮腫 | ||
| 皮膚 | 接触皮膚炎、蕁麻疹 | ||
| 循環器 | 動悸 | ||
| 精神神経系 | 頭痛、眠気 |
14. 適用上の注意
14.1 薬剤交付時の注意
患者に対し以下の点に注意するよう指導すること。
・本剤はベンザルコニウム塩化物を含有するため、含水性ソフトコンタクトレンズ装用時の点眼は避けること。
・本剤は懸濁液のため、使用の際にはその都度容器をよく振盪すること。
・点眼したときに液が眼瞼皮膚等についた場合は、すぐにふき取ること。
・薬液汚染防止のため、点眼のとき、容器の先端が直接目に触れないように注意すること。
・点眼に際しては、原則として仰臥位をとり、患眼を開瞼して結膜のう内に点眼し、1〜5分間閉瞼して涙のう部を圧迫させた後、開瞼すること。
・他の点眼剤を併用する場合には、少なくとも5分以上間隔をあけてから点眼すること。
15. その他の注意
15.1 臨床使用に基づく情報
本剤の保存剤であるベンザルコニウム塩化物による過敏症が知られている。[2.参照]
16. 薬物動態
16.1 血中濃度
16.1.1 反復投与
健康成人に0.05%レボカバスチン塩酸塩点眼液を両眼に1滴ずつ(レボカバスチン塩酸塩として30μg)6時間間隔で1日3回注)、11日間反復投与したとき、血漿中未変化体濃度は投与5日目には定常状態に達し、蓄積性は認められなかった。最終投与後のCmaxは0.94ng/mL、消失半減期は約41時間であった2)。
16.4 代謝
健康成人に3H-レボカバスチン塩酸塩(レボカバスチンとして1mg)を単回経口投与注)したとき、尿中放射活性の大部分は未変化体であり、主代謝物はレボカバスチンのグルクロン酸抱合体であった3)。(外国人データ)
16.5 排泄
16.5.1 健康成人に0.05%レボカバスチン塩酸塩点眼液を両眼に1滴ずつ(レボカバスチン塩酸塩として30μg)6時間間隔で1日3回注)、11日間反復投与したとき、最終投与後96時間までに総点眼量の約16%が未変化体として尿中へ排泄された2)。
16.8 その他
16.8.1 生物学的同等性試験
結膜中薬物滞留性(ウサギ)
ウサギの片眼にレボカバスチン点眼液0.025%「サワイ」又はリボスチン点眼液0.025%をそれぞれ50μL点眼した後、0.5、1、3、8、24時間における結膜中レボカバスチン塩酸塩濃度を測定した。測定値を用いて統計解析を行ったところ、各測定時点における両剤の結膜中レボカバスチン塩酸塩濃度に有意な差は認められなかった5)。
| 投与後の時間(hr) | |||||
| 0.5 | 1 | 3 | 8 | 24 | |
| レボカバスチン点眼液0.025%「サワイ」 | 199.2±52.5 | 99.2±45.6 | 76.5±21.1※ | 25.2±13.1 | 13.9±1.6 |
| リボスチン点眼液0.025% | 211.9±48.6※ | 105.9±29.3 | 97.3±25.0 | 28.7±14.6 | 7.8±3.3 |
注)本剤の濃度は0.025%であり、本剤の承認された用法及び用量は、「1回1〜2滴を1日4回(朝、昼、夕方及び就寝前)点眼する。」である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
18. 薬効薬理
18.1 作用機序
ヒスタミンH1受容体に特異的に働き、強力かつ持続的な拮抗作用を有し、アレルギー性結膜炎におけるそう痒感、充血、流涙などの諸症状を改善する。
18.2 抗ヒスタミン作用
18.2.2 モルモットでのヒスタミン静注致死及びヒスタミン吸入呼吸困難を抑制する(in vivo)13)。
18.2.3 ラットでのcompound48/80誘発致死を抑制する(in vivo)14)。
18.3 実験的アレルギー性結膜炎モデルに対する作用
18.4 好中球及び好酸球の遊走抑制作用(点眼投与)
ヒスタミン誘発によるモルモット結膜への好中球及び好酸球の遊走を抑制する(in vivo)19)。
18.5 生物学的同等性試験
18.5.1 ラット受動感作アレルギー性結膜炎モデルを用い、レボカバスチン点眼液0.025%「サワイ」とリボスチン点眼液0.025%の抗アレルギー作用について、薬剤をアレルギー反応惹起15分前に点眼し、結膜への色素漏出量を指標として比較検討したところ、両剤に有意な差は認められず、両剤の生物学的同等性が確認された5)。
| 抽出色素の吸光度 | |
| レボカバスチン点眼液0.025%「サワイ」 | 0.1414±0.0041 |
| リボスチン点眼液0.025% | 0.1393±0.0069 |
18.5.2 モルモットのヒスタミン誘発結膜炎モデルを用い、レボカバスチン点眼液0.025%「サワイ」とリボスチン点眼液0.025%の抗アレルギー作用について、薬剤をヒスタミンによる結膜炎惹起15分前に点眼することで予防効果を、惹起5分後及び10分後の2回点眼することで治療効果を比較検討した。惹起された結膜炎の程度を観察(スコア化)し、コントロール群のスコア値に対する比率から抑制率を算出した。その結果、いずれの試験においても両剤に有意な差は認められず、両剤の生物学的同等性が確認された5)。
| 抑制率(%) | ||
| 予防効果 (n=8) | レボカバスチン点眼液0.025%「サワイ」 | 70.4±3.29 |
| リボスチン点眼液0.025% | 67.1±4.30 | |
| 治療効果 (n=14) | レボカバスチン点眼液0.025%「サワイ」 | 41.8±2.99 |
| リボスチン点眼液0.025% | 41.8±2.99 |
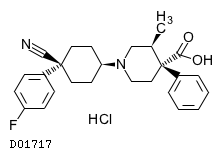
19. 有効成分に関する理化学的知見
19.1. レボカバスチン塩酸塩
20. 取扱い上の注意
20.1 本剤は、保管の仕方によっては振り混ぜても粒子が分散しにくくなる場合があるので、上向きに保管すること。
20.2 小児の手の届かない所に保管すること。
22. 包装
プラスチック点眼容器
5mL×10本
23. 主要文献
- wistar系ラットにおける胎児毒性及び催奇形性試験(segment ii)帝王切開及び自然分娩試験並びに次世代試験 投与経路:強制経口投与(リボスチン点眼液:2000年9月22日承認、申請資料概要ニ3.(2).1)
- 澤充他, 薬理と治療, 22, 4697-4711, (1994)
- ヒトに単回経口投与したときのlevocabastineの吸収、排泄及び代謝(リボスチン点眼液:2000年9月22日承認、申請資料概要ヘ3.(1).2).[1])
- ヒト乳汁中へのlevocabastineの排泄(リボスチン点眼液:2000年9月22日承認、申請資料概要ヘ3.(1).2).[3])
- 社内資料:生物学的同等性試験
- 澤充他, あたらしい眼科, 12, 317-332, (1995)
- 澤充他, あたらしい眼科, 12, 333-350, (1995)
- 澤充他, あたらしい眼科, 11, 1893-1902, (1994)
- 澤充他, あたらしい眼科, 11, 1903-1912, (1994)
- 国内臨床試験(リボスチン点眼液:2009年12月21日公表、再審査報告書)
- Tasaka,K.et al., Arzneim.-Forsch./Drug Res., 43, 1331-1337, (1993) »PubMed
- 塩酸レボカバスチンの抗ヒスタミン(H1)作用の選択性:in vitroでの気管支収縮に対する抑制効果(リボスチン点眼液:2000年9月22日承認、申請資料概要ホ5.(1))
- モルモットにおける塩酸レボカバスチンのin vivoでの抗ヒスタミン作用、抗セロトニン作用及び抗コリン作用:対照薬との比較(リボスチン点眼液:2000年9月22日承認、申請資料概要ホ2.(1).3)
- Dechant,K.L.et al., Drugs, 41, 202-224, (1991) »PubMed
- Kamei,C.et al., J.Pharmacobio-Dyn., 14, 467-473, (1991) »PubMed
- 亀井千晃他, あたらしい眼科, 11, 603-605, (1994)
- モルモットにおけるヒスタミン及び抗原誘発結膜炎に対するレボカバスチン局所投与の作用(リボスチン点眼液:2000年9月22日承認、申請資料概要ホ1.(2))
- 実験的アレルギー性結膜炎ならびに鼻炎に対する塩酸levocabastineの影響(リボスチン点眼液:2000年9月22日承認、申請資料概要ホ1.(3).2),ホ1.(4).2))
- モルモットにおけるhistamine誘発による好中球および好酸球の結膜への浸潤に対する塩酸levocabastine点眼薬の作用(リボスチン点眼液:2000年9月22日承認、申請資料概要ホ1.(6))
24. 文献請求先及び問い合わせ先
文献請求先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
製品情報問い合わせ先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
26. 製造販売業者等
26.1 製造販売元
沢井製薬株式会社
大阪市淀川区宮原5丁目2-30