医薬品情報
| 総称名 | オダイン |
|---|---|
| 一般名 | フルタミド |
| 欧文一般名 | Flutamide |
| 製剤名 | フルタミド製剤 |
| 薬効分類名 | 前立腺癌治療剤 |
| 薬効分類番号 | 4291 |
| ATCコード | L02BB01 |
| KEGG DRUG |
D00586
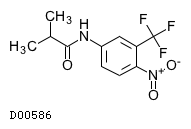
フルタミド
|
| KEGG DGROUP |
DG01591
アンドロゲン受容体拮抗薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2021年10月 改訂(第1版)

|
1.警告 2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| オダイン錠125mg | Odyne Tablets 125mg | 日本化薬 | 4291005F1057 | 101.3円/錠 | 劇薬, 処方箋医薬品注) |
1. 警告
2. 禁忌
次の患者には投与しないこと
2.1 肝障害のある患者[9.3参照]
2.2 本剤に対する過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
通常成人にはフルタミドとして1回125mgを1日3回、食後に経口投与する。なお、症状により適宜増減する。
8. 重要な基本的注意
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 薬物過敏症の既往歴のある患者
9.3 肝機能障害患者
肝障害のある患者には投与しないこと。重篤な肝障害に至るおそれがある。[2.1参照]
9.8 高齢者
患者の状態を観察しながら用量に留意して慎重に投与すること。本剤の臨床試験成績から、高齢者と非高齢者において副作用の発現率及びその程度に差がみられていないが、本剤は主として肝臓で代謝されており、高齢者では肝機能等の生理機能が低下していることが多く高い血中濃度が持続するおそれがある。
10. 相互作用
10.2 併用注意
| ワルファリン | ワルファリンの抗凝固作用を増強するとの報告がある。 | 機序不明 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 重篤な肝障害(頻度不明)
11.1.2 間質性肺炎(頻度不明)
発熱、咳嗽、呼吸困難、胸部X線異常、好酸球増多等を伴う間質性肺炎があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.3 心不全、心筋梗塞(頻度不明)
11.2 その他の副作用
| 10%以上 | 1〜10%未満 | 1%未満 | 頻度不明 | |
| 肝臓 | AST上昇、ALT上昇 | γ-GTP上昇、Al-P上昇 | LDH上昇 | ビリルビン上昇 |
| 内分泌系 | 女性型乳房(22.2%) | ポテンツ低下 | ||
| 消化器 | 悪心・嘔吐、下痢 | 食欲不振 | 胸やけ、胃痛、胃部不快感、口渇 | |
| 血液 | 白血球減少 | 貧血、血小板減少 | ||
| 腎臓 | BUN上昇、尿蛋白陽性 | クレアチニン上昇 | ||
| 精神神経系 | めまい | ふらつき、立ちくらみ、頭痛、脱力感、傾眠、不眠、混乱、うつ状態、不安感、神経過敏症 | ||
| 過敏症 | 発疹、光線過敏症 | |||
| 皮膚 | そう痒 | |||
| その他 | 尿糖陽性、血清総蛋白減少 | 浮腫、全身倦怠感、発熱、潮紅、発汗、味覚障害、血糖値上昇 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
本剤の投与により尿が琥珀色又は黄緑色を呈することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
前立腺癌患者にフルタミド125mgを単回経口投与したとき、フルタミドは速やかに吸収され、ほとんどは活性代謝物OH-フルタミドとして血中に存在した。OH-フルタミドは投与後2時間で最高濃度に達した後、半減期13.9時間で消失した。フルタミド30〜500mgを単回経口投与したとき、OH-フルタミドのCmax及びAUCは、投与量に依存した線形性が認められた1)。
フルタミド単回経口投与時の血漿中濃度
(投与量:125mg,n=3,平均値)
16.1.2 反復投与
前立腺癌患者にフルタミド125mgを1日3回、14日間反復投与したとき、OH-フルタミドは2〜4日目以降で定常状態に達した2)。
16.3 分布
ヒト血漿に14C-フルタミドを200ng/mL添加したときの血漿蛋白結合率は99.1%であり、OH-フルタミドを1000ng/mL添加したときの血漿蛋白結合率は94.1%であった3)。
16.4 代謝
前立腺癌患者の血漿中にはOH-フルタミド及び未変化体が認められ、血中主代謝物はOH-フルタミドであった。尿中代謝物は、ほとんどがグルクロン酸抱合体の形で存在した4)。
16.5 排泄
ヒトにおける主排泄経路は尿と考えられるが、排泄率は8.6〜84.0%と個体差が大きかった4)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内前期第II相試験(用量設定試験)
17.1.2 国内後期第II相試験(二重盲検比較試験)
17.2 製造販売後調査等
17.2.1 国内市販後第III相臨床試験
未治療の進行前立腺癌(臨床病期D)患者を対象とした本剤(375mg/日投与又は250mg/日投与注))とLH-RHアゴニストとの併用投与群とLH-RHアゴニスト単独投与群の無作為化比較試験の結果は以下のとおりであった。
| 評価項目\薬剤投与群 | 本剤とLH-RHアゴニストとの併用投与群 | LH-RHアゴニスト単独投与群 | 検定結果 | |
| 全生存期間 | (107例) | (53例) | Log-Rank P=0.2053 G.Wilcoxon P=0.0869 | |
| 中央値 | 1841日 | 1530日 | ||
| 95%信頼区間 | 1594日〜 | 1124日〜 | ||
| 非再燃期間 | (107例) | (53例) | Log-Rank P=0.0021 G.Wilcoxon P=0.0013 | |
| 中央値 | 572日 | 334日 | ||
| 95%信頼区間 | 401日〜1094日 | 243日〜417日 | ||
| 抗腫瘍効果(総合判定) | χ2検定 P=0.0094 | |||
| 奏効率 | 70.1%(75/107例) | 49.1%(26/53例) | ||
| 95%信頼区間 | 60.5%〜78.6% | 35.1%〜63.2% | ||
| 安全性(副作用発現症例率) | χ2検定 P=0.1400 P=0.3502 | |||
| 自覚症状・他覚所見 | 42.2%(46/109例) | 30.2%(16/53例) | ||
| 臨床検査値異常 | 60.6%(66/109例) | 52.8%(28/53例) | ||
なお、本剤375mg/日投与と250mg/日投与注)の間には、上記評価項目において差はなかった。
注)本剤の承認された用法及び用量は「通常成人にはフルタミドとして1回125mgを1日3回、食後に経口投与する。なお、症状により適宜増減する」である。
18. 薬効薬理
18.1 作用機序
OH-フルタミドが前立腺癌組織のアンドロゲンレセプターに対するアンドロゲンの結合を阻害することにより、抗腫瘍効果を発揮するものと考えられる。
18.2 アンドロゲンレセプターとの結合能(in vitro)
ラット前立腺癌細胞(R3327-G)中のアンドロゲンレセプターを用いた試験において、フルタミドの主活性代謝物であるOH-フルタミドはジヒドロテストステロンの約200倍の濃度で合成アンドロゲン剤のアンドロゲンレセプターに対する結合を50%阻害した7)。
18.3 抗腫瘍効果(in vivo)
フルタミドはヌードマウスに移植したアンドロゲン依存性ヒト前立腺癌細胞(HONDA)及びラット前立腺癌細胞(R3327-G)の増殖を抑制した8)。
19. 有効成分に関する理化学的知見
19.1. フルタミド
22. 包装
100錠[10錠(PTP)×10]
23. 主要文献
- 社内資料:単回投与試験
- 社内資料:反復投与試験
- 社内資料:血漿たん白結合
- 社内資料:尿中代謝物の検索と排泄
- 阿曽佳郎ほか, 泌尿紀要, 39, 391-403, (1993)
- Akaza H,et al., Jpn J Clin Oncol., 23, 178-185, (1993) »PubMed
- 黒岩俊介ほか, 基礎と臨床, 29, 877-885, (1995)
- 黒岩俊介ほか, 基礎と臨床, 29, 887-897, (1995)
24. 文献請求先及び問い合わせ先
文献請求先
日本化薬株式会社
医薬品情報センター
〒100-0005
東京都千代田区丸の内二丁目1番1号
電話:0120-505-282
製品情報問い合わせ先
日本化薬株式会社
医薬品情報センター
〒100-0005
東京都千代田区丸の内二丁目1番1号
電話:0120-505-282
26. 製造販売業者等
26.1 製造販売元
日本化薬株式会社
東京都千代田区丸の内二丁目1番1号