医薬品情報
| 総称名 | エバスチン |
|---|---|
| 一般名 | エバスチン |
| 欧文一般名 | Ebastine |
| 薬効分類名 | 持続性選択H1受容体拮抗剤 |
| 薬効分類番号 | 4490 |
| ATCコード | R06AX22 |
| KEGG DRUG |
D01478
エバスチン
|
| KEGG DGROUP |
DG01482
ヒスタミンH1受容体拮抗薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年9月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 12.臨床検査結果に及ぼす影響 14.適用上の注意 16.薬物動態 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| エバスチン錠5mg「タカタ」 (後発品) | Ebastine Tablets"TAKATA" | 高田製薬 | 4490019F1125 | 17.4円/錠 | |
| エバスチン錠10mg「タカタ」 (後発品) | Ebastine Tablets"TAKATA" | 高田製薬 | 4490019F2121 | 21.9円/錠 | |
| エバスチンOD錠5mg「タカタ」 (後発品) | Ebastine OD Tablets"TAKATA" | 高田製薬 | 4490019F3128 | 17.4円/錠 | |
| エバスチンOD錠10mg「タカタ」 (後発品) | Ebastine OD Tablets"TAKATA" | 高田製薬 | 4490019F4124 | 21.9円/錠 |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
通常、成人には、エバスチンとして1回5〜10mgを1日1回経口投与する。
なお、年齢・症状により適宜増減する。
なお、年齢・症状により適宜増減する。
7. 用法及び用量に関連する注意
高齢者では、1日1回5mgから投与するなど注意すること。[9.8参照]
8. 重要な基本的注意
<効能共通>
8.1 眠気を催すことがあるので、本剤投与中の患者には自動車の運転など危険を伴う機械の操作に注意させること。
<アレルギー性鼻炎>
8.2 季節性の患者に投与する場合は、好発季節を考えて、その直前から投与を開始し、好発季節終了時まで続けることが望ましい。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 長期ステロイド療法を受けている患者
本剤投与によりステロイドの減量をはかる場合は、十分な管理下で徐々に行うこと。
9.3 肝機能障害患者
9.3.1 肝機能障害又はその既往歴のある患者
肝機能異常があらわれるおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中への移行が報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を十分に観察しながら投与すること。一般に生理機能が低下している。[7.参照]
10. 相互作用
相互作用序文
本剤は、主として代謝酵素CYP2J2及びCYP3A4で代謝される。[16.4.1参照]
薬物代謝酵素用語
CYP2J2
薬物代謝酵素用語
CYP3A4
10.2 併用注意
| エリスロマイシン [16.7.1参照] | 本剤の代謝物カレバスチンの血漿中濃度が約2倍に上昇することが報告されている。 | カレバスチンの代謝が抑制されると考えられる。 |
| イトラコナゾール | 本剤の代謝物カレバスチンの血漿中濃度が上昇することが報告されている。 | カレバスチンの代謝が抑制されると考えられる。 |
| リファンピシン | 本剤の代謝物カレバスチンの血漿中濃度が低下することが報告されている。 | カレバスチンの代謝が促進されると考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
血圧低下、呼吸困難、喉頭浮腫等の症状が認められた場合には、投与を中止し、適切な処置を行うこと。
11.1.2 肝機能障害、黄疸(いずれも頻度不明)
AST、ALT、LDH、γ-GTP、ALP、ビリルビンの上昇等を伴う肝機能障害、黄疸があらわれることがある。
11.2 その他の副作用
| 1%以上 | 0.1〜1%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | 発疹、浮腫、じん麻疹 | |||
| 循環器 | 動悸 | 血圧上昇 | ||
| 精神神経系 | 眠気、倦怠感 | 頭痛、めまい、しびれ感 | 不眠 | |
| 消化器 | 口渇 | 胃部不快感、鼻・口腔内乾燥 | 下痢、舌炎 | 嘔気・嘔吐、腹痛 |
| 肝臓 | AST、ALT、LDH、γ-GTP、ALP、ビリルビンの上昇 | |||
| 泌尿器 | 排尿障害、頻尿 | |||
| その他 | 胸部圧迫感 | ほてり | 好酸球増多、体重増加、月経異常、脱毛、味覚異常、BUNの上昇、尿糖 |
12. 臨床検査結果に及ぼす影響
本剤はアレルゲン皮内反応を抑制するため、アレルゲン皮内反応検査を実施する前は、本剤を投与しないこと。
14. 適用上の注意
14.1 薬剤交付時の注意
<製剤共通>
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
<OD錠>
14.1.2 本剤は舌の上にのせて唾液を湿潤させると崩壊するため、水なしで服用可能である。また、水で服用することもできる。
16. 薬物動態
16.1 血中濃度
16.1.1 生物学的同等性試験
(1)エバスチン錠5mg「タカタ」
エバスチン錠5mg「タカタ」とエバステル錠5mgをクロスオーバー法により、健康成人男子14名にそれぞれ1錠(エバスチンとして5mg)を空腹時に単回経口投与し、投与前、投与後2、4、5、6、7、8、10、12、24、48及び72時間に前腕静脈から採血した。LC/MS/MSにより測定したカレバスチン(エバスチンの代謝物)の血漿中濃度の推移及びパラメータは次のとおりであり、統計解析にて90%信頼区間を求めた結果、判定パラメータの対数値の平均値の差はlog0.8〜log1.25の範囲にあり、両剤の生物学的同等性が確認された1)。
図16-1 血漿中濃度(錠5mg)
| 判定パラメータ | 参考パラメータ | |||
| AUCt(ng・hr/mL) | Cmax(ng/mL) | tmax(hr) | t1/2(hr) | |
| エバスチン錠5mg「タカタ」 | 1099.5±271.2 | 45.0±13.0 | 6.1±1.4 | 16.9±2.7 |
| エバステル錠5mg | 1052.2±278.6 | 45.8±11.1 | 5.4±1.4 | 16.7±2.3 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
(2)エバスチン錠10mg「タカタ」
エバスチン錠10mg「タカタ」とエバステル錠10mgをクロスオーバー法により、健康成人男子14名にそれぞれ1錠(エバスチンとして10mg)を空腹時に単回経口投与し、投与前、投与後2、4、5、6、7、8、10、12、24、48及び72時間に前腕静脈から採血した。LC/MS/MSにより測定したカレバスチン(エバスチンの代謝物)の血漿中濃度の推移及びパラメータは次のとおりであり、統計解析にて90%信頼区間を求めた結果、判定パラメータの対数値の平均値の差はlog0.8〜log1.25の範囲にあり、両剤の生物学的同等性が確認された1)。
図16-2 血漿中濃度(錠10mg)
| 判定パラメータ | 参考パラメータ | |||
| AUCt(ng・hr/mL) | Cmax(ng/mL) | tmax(hr) | t1/2(hr) | |
| エバスチン錠10mg「タカタ」 | 2790.2±1168.8 | 102.4±39.7 | 7.0±2.1 | 18.7±3.2 |
| エバステル錠10mg | 2760.6±953.8 | 105.8±30.8 | 5.9±1.3 | 18.9±2.8 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.4 代謝
16.7 薬物相互作用
16.7.1 エリスロマイシン
16.8 その他
16.8.1 エバスチンOD錠5mg「タカタ」
「経口固形製剤の処方変更の生物学的同等性試験ガイドライン」に基づき、エバスチンOD錠5mg「タカタ」と旧処方製剤[ヒトを対象とした生物学的同等性試験により同等性が確認されている。]の溶出挙動を比較したところ、両剤の溶出挙動は同等と判断され、両剤は生物学的に同等とみなされた5)。
16.8.2 エバスチンOD錠10mg「タカタ」
「経口固形製剤の処方変更の生物学的同等性試験ガイドライン」に基づき、エバスチンOD錠10mg「タカタ」と旧処方製剤[ヒトを対象とした生物学的同等性試験により同等性が確認されている。]の溶出挙動を比較したところ、両剤の溶出挙動は同等と判断され、両剤は生物学的に同等とみなされた6)。
18. 薬効薬理
18.1 作用機序
エバスチンはヒスタミンH1受容体遮断薬。H1受容体を介するヒスタミンによるアレルギー性反応を抑制する。
これに加えて、ケミカルメディエーター遊離抑制作用を有する点が、古典的抗ヒスタミン薬とは異なる。
なお、本薬の作用の大部分は活性代謝物のカレバスチンの作用である7)。
これに加えて、ケミカルメディエーター遊離抑制作用を有する点が、古典的抗ヒスタミン薬とは異なる。
なお、本薬の作用の大部分は活性代謝物のカレバスチンの作用である7)。
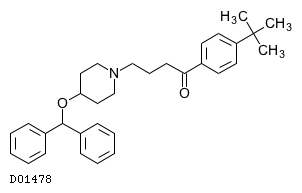
19. 有効成分に関する理化学的知見
19.1. エバスチン
20. 取扱い上の注意
<OD錠>
アルミピロー開封後は遮光して保存すること。
22. 包装
<エバスチン錠5mg「タカタ」>
100錠[10錠(PTP)×10]
<エバスチン錠10mg「タカタ」>
100錠[10錠(PTP)×10]
<エバスチンOD錠5mg「タカタ」>
100錠[10錠(PTP)×10]
<エバスチンOD錠10mg「タカタ」>
100錠[10錠(PTP)×10]
23. 主要文献
- 社内資料:生物学的同等性試験(エバスチン錠5mg「タカタ」、エバスチン錠10mg「タカタ」)
- 橋爪孝典, Progress in Medicine., 23, 282-287, (2003)
- Hashizume T.,et al., J.Pharmacol.Exp.Ther., 300, 298-304, (2002) »PubMed
- 長澤絋一ほか, 臨床医薬, 11, 1213-1226, (1995)
- 社内資料:生物学的同等性試験(エバスチンOD錠5mg「タカタ」)
- 社内資料:生物学的同等性試験(エバスチンOD錠10mg「タカタ」)
- 日本薬局方解説書編集委員会編, 第十八改正 日本薬局方解説書, C-993-997, (2021)
24. 文献請求先及び問い合わせ先
文献請求先
高田製薬株式会社
文献請求窓口
〒336-8666
さいたま市南区沼影1丁目11番1号
電話:0120-989-813
FAX:048-816-4183
製品情報問い合わせ先
高田製薬株式会社
文献請求窓口
〒336-8666
さいたま市南区沼影1丁目11番1号
電話:0120-989-813
FAX:048-816-4183
26. 製造販売業者等
26.1 製造販売元
高田製薬株式会社
さいたま市西区宮前町203番地1